Respuesta Orgánica a la Sepsis, Manifestaciones
Se han descrito también una serie de criterios para definir el cuadro de sepsis, en donde la evidencia de infeccción se encuentra representada por el aislamiento mediante cultivo, o coloración de gérmenes en la sangre o los tejidos (6).
1. Evidencia de Infeccción Bacteriana
Hemocultivos positivos o cultivos positivos para gérmenes en el sitio de la infección.
2. Manifestaciones Sépticas del Huésped
2. 1. Alteración de la temperatura, hipo o hipertermia
2. 2. Taquicardia> 90 latidos/minuto
2. 3. Polipnea > 20 respiraciones/minuto.
2. 4. Evidencia de compromiso hemodinámico representada por
2.4.1. Hipotensión < 90 mmHg de TA sistólica.
2.4.2. Indice cardíaco elevado> 4 L/minuto
2.4.3. Resistencias vasculares bajas < 800 dinas/cm
2. 5. Dos o más manifestaciones de hipoperfusión:
2.5.1. Acidosis metabólica (pH < 7.8, Lactato> 25 mmoll, Déficit de base> 5 mmol)
2.5.2. Hipoxia < 75 mm 02 a nivel del mar
2.5.3.Insuficiencia renal
2.5.4. Manifestaciones de falla hepática. Bilirrubinas 2 veces la basal
2.5.5. Coagulopatía (Aumento de PT y PTT, plaquetas < 100.000)
2.5.6. Alteraciones del sensorio
Activación de Mediadores
Uno de los modelos mejor estudiados es el de la sepsis por Gram negativos y es necesario analizar algo de la estructura de estos gérmenes y dentro de ella, la cápsula exterior que contiene la fracción LPS o de lipolisacárido en gran parte responsable de las respuestas orgánicas a la sepsis; . se encuentra conformada por tres componentes:
l. La fracción de polisacáridos que constituye el “Antígeno O”, responsable de la variedad de serotipos que se encuentran dentro del grupo de bacterias Gram negativas.
2. Se une al “Core”, fracción lipopolisacárida de alta complejidad que la une
3. Al “Lípido A” que es el responsable de gran parte de la toxicidad de los gérmenes Gram negativos (7).
Esta LPS interactúa con la membrana celular de los mamíferos por varios receptores (6, 7):
a) Con el receptor CD I I-CD 18 responsable de la lesión del endotelio
b) Con el receptor CD 14 que liga el complejo LPS. LBP al macrófago
c) Acetilando las LO I receptores de detoxicantes
d) Interactuando con otras proteínas
e) Interactuando con las lipoproteínas de la membrana celular.
El LPS puede producirse por el simple fraccionamiento de la membrana durante la replicación bacteriana o por la destrucción de la misma por la acción de los antibióticos. Cuando éstos son administrados la muerte bacteriana determina un rápido aumento en la sangre de endotoxina libre que refleja la destrucción de la membrana celular y la liberación de depósitos intracelulares de endotoxina. En conejos sometidos a sepsis con Escherichia coli se han podido determinar incrementos hasta 2.000 veces sobre la basal, luego de ser sometidos a terapia con gentamicina (8). En humanos afectados por sepsis por Gram negativos, se han detectado incrementos de endotoxina hasta 50 veces mayores luego de la aplicación intravenosa de antibióticos (9).
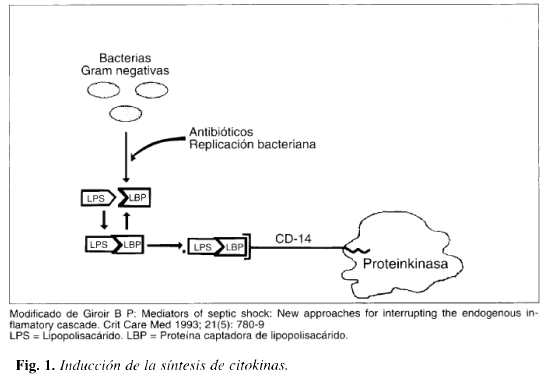
La endotoxina sola no genera los cambios hemodinámicos observados durante la sepsis; requiere de la interacción del lipopolisacárido y los mecanismos inmunológicos del huésped para la liberación de citoquinas y la subsecuente aparición del cuadro de shock séptico (6). El lipopolisacárido LPS se une a una lipoproteína captadora del lipopolisacárido BP que aumenta hasta 100 veces la acción del lipopolisacárido solo. Este complejo (LPS-LBPl se une al receptor CD 14 presente en las células del sistema monomacrófago en donde, mediante la acción de una proteínkinasa, se inicia la síntesis del Factor de Necrosis Tumoral (FNT), por medio de reacciones de transcripción y traslación de genes mensajeros preformados de FNT; esto determina la formación de monómeros de FNT, que a través de reacciones de clivage, trimerización y secreción, forman fracciones de FNT maduro ( 10) (Fig. 1).
Este FNT es sintetizado por los macrófagos; el hígado contiene más del 80% de los macrófagos del cuerpo (11) Y los monocitos, como una respuesta de defensa del organismo a la infección, tiene múltiples repercusiones biológicas; una de ellas es la de amplificar las respuestas inflamatorias; induce la liberación de otra serie de citoquinas a las que les ha prestado especial atención: IL-I con la cual se superpone o coincide (12). IL-6, IL-8, Interferón Gama, mediadores que se autoestimulan unos a otros en nivel tisular e intravascular generando una cadena de acciones incontrolada, responsable de buena parte de la cadena de . eventos que ocurren durante el cuadro de sepsis. Este se inicia, entonces, a partir de un foco infeccioso, sitio en donde innicialmente proliferan los microorganismos; éstos liberan toxinas endógenas, que viajan con el microorganismo al invadir el sistema circulatorio, o que pueden liberarse como exotoxinas a partir del lipopolisacárido de la membrana celular de la bacteria.
Estas toxinas endógenas, provocan la liberación de mediadores propios del huésped, a partir de células del sistema hematológico e inmune, particularmente los macrófagos y los monocitos.
Como resultado final se produce una lesión del endotelio y de la célula miocárdica, con las manifestaciones clínicas de respuesta sistémica; la infección puede progresar a sepsis y causar alteraciones de la perfusión con hipotensión, shock séptico y falla orgánica múltiple.
Activación del complemento
Pero además de la activación de la cascada de las citoquinas, la LPS activa también las cascadas de la coagulación y la fibrinólisis, el complemento, específicamente las fracciones C3a y CSa responsables de la quimiotaxis y activación de los macrófagos, la cadena del ácido araquidónico y aumenta la producción de radicales oxidados producidos durante la fagocitosis por parte de los neutrófilos y macrófagos.
El complemento se puede activar por dos vías: mediante una reacción antígeno-anticuerpo o por la vía alterna del sistema de la properdina que puede ser activada por la acción de la cápsula bacteriana, específicamente por el lípido A; las dos van al paso C3a que aumenta la adhesión de los linfocitos, macrófagos y polimorfonucleares a la célula bacteriana. Al activarse la quimiotaxis, los polimorfonucleares son atraídos al área, iniciándose la adhesión de los neutrófilos y el inicio del ataque a la membrana estimulada por la fracción C3b. El complejo CS678 del complemento permite la lisis lenta de la membrana (13).
Radicales libres de oxígeno
En situaciones estables y de normalidad, los átomos presentan sus orbitales pareados dando poca oportunidad de reacción. Por el contrario, en situaciones de inestabilidad, y de reperfusión posisquemia es una de ellas, los radicales libres pueden ser receptores o dadores de electrones; dentro de los radicales de oxígeno son importantes el superóxido, el peróxido de hidrógeno y los radicales oxhidrilo, alcoxi y peroxi (4); ellos reaccionan con los elementos de la membrana celular, carbono, hidrógeno y nitrógeno mediante reacciones de oxidación y reducción.
Dentro de los efectos de los radicales Iibires u oxidantes se han descrito; 1) Alteración de la permeabilidad vascular. 2) Oxidación de los lípidos de la membrana celular que alteran su función. 3) Iniciación y perpetuación de las reacciones inflamatorias en nivel local y sistémico. 4) Ruptura de la matriz intersticial. 5) Alteración de la actividad fagocítica del macrófago. 6) Alteración del ONA celular. 7) Iniciación del metabolismo del ácido araquidónico. 8) Hemólisis de glóbulos rojos (15, 16).
La célula endotelial expuesta a la lesión posisquemia-reperfusión e hipoxia, presenta una rápida disminución en las concentraciones de ATP, hay aumento de AMP, adenosina, inosina e hipoxantina, con aumento de la relación xantinooxidasa/xantinodeshidrogenasa (4). (En situaciones de normalidad, esta enzima se sintetiza primordialmente bajo la forma D).
El aumento de xantinooxidasa e hipoxantina a expensas del metabolismo de las xantinas, produce aumentos importantes
en las concentraciones de radicales libres de oxígeno, oxidantes o reductores, que producen lesión de ambas membranas (neutrófilo y célula endotelial), aumentando la adhesión e incrementando la quimiotaxis.
Con la disminución de la concentración de oxígeno y de ATP intracelular. la permeabilidad de la membrana se altera, la entrada del calcio (17) hace que la xantinodeshidrogenasa se convierta en xantinooxidasa que en presencia de oxígeno durante la reperfusión, genera la producción de más radicales libres de oxígeno. Adicionalmente. el aumento en la concentración intracelular de adenosina produce vasodilatación local que puede explicar parcialmente la baja de las resistencias vasculares observadas en la sep-SIS.
Activación de los Neutrófilos
Para que la lesión del endotelio se produzca. se requiere a adhesión del neutrófilo. Cuando esto ocurre, se establece un medio ambiente común entre la célula endotelial y el neutrófilo; en este micromedio ambiente. las proteasas liberadas por el neutrófilo y los radicales libres de oxígeno, actúan de manera simultánea, determinando una lesión de la célula endotelial. facilitando la aparición de edema y trombosis (18). En adición a la adhesión. la agregación entre los neutrófilos juega un papel importante en la oclusión y trombosis de las vénulas poscapilares durante la activación generalizada, lo que determina isquemia.
La adhesión y agregación de los neutrófilos está mediada por una glicoproteína. el complejo CO ll-CO 18. Este complejo está compuesto de tres dímeros con tres cadenas alfa (CO II a, CO II b. CO II c) enlazado a una cadena beta común (CO 18). Estas subunidades interactúan con el endotelio celular. determinando la adhesión del neutrófilo al endotelio. El empleo experimental de anticuerpos monoclonales contra esta glicoproteína, reduce sustancialmente la adhesión de los neutrófilos en modelos de isquemia mesentérica y situaciones posreperfusión post shock hemorrágico, disminuyendo el cuadro de respuesta inflamatoria sistémica (19).
Esta activación de los polimorfonucleares neutrófilos es importante como productora de efectores celulares, esenciales para la protección contra infecciones por bacterias y hongos, en donde la producción de inmunoglobulinas y factores del complemento actúan como opsoninas y facilitan la fagocitosis por medio de los polimorfonucleares, benéfica en la respuesta del organismo a la infección; también, como toda respuesta exagerada, es nociva para el huésped por la gran cantidad de radicales libres de oxígeno y enzimas líticas que se producen (20).
Activación de las cascadas de la coagulación y la fibrinólisis
Lesionado el endotelio microvascular, las plaquetas se adhieren al colágeno expuesto. Su activación genera tromboxano A2 y adenosina difosfato, que determinan la agregación de otras plaquetas aumentando el conglomerado plaquetario. La activación simultánea de la cascada de la coagulación genera trombina, la cual actúa sobre el fibrinógeno y lo convierte en fibrina que fortifica aún más el conglomerado plaquetario. En situaciones de normalidad, la producción de trombina se autorregula, lo que estimula al endotelio a producir prostaciclina (PGI-2) que limita el crecimiento del trombo plaquetario.
La activación de la cascada de la coagulación puede iniciarse por acción del LPS sobre el factor XII o de Hageman, activando todos los factores procoagulantes que llevan a la activación del fibrinógeno a fibrina que solidifica el trombo plaquetario, ocasionando trombosis intravascular diseminada (21 ).
De otra parte, el LPS que favorece la agregación de los polimorfonucleares y la lesión del endotelio, activa el plasminógeno, facilitando la degradación de la fibrina por la plasmina. De manera resumida se producen los siguientes efectos:
l. Consumo de plaquetas y factores de coagulación, 2. Formación local y difusa de trombos de fibrina con consecuencias importantes de isquemia e hipoperfusión orgánica.
3. Activación del sistema fibrinolítico para contrarrestar la formación de fibrina, con destrucción de fibrinógeno circulante y aparición en la circulación de PDF.
Activación del ácido araquidónico
El araqjuidónico es un ácido graso que se encuentra presente en las membranas celulares de la mayoría de los tejidos y es el más importante precursor de eicosanoides; una vez liberado el ácido araquidónico por la activación de las plaquetas, se metaboliza rápidamente por vía de la lipooxigenasa a ácido 5-hidroperoxieicostranoico, y a partir de él todos los leucotrienos (22).
Por vía de la cicloxigenasa, se sintetiza la prostaglandina H2, que puede tomar tres caminos: a prostaciclina (PGI-2), lesión térmica, hipertensión de origen renal, enfermedad acidopéptica, vasoconstricción, anormalidades en la función plaquetaria, fiebre y shock (23).
El tromboxano A2 (TXA2) causa agregación plaquetaria y de neutrófilos, vasoconstricción de los lechos vasculares, especialmente pulmonar, coronario, renal y esplácnico, broncoconstricción e incrementa la permeabilidad de las uniones de membrana, con lo que facilita el escape de fluidos. Las plaquetas son una de las principales fuentes de TXA2 y ya hemos visto cómo ellas se activan en contacto con el colágeno una vez lesionado el endotelio.
La prostaciclina (PGI-2), como quedó dicho, es otro de los productos del ácido araquidónico. Ha demostrado que disminuye la adhesividad pla<.juetaria, actuando como antiagregante plaquetario: inhibe in vivo la formación del trombo a través del mecanismo que aumenta el AMP cíclico intracitoplásmico. Administrada por vía intravenosa en perros con permeabilidad aumentada inducida experimentalmente, produjo disminución de la presión en la arteria pulmonar y alivió la dificultad respiratoria (24).
En líneas generales, se podría decir que los leucotrienos son potentes estimuladores de la quimiotaxis de los neutrófilos y de su adhesividad, y tienen efectos profundos en la función cardíaca tanto por su repercusión en el flujo coronario como por su acción en la contractilidad. Son capaces de alterar el flujo sanguíneo de varios lechos vasculares y son importantes en la regulación de la circulación periférica y presión sanguínea sistémica, así como en la permeabilidad vascular. Por sus efectos directos sobre los vasos a través del reclutamiento de las células inflamatorias, contribuyen probablemente al edema no hidrostático asociado con estos síndromes (25).
CLIC AQUÍ Y DÉJANOS TU COMENTARIO