Tratamiento Quirúrgico
Uno de los pilares de la neurocirugía oncológica es obtener una sobrevida con una importante resección de la lesión tumoral. Con el advenimiento de nuevas técnicas imagenológicas y un mayor conocimiento neuroanatómico, se ha obtenido una mayor morbilidad durante el procedimiento resectivo.
El tratamiento estándar aceptado actualmente es cirugía mas radioterapia y quimioterapia con temozolamida.
Se hace radioterapia con plantación tridimensional mediante fraccionamiento de 2 Gy/día, 5 días/semana adjunto temozolamida 75 mg/ m2/día por 7 días/semana. Las 6 semanas de la radioterapia seguido de temololamida adyuvante, 6 ciclos de 5 días cada 28 días a 150-200 mg/m2/día.
En cuanto a la resección de glioblastoma guiada se evaluó la microcirugía convencional versus la cirugía guiada con ácido áminolevulínico (ALA) para determinar la profundidad de la resección en 408 pacientes con glioblastoma multiforme seguidos de radioterapia, la resección con ALA se asocio con resecciones mayores pero mayor tasa de secuelas neurológicas a las 48 horas de postcirugía. (21).
Un estudio que evaluó la relación entre el contenido tumoral de MGMT y la sobrevida sugiere que no hubo beneficio para la sobrevida en los pacientes que sobreexpresaron MGMT.
Rol de la Radioterapia
La utilidad de la radioterapia ha demostrado eficacia cuando se ha agregado a la cirugía o en combinación con cirugía y quimioterapia, prolongando la sobrevida de los pacientes.
Existe controversia en el beneficio de la radioterapia en los casos de radioterapia recidivante.
Tratamiento con Quimioterápicos Wafers de Carmustina:
Los polímeros de liberación controlada han sido diseñados para llevar agentes quimioterapéuticos directamente dentro de los lugares de resección de un glioma maligno. Estos sistemas permiten una exposición local prolongada pero con exposición sistémica limitada.
Tumores Cerebrales
Los gliomas de alto grado son los tumores cerebrales mas comunes en el cerebro de los adultos.
De manera invariable todos los pacientes con glioblastoma progresan o recurren despues del tratamiento, con una media de sobrevida de seis meses después de la recurrencia, a pesar de un tratamiento quimioterapeutico agresivo y esquema de radioterapia. Entre el 80 o 90% de la recurrencia postoperatoria.
Lea También: Pronóstico de los Pacientes con Gliobastoma Multiforme
Neurooncología en relación al manejo de tumores de alto grado
En la pasada década se obtuvieron dos importantes logros en la neurooncología en relacion al manejo de tumores de alto grado.
Por un lado, el desarrollo de polímeros impregnados de BCNU o carmustina que permiten proporcionar altas dosis de quimioterapia en el lecho tumoral al momento de la reseccion quirúrgica, disminuyéndose así los efectos de la toxicidad sistémica. El gliadel es una de los medicamentos aprobados para el tratamiento del gliooblastoma multiforme que está basado en el mecanismo anteriormente mencionado.
El otro avance capital fue el desarrollo de la temozolamida, hematoencefálica. La carmustoina hace parte de una familia llamada mostaza que ha sido un medicamento quimioterapéutico utilizado en una variedad de Tumores Cerebrales malignos tales como astrocitoma, medulblastoma, gliobastoma, mieloma múltiple y linfomas.
La carmustina tiene una biodisponibilidad del 5 al 28% y una vida media entre 15 a 30 minutos, debido a sus propiedades lipofilicas y relativa falta de ionizacion en pH fisiológico. La carmustina cruza en algún grado la barrera hematoiencefálica, es importante vigilar el cuadro hemático por los potenciales efectos de mielosupresión.
Los ciclos no deben ser dados más frecuentes a seis semanas, además un efeco adverso conocido es la toxicidad a nivel pulmonar enmarcada en fibrosis pulmonar que puede aparecer desde el noveno dia de tratamiento hasta los 43 meses.
En la actualidad a pesar de la llegada intersticial de carmustina con los biopolimeros, invariablemente todos los pacientes experimentan recurrencia localmente.
Por otro lado, existe interés en la utilizacion de los biopolímeros en las metástasis cerebrales. Más del 30 % de los pacientes con cáncer desarrollan extensión hematológica de la enfermedad al cerebro. En este punto se han realizado algunos estudios donde el gliadel puede ofrecer una ayuda para las alternativas convencionales de tramtamiento. Pero mas estudios deberán realizarse para esclarecer este punto.
Tratamiento del Glioblastoma Multiforme
Una nueva aproximación al tratamiento del glioblastoma multiforme es el uso de citotoxinas manipuladas molecularmente. Las citotoxinas recombinantes son dirigidas a las células tumorales de glioblastoma por medio de un ligando o anticuerpo que se une a un receptor internalizado en la membrana plasmática.
Entre las citotoxinas ensayadas se encuentran las derivadas de la exotoxinas A de pseudomonas (PE38QQR) y la IL-13.
Es importante mencionar aquí en estudio ASPECT, un ensayo que evaluó la eficacia de un vector adenoviral HSV-tk (Cerepro) y el ganciclovir sistémico para glioblastoma de diagnóstico nuevo. El fundamento es la capacidad de transferencia del adenovirus sobre la timidina-cinasa e inducir la expresión de la misma y de esta manera se produce una sensibilización al ganciclovir sistémico.
Este estudio aleatorizado de 251 paciente concluyó que el Cerepro tenía un impacto positivo en la enfermedad, si bien el grupo tratado con cerepro presentó algunos síntomas neurológicos tales como hemiparesia, disfasia entre otros cuando en relaciona al otro grupo.
Quimioterapia Intraarterial
Esta técnica basada en la colocación del agente quimioterapéutico en el sistema arterial y tiene la ventaja de incrementar la recaptación durante el primer pasos de la droga a través de los capilares. La administración intraarterial de etoposido se cree que puede alterar de manera transitoria la barrera hematoencefálica. (29).
En instituciones americanas como Stony Brook University Hospital en Nueva York desde 1990. Se utiliza quimioterapia intraarterial con cisplatino y etoposido administrado previo a la radioterapia en el manejo de pacientes con glioblastoma multiforme.
Quimioterapia sistémica para los tumores cerebrales
Con sobrevida media de 20 meses es uno de los logros más importantes en cuanto a estrategias de tratamiento. La quimioterapia intraarterial para glioblastoma no ha sido aprobada por la FDA debido a la carencia de ensayos randomizados que comparen esta estrategia con la quimioterapia sistémica (intravenosa) para los Tumores Cerebrales. (30)
Terapia Angiogénica:
Dos diferentes procesos han sido descritos para describir la formación de la vasculatura. La vasculogenenesis se refiere al proceso de la formación de vasos sanguíneos primitivos a partir del mesodermo. Por diferenciación de los angioblastos durante el desarrollo embriogénico.
En el siglo pasado se determinó la asociación entre la angiogenesis y el cáncer. Folkman y cols fueron los primeros en mostrar que losTumores Cerebrales para crecer necesitaban la formación de nuevos vasos sanguíneos. La angiogenesis se ha reconocido como pieza clave para la progresión de los gliomas.
Entre estos el glioblastoma multiforme se conoce como el mas antigénico por mostrar gran proliferación vascular e hiperplasia de células endoteliales. Esta hiprevascularización es parcialmente responsable de las propiedades de este tumor maligno incluyendo el edema peritumoral resultante de la disrupción de la barrera hematoencefálica.
riesgo de hemorragia intratumoral
Estos vasos neoformados se han asociado a incremento de riesgo de hemorragia intratumoral y también son responsables del aumento del contraste en las neuroimagenes.
La proliferación microvascular es un criterio de diagnóstico que ayuda a distinguir a los astrocitomas de bajo y alto grado y es una propiedad histopatológica del glioblastoma.
Aunque es incierta si la proliferación microvascular es la causa del comportamiento de los Tumores Cerebrales malignos. La neovascularizacion en los gliomas se correlaciona de manera positiva con su agresividad biológica. El grado de malignidad y la recurrencia clínica e inversamente con la sobrevida posoperatoria de los pacientes.
La angiogenesis implica una serie de eventos secuenciados que se inician con la expresión de factores angiogenicos con el VEGF con posterior unión a su receptor afín sobre las células endoteliales. El VEGF incrementa la permeabilidad vascular, lo cual conduce a la extravasación de proteínas plasmáticas y alteración de los pericitos.
La degradación de la membrana basal vascular y la matrix etracelular ocurre simultáneamente la alteración de esta última involucra a la catepsina B, metaloproteinasas de la matrix y otras enzimas además de la expresión de proteínas de la matrix como la fibronectina, laminina, tenascina-C y vitronectina. (20)
Se conoce igualmente que la homeostasis vascular es gobernada por un balance entre factores antigénicos y antiangionénicos.
Más de 25 factores de crecimiento y citoquinas diferentes se han identificado capaz de inducir angiogenesis. La producción de factores de crecimiento antigénicos es el resultado de alteraciones genéticas o son inducidos por hipoxia.
factores de crecimiento vascular
La familia VEGF que corresponde a los factores de crecimiento vascular y sus receptores son los mediadores más importantes de la angiogenesis en los gliomas. Esta familia VEFG incluye seis glicoproteínas conocidas como VEGF- A. VEGF-B. VEGF-C, VEGF-D, VEGF-E y el factor de crecimiento placentario.
El VEGF-A ha sido el mejor caracterizado. La expresión del gen VEGF-A es sobreregulado por la hipoxia, mediado por la transcripción del factor HIF y el producto de el gen de supresión tumoral de von Hippel-Lindau.
Otros son: Angiopoyetinas, factores de crecimiento fibroblasticos, Factor de crecimiento derivados de plaquetas, factor de crecimiento epidérmico/ factor de crecimiento transformante alfa, factor de crecimiento transformante beta, factor de crecimiento del hepatocito, interleucina 6 y 8, Factor de crecimiento tumoral alfa, inductor 61 rico en cisteina, factor de crecimiento conectivo tisular y factor de crecimiento relacionado a la insulina 1, integrinas, metaloproteinasas de la matrix, celulas progtenitoras endoteliales, inhibidores angiogenicos endógenos.
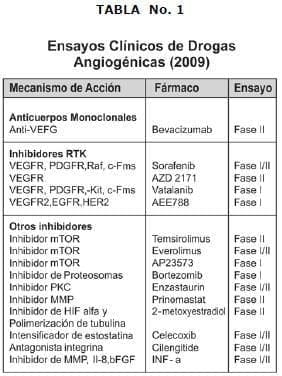
En la actualidad están en curso diversos estudios en Fase I usando la perspectiva desde la terapia antiangiogénica para el manejo de los gliomas malignos. La estrategias pueden ir dirigidas a bloqueo de la producción de factores de creciento, neurotralización de factores de crecimiento circulante, inhibición y supresión de cascadas relacionadas con el RTK (receptor de tirosina kinasa).
En la actualidad se han reportado datos en relación al Bevacizumab solo o en combinación con el Irinotecan (CPT-11). Los cuales han demostrado tasa de respuestas y supervivencia global. Estos fármacos están actualmente bajo investigación y se espera que en un futuro pueden abrir una esperanza basados en esta estrategia terapéutica. (Ver Tabla 1).