Superfamilia de las Inmunoglobulinas. Esta superfamilia comprende aquellas proteínas que tienen uno o más dominios extracelulares homólogos a las inmunoglobulinas. Pueden subdividirse en:
-
- Tipo C1: involucradas en el reconocimiento de los antígenos; se incluyen aquí los receptores antigénicos de los linfocitos T y B, los anticuerpos, y las moléculas del complejo mayor de histocompatibilidad
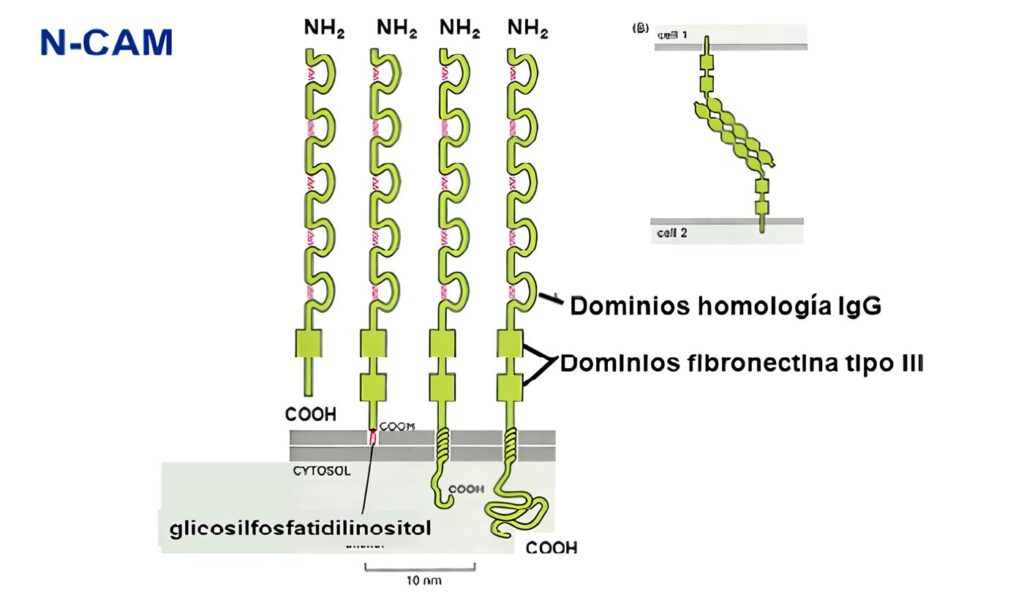
- Tipo C2: proteínas de adhesión celular y fijadoras del complemento (tabla 3); incluye moléculas de acciones muy diversas, desde adhesión neuronal (NCAM), coestimulación celular (CD28, CD80, CD86, CTLA-4), y moléculas de adhesión que en algunos casos son ligandos para las integrinas (aunque en algunos casos realizan inte-racciones homofílicas, como el CD31). Estas moléculas están involucradas en la circulación y tráfico de los leucocitos a los órganos linfoides y a los sitios de daño tisular por medio de interacciones célula-célula y célula-matriz extracelular.
Tabla 3. Superfamilia de las Inmunoglobulinas
Nombre |
Nombre alterno |
Distribución |
Contra receptor |
Regulación |
| ICAM-1 | CD54 | Endotelio,fibroblastos epitelio,monocitos, linfocitos,cél.detrídicas condrocitos |
LFA-1Mac-1 CD 43 (leucosialinas) |
Expresión constitutiva; aumenta por IL-1, TNF-IFN-,LPS |
| ICAM-2 | CD102 | Endotelio,lifocitos monocitos,plaquetas |
LFA-1 | Expresión constituva |
| ICAM-3/ ICAM-R | CD50 | Linfoncitos,monocitos polimorfonucleares |
LFA-1,D/CD18 | Aumenta la expresión con la activación |
| VCAM-1 | CD106 | Endotelio, monocitos Células dendrícas fibroblastos,estroma médula óea |
VLA-4,47,LPA-1 | Aumenta la expreción por Il-1,TNF-,IL-4 IL-13,LPS |
| LFA-2 | CD2 | Linfoncitos T,NK | LFA-3,CD59,Cd48 | Expreción constitutiva |
| LFA-3 | CD58 | Endotelio,Leucocitos células epiteliales |
LFA-2 | |
| PECAM-1, Endocam |
CD31 | Endotelio,plaquetas leucolitos,músculos |
CD31,Heparina, µVb3 |
Tiene formas muy polimórficas |
| MadCAM-1 | Endotelio de mucosas, vénulas de lámina propia y olacas de Peyer,bazo |
LPAM-1(µ4b7) L-selectina |
Expresión aumentada por IL-1,TNF-µ,IFN-g | |
| NCAM | Cél.Neurales, gliales corazón, músculo,riñon NK,algunos T activados |
NCAM,heparán sulfato heparina, µvb3 |
||
| CD80 | B7-1 | Linfoncitos B, fibroblastos Cél.dendríticas linf. Tactivados |
CD28,CTLA-4 | Expresión aumentada por la activación |
| Cd86 | B7-2 | linfoncitos B,monocitos Cél.dendríticas T activados, granulocitos |
CD28,CTLA-4 | Expresión aumentada por la activación |
| Cd28 | Linf.Tcél. plasmáticas | CD80,C86 | Exprsión constitutiva | |
| CTLA-4 | Células T activadas | CD80,CD86 | Expresión aumentada por la activación |
Las moléculas Tipo C2 incluyen un número variable de dominios extracelulares tipo inmunoglobulina, con secuencias de cisteínas conservadas que forman puentes disulfuro para estabilizar la estructura terciaria de la molécula (3).
Miembros de las superfamilia de las Igs
Cinco miembros de las superfamilia de las Igs están expresadas constitutivamente por las células endoteliales, y se encuentran involucradas en la adhesión firme de los leucocitos a ellas:
ICAM-1, ICAM-2, VCAM-1, PECAM-1 y MAdCAM-1. La expresión de la mayoría de estas moléculas es regulada positivamente por varias citoquinas, llevando a un incremento en la unión fuerte de los leucocitos al endotelio durante los procesos inflamatorios (7)(2). Esa adhesión fuerte se realiza por la interacción de las moléculas tipo C2 con las integrinas b1, b2 y b7 expresadas sobre los leucocitos.
Las interacciones del CD28 y CTLA-4 con CD80 (B7-1) y CD86 (B7-2) tienen un interés muy particular pues hacen parte fundamental del sistema de coestimulación desplegado durante la activación de los linfocitos T (7); las evidencias
orientan a proponer un rol estimulador para el CD28, mientras que la señalización generada por CTLA-4 sería inhibidora para la célula T.
Las cadherinas Son proteínas homodiméricas que median adhesiones intercelulares homofílicas dependientes del calcio (3) (8). Participan en la separación histogénica, migración de las células y la diferenciación de los tejidos embrionarios, así como en la formación de uniones entre células adyacentes. Se han clasificado como E, P, N, R y M, de acuerdo con el lugar donde fueron caracterizadas (endotelio, trofoblasto, sistema nervioso, retina y mioblastos).
Las proteínas de la matriz extracelular En este grupo encontramos proteínas como la fibronectina, la laminina y el colágeno (3). Estas moléculas intervienen en mecanismos de adhesión célula-matriz extracelular, esti-mulación de la movilidad hacia los sitios de inflamación y activación de los fagocitos.
(Lea También: Deficiencia en la Adhesión Leucocitaria Tipo II)
Modelos Fisiopatológicos para su Estudio
El exceso, defecto o ausencia de las moléculas de adhesión se relaciona con eventos anormales que participan en el desa-rrollo algunas enfermedades (9) (1); por lo tanto, éstas son usadas como modelos para el estudio y análisis de la función y estructura de dichas moléculas. A continuación mencionaremos algunos modelos de interés.
1. Deficiencia de adhesión leucocitaria Tipo I
Esta es una deficiencia autosómica recesiva, en la cual existe un defecto en las 3 integrinas leucocitarias CD11/CD18 por una alteración en la cadena 2 común de ellas (10). El defecto puede consistir en la ausencia total de la subunidad o la presencia de mutaciones en dicha cadena, que afectan su estructura o las interacciones con la subunidad alfa.
Se habla de un fenotipo severo cuando se presenta menos del 0.3% de la cantidad normal de la 2 integrina, y de un fenotipo moderado cuando los niveles de dicha integrina se encuentran entre el 2.5 % y el 11% del valor normal para la misma.
Se han caracterizado mutaciones en el cromosoma 21q22.3, región que contiene el gen que codifica para la cadena b2; también se han encontrado mutaciones puntuales y anormalidades en el splicing del RNA mensajero que afectan a la proteína resultante.
Este desorden se caracteriza por anormalidades en las actividades dependientes de la adhesión leucocitaria, obser-vándose mayor defecto en la función del neutrófilo: se afecta la adhesión, quimiotaxis y la fagocitosis de los microorganismos opsonizados con C3bi (ligando del MAC-1).
Los pacientes que presentan esta afección se caracterizan por:
-
- Retardo en la caída del cordón umbilical y onfalitis
- Infecciones bacterianas y micóticas recurrentes severas
- Úlceras necróticas sin presencia de pus
- Gingivitis y periodontitis
- Infecciones del tracto respiratorio superior e inferior
- Abscesos cutáneos y celulitis
Los agentes infecciosos más frecuentemente asociados son el Staphylococcus aureus, bacterias gram negativas, Candida albicans y Aspergillus spp.
En las pruebas de laboratorio se pueden encontrar: neutrofilia aunque no exista infección activa; in vivo e in vitro presentan quimiotaxis anormal; ausencia de adhesión al vidrio, plástico y al cultivo de células endoteliales.
Gracias a la activación con otras opsoninas (p.e. C3b, IgG) la degranulación, fagocitosis y explosión respiratoria en los neutrófilos pueden estar presentes; esto se explica por la existencia de receptores de membrana diferentes para estas moléculas o por agonistas solubles que no requieren el MAC-1.
El diagnóstico se confirma por medio de citometría de flujo, en la cual se evalúa la presencia o ausencia del CD18 en la superficie de los leucocitos. También se hace la caracterización molecular de los diferentes defectos implicados y el diagnóstico prenatal.
2. Deficiencia en la adhesión leucocitaria Tipo II
Se debe a un defecto en la adhesión mediada por las selectinas. Existe una falla en el metabolismo de la fucosa, que lleva a una alteración en la adición de los carbohidratos a las proteínas que son ligandos para las selectinas, como es el caso del Sialyl Lewis X, que se encuentran en las células endoteliales (10). Se asocia además con la ausencia del antígeno H en la superficie del glóbulo rojo, lo cual origina el fenotipo Bombay (hh).
Los pacientes presentan dismorfismo craneofacial, déficit neurológico e infecciones recurrentes respiratorias. In vitro se encuentran defectos en la fagocitosis, quimiotaxis, quimiocinesis y agregación de los fagocitos.
Se ha observado disminución en la vida media de los neutrófilos circulantes, aproximadamente en un 50% con respecto al valor normal; se desconocen sus defectos moleculares subyacentes.