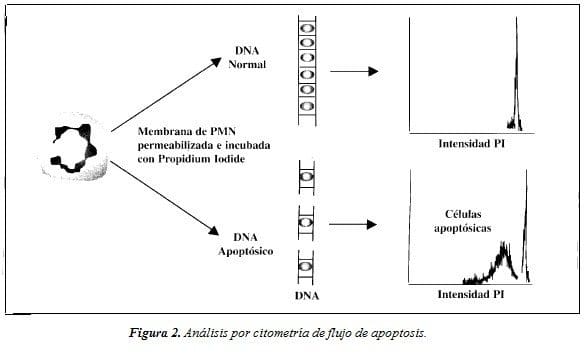
Citometría de Flujo
P.C. Rodríguez, L.F. García
Grupo de Inmunología Celular e Inmunogenética,
Facultad de Medicina, Universidad de Antioquia,
Medellín, Colombia.
La detección de aloanticuerpos por citometría de flujo (CF) ha tenido gran acogida en los últimos años dado su objetividad y alta sensibilidad. Además de la disponibilidad de una amplia gama de anticuerpos que permiten la identificación precisa de determinada población celular.
Si bien, rutinariamente se estudian los aloanticuerpos contra HLA-I y HLA-II. Utilizando linfocitos T y B como blanco. La CF también puede ser usada para detectar anticuerpos contra diferentes moléculas expresadas en otras poblaciones celulares como plaquetas, células endoteliales, Monocitos y Granulocitos, entre otros.
La detección de aloanticuerpos por CF es una inmunofluorescencia indirecta donde las células blanco son incubadas con un suero negativo. Un suero positivo y el suero problema a estudiar. Posteriormente se incuban con un F(ab)2 anti-IgG o anti-IgM humana marcada con un fluorocromo y un anticuerpo monoclonal contra la población celular a estudiar marcado con un fluorocromo diferente. Finalmente se hace el análisis en el citómetro.
El anti-anticuerpo F(ab)2 se debe titular previamente para cada población a estudiar.
Es básico establecer el punto de corte sobre el cual se va a considerar una muestra positiva. Para lo cual se estudia el suero control negativo (proveniente de individuos AB no transfundidos) con células de 10 donadores sanos y el valor de tres desviaciones estándar de la media de las medianas de la intensidad de fluorescencia (canales) es considerado como punto de corte.
Nosotros detectamos anticuerpos contra plaquetas, células endoteliales de cordón umbilical, monocitos, granulocitos y linfocitos T y B.
La adquisición de plaquetas se usa anti-CD41a como marcador específico, pero estas son previamente purificadas por centrifugaciones diferenciales (pureza 90%) y se tiene como punto de corte para IgG 56 canales de desplazamiento y para IgM 70.
(Lea También: Detección de Factores Bloqueadores del Cultivo Mixto de Linfocitos)
Para la identificación de anticuerpos anti-endotelio:
Las células extraídas mediante infusión de colagenasa en cordones umbilicales. Son marcadas con anti-CD45 y CD54 (las células endoteliales son CD45- y CD54+). Se ha establecido que valores superiores a 62 canales para IgG y 93 para IgM son considerados positivos. Para la tinción simultánea de células T y B, los mononucleares son teñidos con anti-CD3 para T y anti-CD19 para B y la muestra es positiva cuando supera la mediana de fluorescencia del control negativo en 49 canales para linfocitos T y 59 para B en IgG. Además de 35 y 85 para T y B en IgM.
Para la tinción simultanea de granulocitos y monocitos se hace inicialmente una región en los monocitos y se analizan las CD14+ siendo positivo a partir 34 canales para IgG y 88 para IgM. Para la adquisición de granulocitos se hace una región dentro de ellos (FSC vs SSC) y se usa anti-CD33 como discriminador. Se estableció que valores superiores a 39 canales para IgG y 81 para IgM son positivos.
En resumen, la utilización de esta técnica podría ser recomendada en todas aquellas patologías que comprometan la acción de anticuerpos dirigidos contra algunas poblaciones celulares.