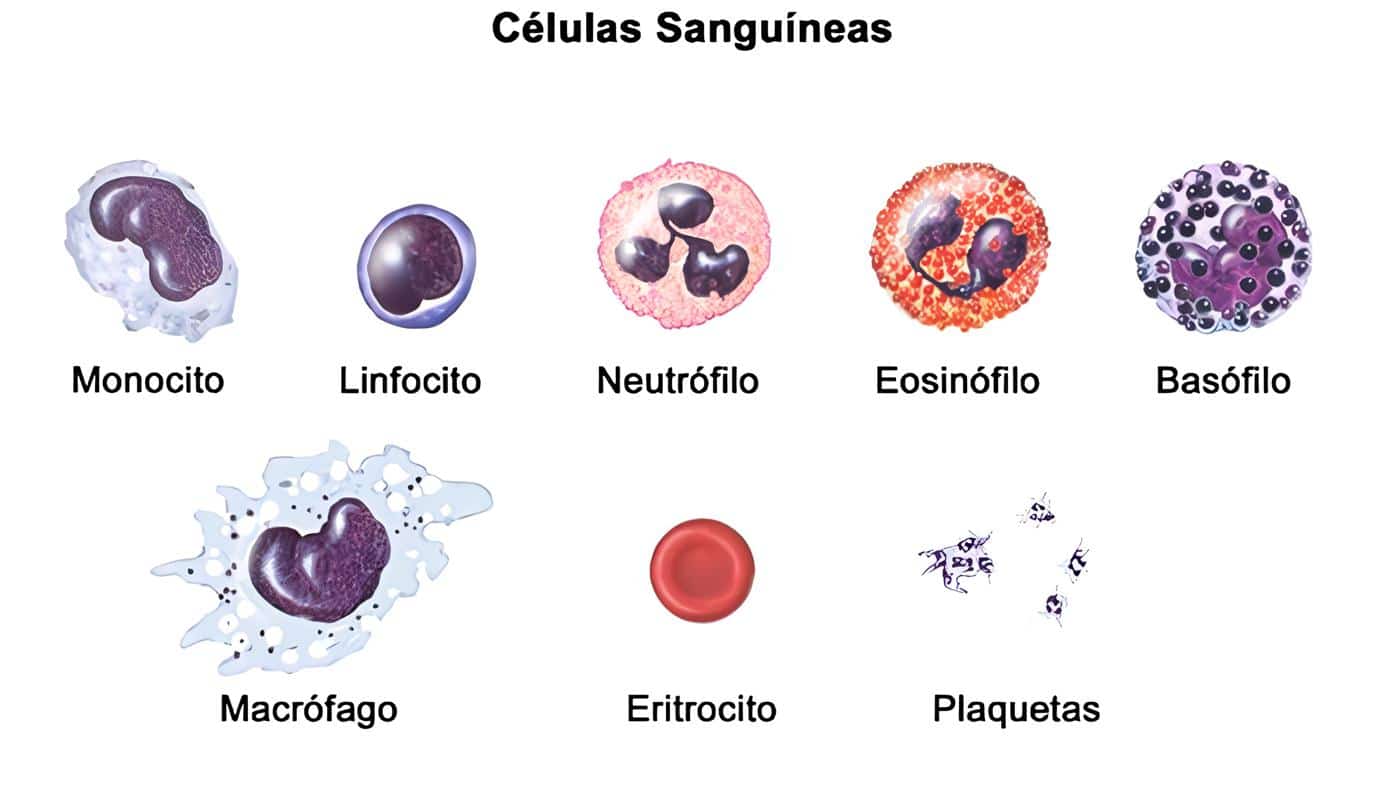
Uso en Enfermedades Infecciosas
La exposición in vitro e in vivo de los PMN al GM-CSFrh incrementa la expresión de moléculas de superficie como las ß2 integrinas, receptores para la porción Fc de la IgG y para los componentes derivados del complemento (20); además, puede incrementar la quimiotaxis (21).
El GM-CSF disminuye la migración de los PMN ya localizados en el sitio de la inflamación (7) y aumenta la producción de anión superóxido en respuesta a quimioatrayentes bacterianos (FMLP) y derivados del complemento; además, aumenta hasta cuatro veces la respuesta de estas células al FMLP.
El GM-CSF no induce fagocitosis de las bacterias que no se encuentren opsonizadas; sin embargo, hace de los PMN unos fagocitos más eficientes cuando las bacterias están en un medio previamente opsonizado con suero (6).
Sargramostim prolonga la sobrevida de los PMN inhibiendo la apoptosis (de 96 a 216 horas) e induce en ellos la expresión de moléculas del complejo mayor de histocompatibilidad clase II, lo que podría permitir a los neutrófilos actuar como células presentadoras de antígeno (22, 23).
También se han observado efectos de esta citoquina sobre la función de los monocitos y macrófagos: incrementa la expresión de moléculas de superficie como CD11a, CD11b y CD11c; aumenta la expresión y afinidad del receptor para IgG FcgRII (CD32); incrementa la citotoxicidad dependiente de anticuerpos, la explosión respiratoria y la generación de anión superóxido, aumentando de esta manera la capacidad para fagocitar y destruir tanto bacterias como hongos.
Esto se ha demostrado in vitro con el Staphylococcus aureus y la Candida albicans, pues las células tratadas con GM-CSFrh destruyeron el 90% de la C. albicans comparado con las células no tratadas que solo eliminaron el 50%. La fagocitosis y la destrucción del S. aureus se incrementaron de un 62% a un 72% durante el tratamiento (24).
En estudios realizados en ratones infectados con el complejo Mycobacterium avium se han obtenido datos que sugieren que sargramostim aumenta el efecto antibacteriano de la claritromicina, azitromicina, amikacina y ofloxacina (25).
En una investigación realizada en pacientes con cáncer, compromiso de un órgano mayor e infección micótica diseminada, utilizando GM-CSFrh como adyuvante de la terapia, en seis de los ocho individuos evaluados se presentó mejoría en el conteo de PMN; cuatro de estos pacientes se curaron completamente de la infección mientras que 2 presentaron respuesta parcial (26).
En otro estudio, en doce pacientes con infección por VIH avanzada (CD4+ £200/mL) tratados con zidovudina, la administración de sargramostim subcutáneo incrementó tres veces el conteo absoluto de PMN y monocitos (27).
Debido a que aumenta la capacidad de los PMN y macrófagos para fagocitar bacterias, hongos y parásitos intracelulares, el GM-CSFrh podría ser usado para el tratamiento y profilaxis de las infecciones oportunistas en pacientes con SIDA; aunque en un principio se pensó que así se podría estimular la replicación viral, ésto ha sido controversial pues algunos estudios han demostrado incremento de la replicación viral cuando los monocitos y macrófagos infectados con el VIH son expuestos al GM-CSFrh (28), mientras que otros trabajos han reportado supresión de la expresión del virus (29).
Experimentos in vitro han demostrado que el GM-CSFrh incrementa la actividad de algunos antirretrovirales como zidovudina y estavudina, posiblemente aumentando su fosforilación intracelular (28-30).
Al respecto, se han realizado trabajos para evaluar el efecto del GM-CSFrh sobre la replicación viral mediante la medición del antígeno p24 y se encontró que cuando se administraba junto con la terapia antirretroviral los niveles de este antígeno no variaban significativamente (27); en otros estudios, cuando se administraba solamente molgramostim se observó que algunos pacientes presentaron incremento del antígeno p24 (31).
La utilidad de una terapia mixta se ha confirmado en pacientes usando PCR para medir la carga viral, pues con la administración concomitante del GM-CSFrh y una terapia antirretroviral que incluía un inhibidor de proteasas los pacientes experimentaban un incremento significativo del recuento de células CD4+ y una disminución de la carga viral (32)
En algunos pacientes con SIDA e infección por Mycobacterium avium tratados con azitromicina, se agregó sargramostim por seis semanas al azar en cuatro de ellos y se evaluó la producción de anión superóxido, la que se encontró aumentada en los pacientes que recibían sargramostim respecto de los controles; además, se observó una disminución del 60% en el número de Mycobacterium avium al final del tratamiento, mientras que en los controles sólo disminuyó en un 28% (33).
Utilidad como adyuvante de vacunas
En las células dendríticas el GM-CSFrh incrementa en la expresión de moléculas del complejo mayor de histocompatibilidad clase II, para que una vez procesado el antígeno sea presentado más eficientemente a los linfocitos T CD4 ayudadores y, activen la producción de anticuerpos por las células B.
Este factor aumenta también la expresión de moléculas coestimulatorias, de adhesión y la producción de citoquinas como la IL-1, TNF e IL-6, incrementando así la expansión y diferenciación de los linfocitos B y T.
Por todas estas características, se piensa que el GM-CSFrh puede actuar como adyuvante de vacunas, una nueva estrategia para la inmunoterapia de enfermedades infecciosas y el cáncer. Se ha encontrado que la inyección local de GM-CSFrh puede aumentar la inmunogenicidad de las vacunas y es bien tolerado (34).
Como terapia antitumoral
Estudios in vitro han demostrado que el GM-CSFrh aumenta la actividad citotóxica de los monocitos y linfocitos de sangre periférica y especialmente la citotoxicidad celular dependiente de anticuerpos.
En macrófagos infiltrantes de tumores, incrementa la secreción de metaloproteasas de matriz y la producción de angiostatina (inhibidor de la angiogénesis) disminuyendo el crecimiento de las metástasis pulmonares (35). También, puede aumentar la inmunogenicidad de las células tumorales facilitando la presentación de sus antígenos (36).
El GM-CSFrh ha sido ensayado en ratas como adyuvante para la generación de una respuesta inmune contra péptidos antigénicos derivados de tumor (34).
En 20 pacientes con melanoma metastásico se evaluó el uso de sargramostim como adyuvante del R24, un anticuerpo monoclonal murino que media la citotoxicidad celular dependiente de anticuerpos y de complemento contra las células tumorales; la medición de la citotoxicidad directa y dependiente de anticuerpos indica que sargramostim aumentó la citotoxicidad de los monocitos y granulocitos hacia la tercera semana en todos los pacientes evaluados.
De los 14 individuos que recibieron la combinación, en dos se encontró repuesta parcial, seis no respondieron y seis desarrollaron enfermedad progresiva. De seis pacientes que recibieron sólo sargramostim, tres no respondieron al tratamiento permaneciendo su enfermedad estable; los otros tres presentaron progresión de la enfermedad (37).
Otros usos potenciales
La utilidad del GM-CSFrh se ha sugerido para el tratamiento de la mucositis, estomatitis y diarrea ocasionadas por la quimio y radioterapia; se ha demostrado que estimula la migración y proliferación de las células endoteliales y promueve el crecimiento de los queratinocitos (38); además, reduce la duración y la severidad de la neutropenia.
sto se ha observado tanto en pacientes con sarcoma que recibieron sargramostim después de la quimioterapia como en pacientes sometidos a transplante alogénico de médula ósea que recibieron medicamentos e irradiación.
También se ha ensayado el uso tópico de molgramostim para la prevención de la mucositis, observando que los pacientes sometidos a transplante de médula ósea que hacían lavados bucales de molgramostim desarrollaban mucositis leve al compararlos con los pacientes que no los hicieron (39).
Se han llevado a cabo estudios en animales con la aplicación local de GM-CSFrh en heridas crónicas, resultando en un incremento de la formación del tejido de granulación y el incremento de la fuerza tensil de las heridas quirúrgicas, produciendo curación rápida (40). Para el tratamiento de las úlceras de origen vascular en los miembros inferiores, se estudiaron diez pacientes manejados con seis inyecciones intradérmicas de molgramostim en la periferia de la úlcera, aplicadas cada dos semanas y se observó mejoría completa o al menos parcial en algunos pacientes (41).
Efectos secundarios y perfil de seguridad del GM-CSFrh
Aunque el GM-CSFrh es generalmente bien tolerado a la dosis estándar, el efecto tóxico más frecuente es el dolor óseo leve o moderado observado en el 20% a 30% de los pacientes que lo reciben; ésto puede atribuirse a la capacidad de estas moléculas de estimular la hematopoyesis.
Adicionalmente, su uso se asocia frecuentemente con fiebre y síntomas generales semejantes a un resfriado (Tabla 3).
Tabla 3. Comparación de los efectos adversos producidos por GM-CSFrh y G-CSFrh
| EFECTOS ADVERSOS | GM-CSFrh | G-CSFrh |
|
+ | – |
|
+ | – |
|
+ | + |
|
+ | – |
|
+ | – |
|
+ | – |
|
+ | + |
|
+ | – |
|
+ | – |
|
+ | – |
|
+ | – |
|
+ | – |
|
+ | – |
|
+ | – |
|
+ | – |
|
+ | – |
|
+ | – |
|
+ | – |
+ = presente – = ausente
Los efectos secundarios después de la aplicación del molgramostim son más frecuentes, lo que puede estar relacionado con su acción sobre los macrófagos.
La fiebre (20% de los pacientes que lo reciben) crea confusión a la hora de evaluar la respuesta a los tratamientos para las infecciones; se acompaña en ocasiones de mialgias y de un síndrome semejante a la influenza.
El 25% de los pacientes que reciben la primera dosis IV de molgramostim presentan enrojecimiento de la cara, taquicardia, hipotensión, dolores osteomusculares, disnea, náuseas, vómito, escalofrío, desaturación de oxígeno y síncope; la causa puede ser la liberación de mediadores vasoactivos que inducen desajustes en la ventilación/perfusión intrapulmonar.
En raras ocasiones ocurren reacciones autoinmunes: hemólisis, vasculitis cutánea y síntomas de artritis reumatoidea. Los efectos secundarios son menos frecuentes cuando se administra el sargramostim (15).
Aunque las células leucémicas mieloides y de otras neoplasias pueden expresar receptores para el GM-CSFrh, no hay evidencia convincente que indique que cualquiera de estos factores causa transformación maligna o agrava el curso de las leucemias.
A pesar de que se emplean en pacientes leucémicos y con mielodisplasia que presentan neutropenia severa, no se ha observado activación de la enfermedad o su transformación leucémica. Los efectos adversos del GM-CSFrh desaparecen rápidamente con la suspensión de la terapia.
Referencias Bibliográficas
- Metcalf D. The molecular biology and functions of the granulocyte-macrophage colony-stimulating factor. Blood 1986;67:257
- Kubota N, Orita T, Hattori K. Structural characterization of natural and recombinant human granulocyte colony-stimulating factor. J Biochem 1990;107:486.
- Cantrel MA, Anderson D, Cerretti DP, Price V, et al. Cloning sequence, and expression of a human granulocyte/macrophage colony-stimulating factor. Proc Natl Acad Sci USA 1985;82(6250).
- Zhao Y, Chegini N. The expression of granulocyte macrophage-colony stimulating factor (GM-CSF) and receptors in human endometrium. Am J Reprod Immunol 1999;42:303.
- Chegini N, Tang XM, Dou Q. The expression, activity and regulation of granulocyte macrophage-colony stimulating factor in human endometrial epithelial and stromal cells. Mol Hum Reprod 1999;5:459.
- Gasson JC, Weisbart RH, Kaufman SE, et al. Purified human granulocyte-macrophage colony stimulating-factor: direct action on neutrophils. Science 1984;226:1339.
- Fleischmann J, Golde DW, Weisbart RH, Gasson JC. Granulocyte-macrophage colony-stimulating factor enhance phagocytosis of bacteria by human neutrophils. Blood 1986;67:708.
- DiPersio JF, Billing P, Williams R, Gasson JC. Human granulocyte-macrophage colony-stimulating factor and other cytokines prime human neutrophils for enhanced arachidonic acid release and leukotriene B4 synthesis. J Immunol 1988;140:4315.
- Griffin JD, Spertini O, Ernest TJ, et al. Granulocyte-macrophage colony-stimulating factor and other cytokines regulate surface expression of the leukocyte adhesion molecule-1 on human neutrophils, monocytes, and their precursors. J Immunol 1990;145:576.
- Quelle FW, Sato N, Withhuhn BA, et al. JAK2 associates with bc chain of the receptor for the granulocyte macrophage-colony stimulating factor, and its activation requires the membrane proximal region. Mol Cell Biol 1994;14:4335.
- Park L, Friend D, Urdal DL. Characterization of the cell surface receptor for human granulocyte/macrophage colony stimulating factor. Exp Med 1986;164:251.
- Husein AM, Ross M, Vredenburgh J, Meisenberg B, et al. Effects of granulocyte-macrophage colony stimulating factor produced in chinese hamster ovary cell (regramostim), Escherichia coli (molgramostim) and yeast (sargramostim) on priming peripheral blood progenitor cells for use with autologous bone marrow after high-dose chemotherapy. Eur J Haematol 1995;54:281.
- Schwinghammer TL, Shadduck RK, Waheed A, Evans C, Sulecki M, Rosefeld CS. Pharmacokinetics of recombinant human granulocyte-macrophage colony-stimulating factor (GM-CSF) after intravenous infusion and subcutaneous injection. Pharmacotherapy 1990;2:105.
- Hovgaard D, Mortensen BT, Schifter S, Nissen NI. Comparative pharmacokinetics of single-dose administration of mammalian and bacterially-derived recombinant human granulocyte-macrophage colony-stimulating factor. Eur J Haematol 1995;50:32.
- Rabinowitz J, Petros WP, Stuart AR, Peters WP. Characterization of endogenous cytokine concentrations after high-dose chemotherapy with autologous bone marrow support. Blood 1993;81:835.
- Neelis KJ, Hartong SCC, Egeland T, Thomas GR, Eaton DL. The efficacy of single-dose administration of thrombopoietin with coadministration of either granulocyte colony-stimulating factor in myelosuppressed rhesus monkeys. Blood 1997;90:2565.
- Ali SM, Brown RA, Adkins DR, et al. Analysis of lymphocyte subsets and peripheral blood progenitor cells (PBPC) in apheresis products from normal donors mobilized whit either G-SCF or concurrent G-CSF and GM-CSF. Blood 1997;90:2511.
- Büchner T, Hiddeman W, Wörmann B, et al. Hematopoietic growth factors in acute myeloid leukemia: supportive and priming effects. Semin Oncol 1997;24:124.
- Yau JC, Neidhart JA, Triozzi P, et al. Randomized placebo-controlled trial of granulocyte-macrophage colony-stimulating-factor support for dose intensive cyclophosphamide, etoposide and cisplatin. Am J Hematol 1996;51:289.
- Boder LA, Grace MJ, Pugliese-Silvo C, et al. The effect of GM-CSF and G-CSF on human neutrophil function. Immunopharmacolgy 1995;29:111.
- Wang JM, Colella S, Allavena P, Mantovani A. Chemotactic activity of human recombinant granulocyte-macrophage colony-stimulating factor. Immunology 1987;60:439.
- Brach MA, deVos S, Gruss H-J, Hermmann F. Prolongation of survival of human polymorphonuclear neutrophils by granulocyte-macrophage colony stimulating-factor caused by inhibition of programmed cell death. Blood 1992;80:1220.
- Gosselin EJ, Wardwell K, Rigby WFC, Guyre PM. Induction of MHC class II on human polymorphonuclear neutrophils by granulocyte/macrophage colony-stimulating factor, IFN g , and IL-3. J Immunol 1993;151:1482.
- Richardson MD, Brownlie CED, Shankland GS. Enhanced phagocytosis and intracellular killing of Candida albicans by GM-CSF-activated human neutrophils. J Med Vet Mycol 1992;30:433.
- Bermudez L, Martinelli J, Petrofsky M, Kolonoski P, Young L. Recombinant granulocyte-macrophage colony-stimulating factor enhance the effects of antibiotics against Mycobacterium avium complex infection in begie mouse model. J Infect Dis 1994;169:575.
- Bodey G, Anaissie E, Gutterman J, Vadhan-Raj S. Role of granulocyte-macrophage colony-stimulating factor as adjuvant therapy of fungal infection in patients with cancer. Clin Infect Dis 1993;17:705.
- Scadden DT, Pickus O, Hammer SM, et al. Lack of in vitro effect of granulocyte-macrophage colony-stimulating factor on human immunodeficiency virus type I. AIDS Res Human Retrovir 1996;12:1151.
- Perno C, Cooney D, Gao W, et al. Effects of bone marrow stimulatory cytokines of human immunodeficiency virus replication and the antiviral activity of dideoxynucleosides in cultures of monocyte/macrophages. Blood 1992;80:995.
- DiMarzio P, Mariani R, Tse J, Thomas E, Landau N. GM-CSF or CD40, suppresses chemokine receptor expression and HIV-1 entry in human monocytes and macrophages. Abstracts of the 5th conference on retroviruses and opportunistic infections, Chicago. 1998;abstr 37:86.
- Perno CF, Yarchoan R, Cooney DA, et al. Replication of human immunodeficiency virus on monocytes. Granulocyte/macrophage colony-stimulating factor (GM-CSF) potentiates viral reproduction yet enhances the antiviral effect mediated by 3′-azido-2’3′-dideoxythymidine (AZT) and other dideoxynucleoside congeners of thymidine. J Exp Med 1989;169:933.
- Pluda JM, Yarchoan R, Smith PD, et al. Subcutaneous recombinant granulocyte-macrophage colony-stimulating factor used as a single agent and in an alternating regimen with azidothymidine in leukopenic patients with severe human immunodeficiency virus infection. Blood 1990;76:463.
- Skowron G, Stein D, Drusano G, et al. Safety and anti-HIV effect of GM-CSF in patients on highly active anti-retroviral therapy. Program and Abstract of the 5th Conference on Retroviruses and Opportunistic Infections. Chicago, IL: 1998. p.267(Abstr 615).
- Kemper C, Bermudez L, Agosti J, Deresinsky S. Immunomodulatory therapy of Mycobacterium avium (MAC) bacteremia in AIDS with rhGM-CSF. Thirty Fifth Annual Meeting of the Interscience Conference on Antimicrobial Agents and Chemotherapy, San Fancisco,CA. 1995. p.177.
- Diss ML, Bernhard H, Shiota FM, et al. Granulocyte-macrophage colony-stimulating factor: an effective adjuvant for protein and peptide-based vaccines. Blood 1996;88:202.
- Dong Z, Kumar R, Yang X, Filder IJ. Macrophage- derived metalloelastase is responsible for the generation of angiostatin in Lewis lung carcinoma. Cell 1997;88:801.
- Dranoff G, Jaffee E, Lazenby A, et al. Vaccination with irradiated tumor cells engineered to secrete murine granulocyte-macrophage colony-stimulating factor stimulates potent, specific, and long-lasting anti-tumor immunity. Proc Natl Acad Sci USA 1993;90:3539.
- Chachoua A, Oratz R, Liebes L, et al. Phase Ib trial of granulocyte-macrophage colony-stimulating factor combined with murine monoclonal antibody R24 in patients with metastasic melanoma. J Immunother 1994;16:132.
- Bussolino F, Wang JM, Defilippi P, et al. Granulocyte- and granulocyte-macrophage-colony stimulating factors induce human endothelial cells to migrate and proliferate. Nature 1989;337:471.
- Ovilla-Martinez R, Rubio ME, Borbolla JR, Gonzalez-Llaven JE. Mouthwashes as treatment for mucositis in BMT patients. Blood 1994;84:717a.
- Jyung RW, Wu L, Pierce GF, Mustoe TA. Granulocyte-macrophage colony-stimulating factor and granulocyte colony-stimulating factor: differential action on incisional wound healing. Surgery 1994;115:325.
- Arnold F, O´brien J, Cherry G. Granulocyte monocyte-colony stimulating factor as an agent for wound healing. J Wound Care 1995;4(400).