Los factores estimulantes de colonias constituyen una familia de glicoproteínas que modulan la hematopoyesis y controlan la sobrevida, proliferación, diferenciación y capacidad funcional de los progenitores hematopoyéticos, con actividades frecuentemente superpuestas. Son, además, reguladores importantes de la respuesta inmune y de la homeostasis tisular (1).
El DNAc para el GM-CSF humano codifica para un polipéptido de 144 aminoácidos (aa), con una secuencia líder de 17 aa, dos sitios de glicosilación N y dos uniones disulfuro intracatenarios. El GM-CSF tiene un peso molecular que varía de 14 a 30 KDa, debido a su glicosilación cambiante pues más del 50% de la molécula está constituida por carbohidratos (2).
El gen del GM-CSF se ha mapeado en el brazo largo del cromosoma 5 (5q21-q32), nueve Kb corriente abajo del gen de la IL-3; se transcribe constitutivamente en monocitos, fibroblastos y células endoteliales. El RNAm no se acumula, a menos que las células sean inducidas por estímulos como la IL-1 y el factor de necrosis de tumores (TNF), lo que lleva al incremento transitorio del RNAm y a la producción de la proteína, con un pulso máximo entre 3 y 6 horas (2). En las células T, la expresión del GM-CSF es transcripcionalmente regulada (3).
Este factor de crecimiento lo producen también los queratinocitos y tiene un efecto local sobre la función y viabilidad de las células de Langerhans de la epidermis madura. Las células madres pluripotenciales CD34+ pueden ser inducidas in vitro, en presencia de GM-CSF y TNF, para que se diferencien en células dendríticas con un incremento de 10 a 20 veces en la expresión de CD1, además de altos niveles de HLA-DR.
Se ha encontrado expresión tanto del GM-CSF como de su receptor en el endometrio humano:
Lo que puede sugerir un papel autocrino y paracrino en este tejido, ya que se ha observado que una coexpresión temporal y espacial puede influenciar de alguna manera ciertas actividades biológicas del endometrio, como son la respuesta local inflamatoria y la sobrevida de los macrófagos (4); por algunos estudios se ha concluido que aunque el GM-CSF no es un factor mitogénico para las células glandulares o estromales del endometrio, puede actuar allí de una manera interactiva con el factor transformante de crecimiento beta (TGF-ß), el cual regula la expresión tanto del GM-CSF como de su receptor (5).
En la circulación el GM-CSF se detecta excepcionalmente, aun en pacientes febriles, neutropénicos o con infección. Estas observaciones sugieren que las acciones importantes del GM-CSF durante las respuestas contra los microorganismos agresores están dadas localmente, lo que contrasta con la actividad del G-CSF que estimula en forma generalizada las funciones de los PMN.
El GM-CSF tiene un amplio impacto sobre la hematopoyesis:
Estimulando el desarrollo y la maduración de las células madres que van a dar origen a los neutrófilos (PMN), eosinófilos, monocitos y megacariocitos. Su actividad proliferativa puede ser sinérgica con otros factores de crecimiento hematopoyético, como la eritropoyetina y la IL-3. El GM-CSF no activa por si mismo a los progenitores tempranos o a las células madres, a menos que esté presente la IL-1.
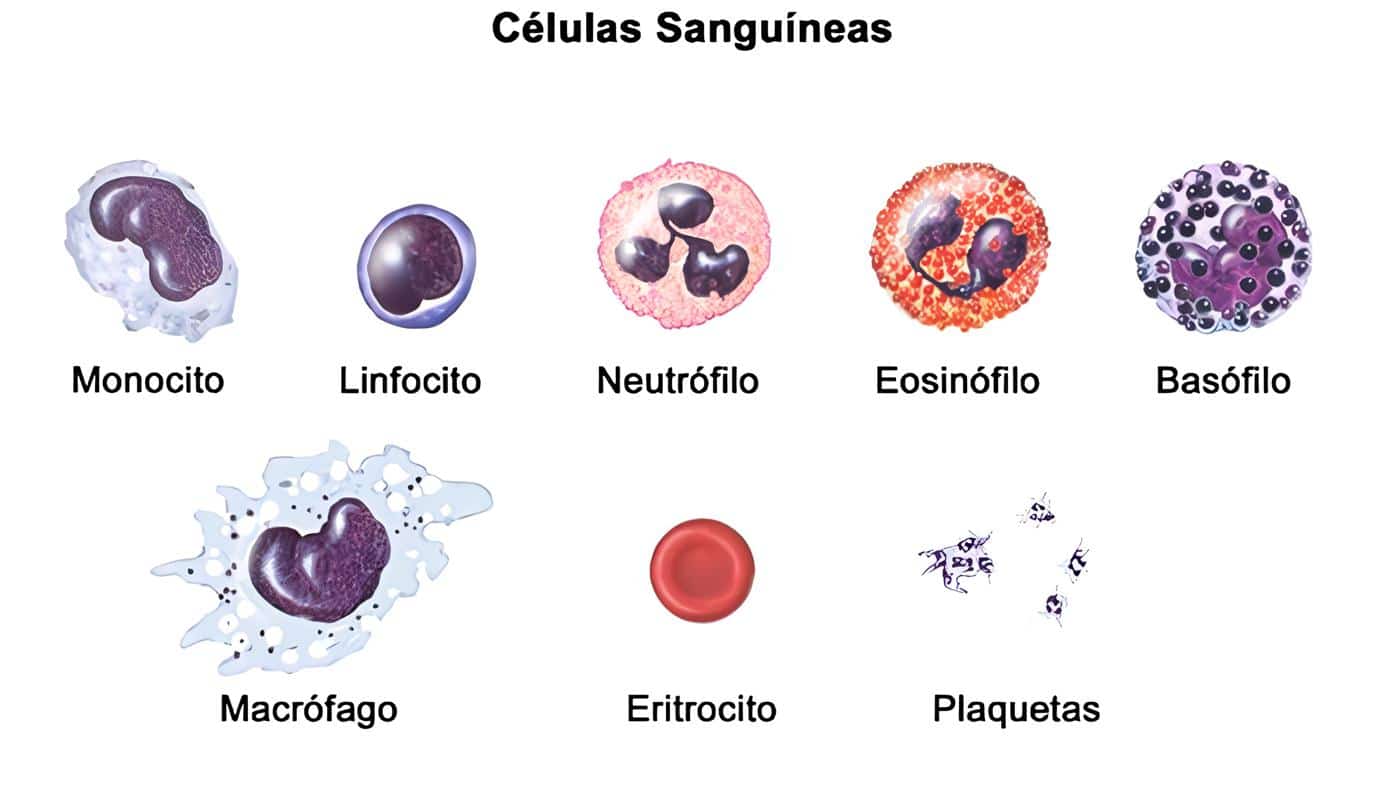
Las acciones de los PMN, eosinófilos, monocitos y macrófagos se pueden activar por el GM-CSF; específicamente, induce la síntesis y liberación de la IL-1, el TNF y el G-CSF por los monocitos y macrófagos. Los PMN, macrófagos y eosinófilos incrementan su habilidad fagocítica y de destrucción de diversos patógenos después de la estimulación con el GM-CSF, a través de numerosos mecanismos (6-8) (Tabla 1).
Tabla 1. Efectos biológicos del GM-CSF sobre las células hematopoyéticas maduras
CÉLULAS |
ACCIÓN BIOLÓGICA |
EFECTO DEL GM-CSF |
Neutrófilos |
Expresión de CD11b/CD18 Expresión CD64, CD14 Quimiotaxis Fagocitosis – degranulación Reacciones microbicidas Actividad NADPH Oxidasa: O-2 Citotoxicidad celular dependiente de Acs Expresión receptores: C3bi -Fca – FMLP Liberación leucotrienos – Ácido araquidónico Secreción de citoquinas Apoptosis |
+ – + + + + + + + + – |
Monocitos |
Sobrevida – Proliferación Producción de óxido nítrico Moléculas CMH clase II, CD1 a,b,c. Citotoxicidad celular dependiente de Acs Expresión de genes: IL-1, TNF, IL-6 Liberación de IL-1, TNF, IL-6, G-CSF, M-CSF |
+ + + + + + |
Basófilos |
Liberación de histamina | + |
Eosinófilos |
Sobrevida Citotoxicidad celular dependiente de Acs Síntesis de Leucotrienos Maduración, función y expresión CMH clase II, CD1a |
+ + + + |
Osteoclastos |
Reabsorción ósea | – |
| + = estimulación positiva de la función, incremento en la expresión – = inhibición de la función o la expresión |
||
Se tiene evidencia de que el GM-CSF puede afectar la adhesión, agregación y movilidad de los neutrófilos in vitro e in vivo, sin embargo los mecanismos por los cuales ejerce este efecto no están completamente entendidos.
Miembros de la familia de moléculas de adhesión como LAM-1 (moléculas de adhesión leucocitaria) y su homólogo murino MEL-14, los cuales median la unión de los leucocitos al endotelio alto de las vénulas, son expresados por los neutrófilos, eosinófilos, monocitos y células de la médula ósea; la exposición de éstos al GM-CSF recombinante humano (GM-CSFrh) ocasiona la pérdida rápida y completa de la superficie celular de la molécula LAM-1, lo que puede alterar la capacidad de los neutrófilos para migrar hacia los sitios de inflamación.
(Lea También: GM-CSF Recombinante Humano)
La regulación positiva de CD11b
La regulación positiva de CD11b (una molécula de adhesión encargada de la agregación de los neutrófilos) puede ser la responsable de la neutropenia rápida y del secuestro pulmonar de los neutrófilos que se ha observado después de la administración del GM-CSFrh.
De la misma manera, se ha encontrado que durante la maduración inducida por el GM-CSF las células progenitoras de los neutrófilos y monocitos expresan altos niveles del LAM-1, efecto observado también en los progenitores eritroides tempranos (9).
Los efectos biológicos del GM-CSF son mediados por medio de la unión a su respectivo receptor específico; las vías de transducción de señales que se activan después de esta unión ligando-receptor están en estudio; al parecer, hay dos vías de señalización y cada una compromete una región diferente de la cadena ß común (ßc); una de ellas lleva a la inducción de C-myc y a la replicación del DNA, activando las proteínas JAK (quinasas Janus) y las señales de transducción y transcripción por las proteínas STAT. La segunda vía compromete la activación de proteínas de la familia Ras y proteínas quinasas activadas por mitógenos (MAP quinasas) (10) (Figura 1).
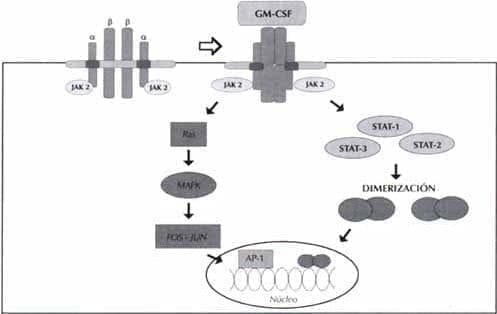
Figura 1. Receptor para el GM-CSF y vías de transducción de señales
Receptor para el GM-CSF
El receptor para el GM-CSF es un heterodímero compuesto de una cadena a (c¤, el ligando específico) y la cadena ßc. El gen de la c¤ se ha mapeado en la región seudoautosómica de los cromosomas sexuales, mientras el gen de la bc está localizado en el cromosoma 22q31 (11).
Las cadenas ¤ y ß pertenecen a la superfamilia de receptores de citoquinas tipo 1; poseen una porción de 200 aa en la región extracelular, con cisteínas conservadas y un motivo WSXWS (Trp-Ser-X-Trp-Ser). En los humanos sólo existe una clase de bc; mientras la ca es única para el receptor del GM-CSF, la bc es compartida por los receptores para la IL-3 y la IL-5 (11).
La ca tiene un dominio fibronectina tipo III; se han descrito tres isoformas de la ca, dos formas de 400 y 410 aa idénticas en los dominios extracelular, transmembrana y citoplasmática proximal, pero tienen una pérdida completa de la identidad en los aa terminales 54 y 64.
La tercera forma tiene una delección transmembrana y puede presentarse en forma soluble. La expresión diferencial de las diferentes isoformas de esta cadena sobre los diversos tipos de células y estados de diferenciación, lleva a la presentación de distintas respuestas al GM-CSF.
La ca liga al GM-CSF
La ca liga al GM-CSF con baja afinidad; la bc no tiene afinidad detectable para el GM-CSF, pero al unirse a la ca forman un heterodímero que da origen al receptor de alta afinidad.
El receptor para el GM-CSF se expresa en los PMN como una clase única de alta afinidad (Kd de 199 pM; entre 300 a 2800 receptores por célula).
Los progenitores mieloides, eritrocitos, células dendríticas, megacariocitos, células plasmáticas, ciertos linfocitos T, células endoteliales, eosinófilos, macrófagos, monocitos y células mieloides leucémicas expresan receptores, las dos últimas de afinidad intermedia (Kd de 10 a 40 pM) y el resto de baja afinidad (Kd)