Se han encontrado huesos con depósitos metastásicos en esqueletos de la Edad del Hierro y del Bronce, así como entre los sajones, en especímenes de la baja edad media de Dinamarca, en diversas dinastías egipcias y en el nuevo mundo.
La mayoría de los eventos están asociados a granulomas eosinofílicos, mieloma múltiple o carcinomas prostáticos (44). Una de las menciones más emblemáticas pertenece a una mujer joven hallada en Irak, y otro esqueleto perteneciente a un hombre adulto maduro con un carcinoma de próstata, ambos fechados alrededor de 3.100 a.C.
Gerszten reportó el hallazgo de lesiones en los huesos de una mujer de 45 años hallada en la región andina del norte de Chile (750 a.C.), patología que sugiere un cáncer de seno metastásico por la distribución del daño que seguía un patrón blástico en el cráneo, la columna vertebral, el esternón, uno de los fémures, y la pelvis (45).
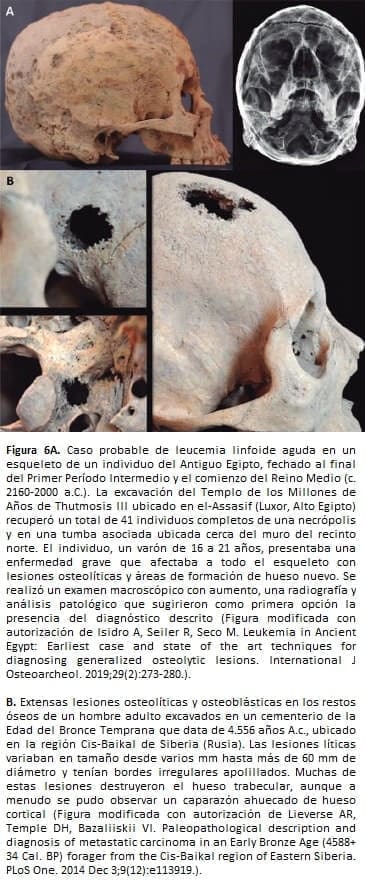
No obstante, un gran número de hallazgos permanecen en incertidumbre debido a las dificultades que entraña el diagnóstico de las lesiones líticas en los huesos humanos secos o fosilizados (Figura 6). Las discusiones iniciaron con algunos casos de Eurasia conocidos por el cumulo de Mokrin (ex Yugoslavia) que datan del año 1.900 a.C., lugar donde se encontró el esqueleto de una mujer anciana con lesiones que podrían sugerir un proceso degenerativo versus la evolución natural de un cáncer de seno.
De forma similar, casos provenientes de Rusia, Polonia, Hungría, Inglaterra, Dinamarca, y Suiza, todos con el común denominador de la ausencia de confirmación radiológica o histológica.
Mejor suerte han tenido los hallazgos recientes de lesiones líticas encontradas en poblaciones americanas precolombinas, especialmente provenientes de nativos documentados en California, Kentucky, Perú y la isla de St. Lawrence en Alaska (9).
Tumores de tejidos blandos
Ocasionalmente se han descrito neoplasias primarias de los tejidos blandos en restos de momias, siendo representativo el caso de un niño de 12 a 18 meses descubierto por Gerszten y Allison que informaron la presencia de un rabdiomiosarcoam de la mejilla en una momia masculina del norte de Chile (300-660 d.C.) (46).
Igualmente, se han descrito melanomas metastásicos en momias incas de más de 2.400 años de historia (47). Desde una perspectiva paleoepidemiológica se ha calculado que alrededor del 15% de las neoplasias del Egipto dinástico eran carcinomas nasofáringeos (Figura 7), distribución dramática si se considera la incidencia actual de este carcinoma que n excede el 0.25% (48).
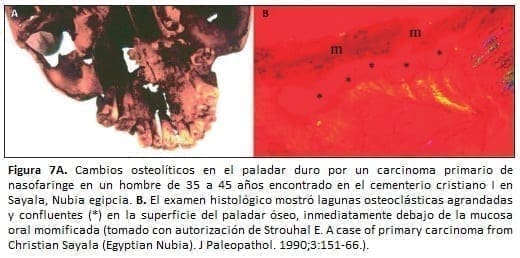
La situación resultaba completamente diferente en la antigua Eurasia, donde solo hay registro de un caso originado en este segmento anatómico con extensión a los senos paranasales en un cráneo de Tepe Hissar, Irán (3.200 a 2.000 años a.C.) (49).
El alto número de casos de carcinoma nasofaríngeo documentados en el antiguo Egipto podría representar el vínculo primario con un carcinógeno viral, el contacto original con el virus de Epstein Barr y su oncogén LMP-1. Desde entonces, esta neoplasia sigue un patrón poblacional que afecta con mayor frecuencia algunas partes de África, incluyendo Túnez, Argelia, Marruecos, Sudán y parte de África oriental. En adición, Singapur, Tailandia, Vietnam, el sur de China y Alaska.
En la última región la prevalencia del tumor puede alcanzar hasta el 20% de las neoplasias malignas, posiblemente en asociación a la variante Alaskan de LMP-1 (50). Los pobladores de esta región también tienen una mayor exposición a carcinógenos químicos de la flora local incluyendo los diterpenoides propios del Clerodendrum eriophyllum y de la Euphorbia resinífera.
(Lea También: Secuenciación de Nueva Generación (NGS) y Oncología de Precisión)
Porque la baja frecuencia del cáncer en las poblaciones humanas antiguas
A partir de la evidencia paleo-oncológica parece evidente que el cáncer resultaba infrecuente en la antigüedad humana.
Un motivo plausible es que las neoplasias pudieron conducir rápidamente a la muerte en contraposición al ahora, afectando en alguna proporción la esperanza de vida al nacer (que en la antigüedad rodeaba los 32 a 39 años). Sin embargo, es indudable que la prevalencia de la enfermedad ha aumentado progresivamente en el tiempo, y en especial, durante el último siglo.
Por ejemplo, en Alemania la mortalidad por cáncer en 1900 era solo del 3,3%, pero había uamentado a más del 20% en 1970, y cerca de del 46% en la década de 1990. Además, sabemos que aproximadamente la mitad de los hombres y un tercio de las mujeres desarrollarán cáncer a lo largo de sus vidas (51). Estos datos soportan que la expansión de la enfermedad corresponde a un evento biológico relativamente reciente.
El fenómeno evolutivo se ha relacionado tentativamente con el envejecimiento de la población en la modernidad, de hecho, en los países con altos ingresos la esperanza pasó de 30 a 40 años hasta 70 a 80 años en la menos de un siglo.
Para el año 2000, más del 85% de las muertes por cáncer en Estados Unidos se produjeron en sujetos mayores de 55 años, evento diferencial con la antigüedad donde más del 90% de los restos enfermos por murieron antes de los 30 años (52).
Sin embargo, estos datos no soportan la variación temporal:
de hecho, cabe considerar la posibilidad de que las causas de cáncer puedan diferir en tipología e intensidad respecto de la antigüedad.
Considerando la tipología, es notable que los humanos antiguos fueron excluidos de la exposición a carcinógenos sintéticos modernos, incluidos algunos factores físicos como la radioactividad ambiental generada por las pruebas nucleares que iniciaron hacia 1950.
De igual forma, múltiples agentes químicos responsables de la contaminación en los espacios urbanos. En el pasado, los homínidos primitivos y humanos de la antigüedad no tenían hábitos sociales determinados, solían vivir en espacios abiertos, y muchos seguían conductas nómadas.
Las ocupaciones domésticas y el trabajo en interiores aumentaron significativamente la exposición al gas radón, así como al uranio y otros metales pesados. Un ejemplo que permite valorar el impacto de la exposición interior prolongada en el pasado se dio en Herculano durante el siglo I d.C., y en la Nueva Guinea Montañez.
En ambas situaciones, la contaminación interior aumentó la exposición al humo por combustión de leña, el uso de aceites, o de lámparas alimentadas con grasa animal. En los dos entornos se incrementó el índice de enfermedades pulmonares, incluido el cáncer.
El cáncer como estrategia evolutiva
Mediante el estudio de la evidencia de neoplasia en los fósiles, se han recopilado pruebas de que algunos animales han adoptado la generación de tumores como estrategia biológica de evolución.
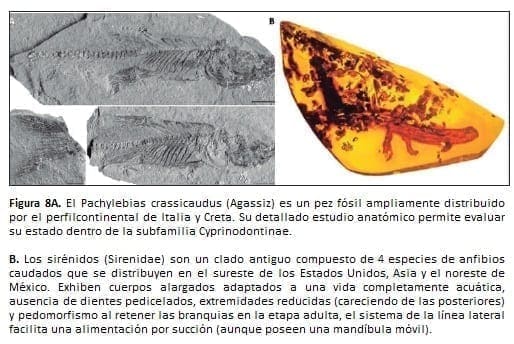
El pez del género Pachylebias que vivían en las aguas hipersalinas del mar Mediterráneo hace unos 8 millones de años, adoptaron la paquiosis para facilitar la inmersión en el agua altamente densa gracias al aumento del peso de sus esqueletos gracias al desarrollo de hiperostosis difusa.
Una estrategia similar fue dispuesta por mamíferos pertenecientes al grupo Sirenidae del Oligoceno (hace unos 30 millones de años), que adquirió un hueso de alta densidad en el esqueleto axial para consentir la navegación en el fondo de las aguas poco profundas.
La presencia de estos 2 grupos de animales acuáticos, tanto extintos como vivos, muestra que las neoplasias fueron adoptadas para obtener ventajas ambientales (Figura 8). De hecho, aunque las neoplasias representas una condición patológica, la desventaja individual fue compensada en gran medida por la ventaja para toda una especie.
En este sentido, se podría afirmar que algunas neoplasias fueron adoptados y utilizadas por algunos animales como estrategia para diferenciarse y aumentar su adaptabilidad (9). Este hecho permitió que la patología sobreviviera generación tras generación durante millones de años.
También, sabemos que algunos tipos de cáncer pueden haber desaparecido.
Por ejemplo, Moodie describiò una lesión lítica en un cráneo humano precolombino de Perú que se debió a una forma de cáncer desconocido en la actualidad (incluso por análisis histológico) (53).
La existencia de posibles formas extintas de cáncer indica que pueden ser consideradas como un fenómeno que evoluciona en estrecha asociación con los vertebrados hospederos.
Las formas extintas y las formas de neoplasias de larga duración en la historia muestran una posible imagen de la coevolución de la enfermedad sobre la historia de la vida en la Tierra.
Referencias
-
1. Halperin EC. Paleo-oncology: the role of ancient remains in the study of cancer. Perspect Biol Med. Winter 2004;47(1):1-14.
-
2. Ekhtiari S, Chiba K, Popovic S, et al. First case of osteosarcoma in a dinosaur: a multimodal diagnosis. Lancet Oncol. 2020;21(8):1021-1022.
-
3. News in brief. A Discovery 76 Million Years in the Making. Cancer Discov. 2020;10(10):1433-1434.
-
4. Kirkpatrick CL, Campbell RA, Hunt KJ. Paleo-oncology: Taking stock and moving forward. Int J Paleopathol. 2018;21:3-11.
-
5. David A, Zimmerman M. Cancer: an old disease, a new disease or something in between?. Nat Rev Cancer. 2010;10:728–733.
-
6. Faltas B. Cancer is an ancient disease: the case for better palaeoepidemiological and molecular studies. Nat Rev Cancer. 2011;11(1):76.
-
7. Fearon E, Bommer G. Progressing from gene mutations to cancer. En: Abeloff M, Armitage J, Lichter A, Niederhuber J, Kastan M, McKenna W. (Eds.), Abeloff’s Clinical Oncology, fourth ed. Elsevier Health Sciences, Philadelphia, Pennsylvania.2008.Odes EJ, Randolph-Quinney PS, Steyn M. Earliest hominin cancer: 1.7-million-yearold osteosarcoma from Swartkrans Cave, South Africa. S Afr J Sci. 2016;112(7/8):2-5.
-
8. Capasso LL. Antiquity of cancer. Int J Cancer. 2005;113(1):2-13.
-
9. Strouhal E., Vyhnánek L, Nemeckrová A, HorackovaL, Benesová L. Malignant tumors affecting the people from the ossuary at Krtiny (Czech Republic). Int J Paleopathol. 1996;8(1):5–24.
-
10. Strouhal E, Němečková A. Trpěli i dávní lidé nádory? Historie a paleopatologie nádorů, zvláště zhoubných. Karolinum Publishing House, Prague, Czech Republic. Strouhal, E., Němečková, A., 2009. History and palaeopathology of malignant tumours. Anthropologie. 2008;47(3):283–288.
-
11. Molnar E, Marcsik A, Bereczki Z, et al. Malignant tumors in osteoarchaeological samples from Hungary. Acta Biol Szeged. 2009;53:117–124.
-
12. Hunt KJ, Roberts C, Kirkpatrick C. Taking stock: A systematic review of archaeological evidence of cancers in human and early hominin remains. Int J Paleopathol. 2018;21:12-26.
-
13. Schlumberger HG, Lucke B. Tumors of fishes, amphibians, and reptiles. Cancer Res. 1948;8:657–753.
-
14. Capasso L. Osteoma: paleopathology and phylogeny. Int J Osteoarch.1997;7:615–20.
-
15. Rothschild BM, Martin LD. Paleopathology: disease in the fossil record. Boca Raton: CRC Press, 1993.
-
16. Frye FL, Carney JD. Parathyroid adenoma in a tortoise. Vet Med. 1975;70:582–584.
-
17. Frye FL. Surgery in captive reptiles. In: Kirk RW, ed. Current veterinary therapy. Philadelphia: WB Saunders, 1974.
-
18. Wadsworth RJ. Neoplasms in snakes. Univ Pa Bull Veter Ext Q. 1954;133:65–74.
-
19. Montali RJ. An overview of tumors in zoo animals. In: Montali RJ,
-
20. Migaki G, eds. The comparative pathology of zoo animals. Washington DC: Smithsonian Institution Press, 1980.
-
21. Jubb KV, Kennedy PC. Pathology of domestic animals. New York: Academic Press, 1970.
-
22. Capasso L, Bascchia F, Rabottini N, et al. Fossil evidence of intraspecific aggressive behavior of Devonian giant fish (Artrodire dinichthydae). J Paleopathology. 1996;8:153- 60.
-
23. Moodie RL. Tumors in the Lower Carboniferous. Science. 1927;66:540.
-
24. Moodie RL. Pathological lesions among extinct animals: a study of the evidences of disease millions of years ago. Surg Clin Chicago. 1918b;2:319-31.
-
25. D’Anastasio R. Osteoma: epidemiologia e filogenesi. Tesi di Dottorato di Ricerca, XV Ciclo. Roma: Universita Cattolica del Sacro. Cuore, 2004.
-
26. Wang X-M, Rothschild BM. Multiple hereditary osteochondroma in Oligocene Hesperocyon (Canidae: Carnivora). J Vertebr Paleont. 1992;12(3):387–94.
-
27. Capasso L, Di Tota G. The antiquity of osteosarcoma. Int J Osteoarcheology. 1996;6:512– 4.
-
28. Cabrera A. Anomalias patologicas dentarias en algunos ungulados pampeanos. Notas Mus La Plata. 1934;2:183– 5.
-
29. Baker J, Brothwell D. Animal diseases in antiquity. London: Academic Press, 1980.
-
30. Stathopoulos G. Kanam mandible’s tumour. Lancet. 1975;1(7899):165–7.
-
31. Tobias PV. The Kanam jaw. Nature. 1960;195:946–7. 32. Sandison AT. Kanam mandible’s tumor. Lancet. 1975;1:279.
-
33. Czarnetzki A. Pathological changes in the morphology of the young Paleolithic skeletal remain from Stetten (Southwest Germany). J Hum Evol. 1980;9:15–7.
-
34. Rogers L. Meningiomas in pharaoh’s people; hyperostosis in ancient Egyptian skulls. Br J Surg 1949;36:423-4.
-
35. MacCurdy G. Human skeletal remains from highlands of Peru. Am J Physical Anthropol. 1923;6:217–330.
-
36. Sawyer D, Wood N, Allison M. An ancient “tumour” from preColumbian Chile. J Craniomaxillofac Surg. 1988;18:136-8.
-
37. Aufderheide AC, Ragsdale B, Buikstra J, Ekberg F, Vinh TN. Structure of the radiological “sunburst” pattern as revealed in a ancient osteosarcoma. J Paleopathol. 1997;9:101-6.
-
38. Dastugue J. Tumeur maxillaire sur un crane du Moyen- Age. Bull Assoc Fr Etud Cancer. 1965;52:69-72.
-
39. Suzuki T. Paleopathological study on a case of osteosarcoma. Am J Phys Anthropol. 1987;74:309 –18.
-
40. Zimmerman MR. A possible histiocytoma in an Egyptian mummy. Arch Dermatol. 1981;117:364-8.
-
41. Fornaciari G, Mallegni F. Probabile osteoclastoma (tumore a cellule giganti) su un omero di eta paleocristiana proveniente dalla Basilica di´San Vigilio (Trento). Quaderni di Scienze Antropologiche. 1980;5:127-35.
-
42. Steinbock TR. Paleopathological diagnosis and interpretation. Springfield: CC Thomas, 1976.
-
43. Waldron T. Lytic lesions in a skull: a problem in diagnosis. J Paleopathol. 1987;1:5-14.
-
44. Ortner DJ, Putshar WR. Identification of pathological condition in human skeletal remains. Smithsonian Contribution to Anthropology. 1981;28:365–98.
-
45. Gerszten E, Allison MJ. Human soft tissue tumors in paleopathology. Zagreb Paleopathol Symp. 1988;4:257–60.
-
46. Urteaga O, Pack GT. On the antiquity of melanoma. Cancer. 1966;19:607-10.
-
47. Capasso L, Mariani-Costantini R. Paleopatologia dei tumori umani. Medicina Nei Secoli Arte e Scienza. 1994;4:1–51.
-
48. Krogman WM. Skeletal and dental pathology of an early Iranian site. Bull Hist Med 1940;8:28-48.
-
49. Smatti MK, Al-Sadeq DW, Ali NH, et al. Epstein–Barr Virus Epidemiology, Serology, and Genetic Variability of LMP-1 Oncogene Among Healthy Population: An Update. Front Oncol. 2018;8:211.
-
50. Parker SL, Tong T, Bolden S, Wingo PA. Cancer statistics. Am Cancer Soc. 1996;46:5–27.
-
51. Siegel RL, Miller KD, Jemal DVM. Cancer statistics, 2020. CA Cancer J Clinicians. 2020;70(1):7-30.
-
52. Moodie RL. Studies in paleopathology. XVIII. Tumors of the head among pre-Columbian Peruvians. Ann Med Hist. 1926;8:394-412. Recibido: Diciembre 15, 2020 Aceptado: Diciembre 16, 2020 Correspondencia: Andrés F. Cardona andres.cardona@clinicadelcountry.com