Historia de la Medicina
Siglo XXI: El Siglo de las Enfermedades Causadas por CORONAVIRUS, SARS / MERS / COVID-19
Resumen
En las primeras dos décadas del siglo XXI, la humanidad ha sido testigo de tres brotes de nuevos coronavirus de origen zoonótico. Estas tres betas de coronavirus, SARS-CoV, MERS-CoV y el más reciente, el SARS-CoV-2, comparten un posible reservorio común, el murciélago.
De manera diferente, han llegado a infectar a los seres humanos y han causado síndromes respiratorios severos: SARS, MERS y la COVID-19, respectivamente, con diferentes tasas de letalidad. En este artículo se describen las características de cada uno de ellos y se comparan desde el punto de vista biológico, epidemiológico y clínico.
Palabras clave: Virus del SARS; MERS; COVID-19; Coronavirus.
21ST Century: The Century of Coronavirus Diseases, SARS / MERS / COVID-19
Abstract
In the fi rst two decades of the 21st century, humanity has witnessed three outbreaks of new zoonotic coronaviruses. These three betas coronavirus, SARS-CoV, MERS-CoV, and the most recent SARS-CoV-2, share a possible common reservoir, the bat.
Diff erently, they have come to infect humans and have caused severe respiratory syndromes (SARS, MERS, and COVID-19, respectively) with varying rates of fatality. This article describes the characteristics of each one of them and compares them from the biological, clinical, epidemiological point of view.
Keywords: SARS virus; Middle East Respiratory Syndrome Coronavirus; COVID-19; Coronavirus.
Introducción
En diciembre de 2019, se presentó un nuevo brote de una neumonía de causa desconocida en Wuhan, provincia de Hubei en China, al parecer, relacionada con un mercado de frutos de mar y venta de animales vivos (1).
El 31 de diciembre fue notificada la Organización Mundial de la Salud OMS) por parte del gobierno chino y rápidamente, el 7 de enero, se confirmó que este nuevo brote era causado por un nuevo coronavirus, y su secuencia se encuentra disponible desde el 12 del mismo mes (2).
La secuencia de este virus tenía cierta similitud a otro virus aislado en el 2002, el SARS-CoV, causante de un brote epidémico denominado Síndrome Respiratorio Agudo Severo (SARS) (2).
Antes de continuar con la descripción del nuevo coronavirus (SARS-Cov-2), es importante resaltar que el siglo XXI, sin lugar a dudas, será recordado desde el punto de vista de salud pública, como el siglo de los coronavirus y, no es para menos, dado que las tres primeras décadas, la humanidad ha sido afectada por una nueva zoonosis: en 2002-2003, causada por un nuevo coronavirus, el SARS-Cov; en 2012-2015, el MERS-CoV; y desde 2019, el recientemente bautizado por OMS como SARS-Cov-2.
Es preciso señalar que hay 4 coronavirus que usualmente infectan a los seres humanos y son causantes de resfriados comunes insignificantes. A continuación, me permito describir cada una de estas epidemias con algunas de las diferencias y similitudes entre cada una de ellas, no sin antes hablar brevemente del agente causal.
¿Quiénes son los coronavirus?
Los coronavirus (CoV) son virus esféricos de 100-160 nm de diámetro, de tipo ARN de sentido positivo monocatenario, con un tamaño entre 27-32 Kb, con envoltura, que pertenecen a la familia Coronaviridae (3).
De acuerdo con la organización genómica y la relación filogenética, los coronavirus se han clasificado en la subfamilia Coronavirinae, que consta de cuatro géneros: Alphacoronavirus (αCoV), Betacoronavirus (βCoV), Gammacoronavirus (γCoV) y Deltacoronavirus (δCoV) (3).
Usualmente, los coronavirus humanos (CoV H) Cov-HKU1, CoV-NL63, CoV-OC43 y CoV- 229E, están asociados con síntomas respiratorios leves en humanos. Al contrario, los tres beta coronavirus causantes del SARS, MERS y COVID-19 (Cov-SARS, Cov-MERS y SARS-CoV-2, respectivamente) producen una cuadro variado de síntomas, que incluyen un compromiso severo de predominio pulmonar con desenlaces muchas veces fatales.
Estos últimos tres, son considerados zoonosis porque su reservorio principal es un mamífero distinto al ser humano.
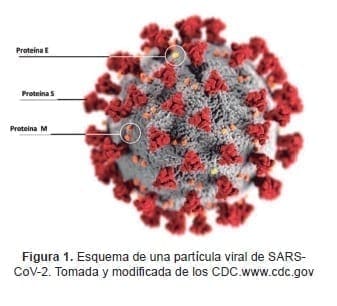
Además, evolutivamente hicieron un salto, de manera directa o indirecta, y no solo lograron infectar a células humanas, sino adquirieron la capacidad de transmitirse entre seres humanos, aspectos claves para el éxito en la propagación. En la figura 1, se describe la estructura de una partícula viral clásica de este virus.
SARS-CoV y El SARS
EL SARS es una zoonosis causada por el SARS-CoV, que apareció por primera vez en la ciudad de Foshán, región de Yunnan (China), y rápidamente se generó un brote epidémico en Guandong, en noviembre del 2002, que luego se extendió a 29 países, lo que causó brotes en diferentes escenarios (conjuntos residenciales, hospitales, viajes aéreos, entre otros) (4,5,6).
El 15 de marzo del 2003, la OMS decretó una alerta a nivel mundial, dada la aparición de brotes en varios continentes, brotes asociados a viajes y transmisión nosocomial, puesto que su pico de excreción viral se presentaba, muchas veces, cuando el paciente ya se encontraba hospitalizado (aproximadamente, al décimo día).
De esta manera, el saldo final, causado por este virus, fueron los 8.098 casos, de los que 774 fallecieron, es decir, con una tasa de letalidad de 9,6% (6,7). Los murciélagos fueron el origen del virus, pues son considerados los reservorios naturales y, a través del paso por un reservorio intermediario (los gatos de civeta), ocurrió la infección a los seres humanos.
Una vez el ser humano se expone a este virus
Por medio de la unión de la proteína S con el receptor de la enzima convertidora de angiotensina (ACE 2), ingresa a células humanas, lo que causa su infección y posterior replicación. El periodo de incubación se estima en 5 días, pero puede variar en un espectro amplio desde 2 hasta 14 días (8).
Desde el punto de vista clínico, el virus se caracterizó por un cuadro de fiebre, tos, ocasionalmente diarrea acuosa, con evolución rápida a un deterioro respiratorio por neumonía bilateral y con requerimiento de soporte ventilatorio en una tercera parte de los casos, de los que aproximadamente un 10% falleció (8).
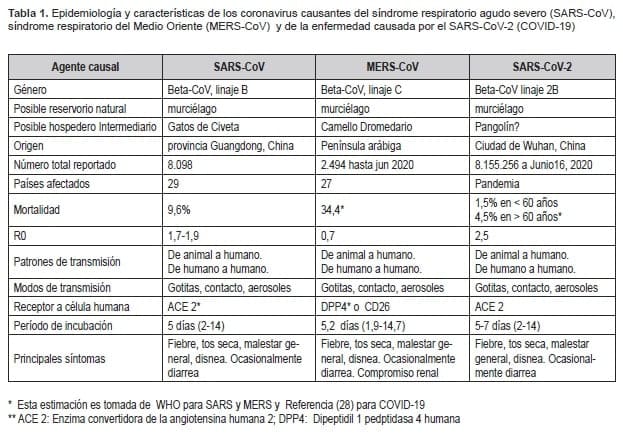
La mayoría de los pacientes que fallecieron, tenían en común que presentaban comorbilidades. En la tabla 1, se describen diveras características epidemiológicas y biológicas, comparadas con los otros nuevos coronavirus.
MERS-CoV y el MERS
El 23 de septiembre de 2012, la Organización Mundial de la Salud (OMS) informó dos casos de un síndrome respiratorio agudo con insuficiencia renal, asociado con un nuevo CoV en dos pacientes del Medio Oriente y, paralelamente, se anunció el primer caso de un nuevo coronavirus en Arabia (9,10). Por la ubicación geográfica, este nuevo cuadro clínico fue nombrado síndrome respiratorio por Coronavirus del Medio Oriente (MERS) en mayo del 2013 (11).
Con rapidez, la OMS comunicó la secuencia completa del genoma y se estableció un método diagnóstico confiable, que incluso permitió que retrospectivamente se confirmara un brote asociado al CoV-MERS, en abril del 2012 en Jordania (12,13). Rápidamente se fueron confirmando casos en Europa y países de Oriente Medio, especialmente, del reino de Arabia Saudita, Emiratos Árabes Unidos, Jordania, Qatar, Omán, etc. (14).
A pesar de que también se considera una zoonosis y que el origen de este coronavirus son los murciélagos, a diferencia del SARS-CoV, el hospedero intermediario son los dromedarios y, probablemente, con un salto de especie al menos 30 años atrás, de acuerdo con los estudios filogenéticos (3).
Para el año 2015, ya se describen casos importados en varios países, fuera de la región de Oriente Medio, tanto en Europa como en Estados Unidos y Asia (14) y, a la fecha, se ha confirmado su presencia en 27 países (15).
Punto de vista epidemiológico
Desde el punto de vista epidemiológico, se considera que la persistencia de la epidemia está relacionada con la repetición de transmisiones de dromedarios a humanos que están en contacto frecuente con residentes en la región. Además, se amplifica de persona a persona en una transmisión que no se sostiene por un R0 <1, pero se asocia a brotes durante la atención en salud y grupos de contacto estrecho (14,16-17).
La posible razón de este comportamiento puede estar relacionado con el momento de mayor transmisión (mayor excreción viral), que ocurre varios días después de presentar síntomas y, por ende, asociarse cuando ya se encuentra hospitalizado (6,18-19).
El periodo de incubación se estima en 5,2 días, con un rango de 1,9 a 14,7 días, y el 95% de los pacientes infectados tienen síntomas al día 12 (14). De la misma forma que se observó en el SARS y ahora en COVID-19, en los casos de MERS hay un predominio de contagio en hombres y, aquellos que presentan una edad mayor a 60 años o comorbilidades (hipertensión arterial, enfermedad renal crónica, diabetes, obesidad), tienen mayor riesgo de hospitalización y severidad clínica, asociado con un peor desenlace clínico (14, 20).
En la actualidad, dado que el MERS sigue siendo una enfermedad relativamente rara sobre la que los profesionales de la salud tienen poca conciencia y escaso conocimiento, sumado a que los síntomas de la infección por MERS-CoV son inespecíficos, es posible que cuando se presente un nuevo caso, fácilmente puedan ocurrir brotes en los hospitales (21).
Así mismo, dada la relación epidemiológica del contacto con el dromedario, el MERS seguirá circulando en aquellas áreas en las que haya contacto estrecho de humanos con dicho mamífero artiodáctilo, aunque seguirán apareciendo casos importados alrededor del mundo.
SARS-CoV-2 y COVID-19
A fines de diciembre de 2019, se produjo un brote de neumonía de etiología desconocida en Wuhan, provincia de Hubei (China).
Teniendo en cuenta la vigilancia establecida después del brote de SARS de 2002- 2003, en el Hospital Wuhan Jinyintan, se recogieron tres muestras de lavado broncoalveolar de un paciente con neumonía de etiología desconocida, en las que se descartó la presencia de MERS-CoV, influenza aviar, influenza y otros virus respiratorios comunes (2,23).
Los ensayos de PCR en tiempo real (RT-PCR), en estas muestras, fueron positivos para un virus pan-betacoronavirus. Rápidamente, se realizó la secuenciación del genoma completo y, la alineación de la secuencia de este genoma de longitud completa de este nuevo virus con otros genomas disponibles de Betacoronavirus, mostró una relación muy cercana con la cepa BatCov RaTG13, similar al SARS tipo murciélago, con una identidad del 96%.
El 2019-nCoV es un β CoV del grupo 2B y, dada la similitud en contrada con la secuencia genética del SARS-CoV, ha sido nombrado SARS-CoV-2 por la OMS (1). A partir de estos análisis filogenéticos, realizados con disponibilidad completa en las secuencias del genoma, los murciélagos parecen ser el reservorio del virus COVID-19 y, al parecer, los pangolines, los hospedadores intermediarios (24,25).
A partir de estos casos iniciales de Wuhan, según la OMS, en la actualidad existen cerca de 8 millones de casos confirmados y 450.000 muertes, cifras que probablemente se seguirán multiplicando vertiginosamente alrededor del mundo (26).
Características que comparte el SARS-CoV-2
Algunas características que comparte el SARS-CoV-2, con los dos descritos previamente, es la forma de transmisión (gotitas, contacto y aerosoles), posible origen zoonótico, periodos de incubación y manifestaciones clínicas.
En la tabla 1 se puede observar la comparación entre estos tres virus y, a partir de ello, se puede enfatizar que, aunque el periodo de incubación es similar, es posible que las diferencias den el periodo infectante para el SARS-CoV-2, que puede ser incluso 1 a 2 días antes de la aparición de síntomas; la posibilidad de transmisión de la población asintomática, sumado a una menor tasa de letalidad, facilita su propagación (27).
Aunque aún no se conoce con certeza su tasa de letalidad, modelos predictivos calculan que puede ser cercana a 1,5% en personas menores de 60 años y hasta 4,1% en los mayores de 60 años (28).
En principio, conserva ciertas similitudes con el SARS, como: el receptor de entrada a la célula (ACE 2), las manifestaciones clínicas (predominio de síntomas respiratorios y ocasionalmente gastrointestinales), más frecuente en hombres, mayor tasa de complicaciones asociadas a la edad y presencia de comorbilidades tales como hipertension arterial, obesidad, diabetes, enfermedad renal crónica, hipotiroidismo, entre otras (2, 8,14, 29).
Específicamente para el COVID-19
Aún no sabemos cuál es la verdadera prevalencia de personas infectadas que permanecen asintomáticas; en la literatura hay una variedad de publicaciones que pueden oscilar entre 10 y 40%, dependiendo de la metodología realizada y la población seleccionada (30).
El verdadero espectro de la enfermedad clínica, implica determinar: las proporciones de personas infectadas que son asintomáticas; quiénes son sintomáticos, pero aparentemente (para otros) asintomáticos; quiénes tienen una enfermedad similar a la influenza, neumonía focal o compromiso respiratorio severo; y también las muertes. Lo que es consistente en todos los países.
Las proporciones de gravedad han sido aproximadamente: del 80% leves a moderadas; del 15% graves; y del 5% críticas (que requieren ingreso en la UCI) (2, 29). Aproximadamente, el 5% de todas las personas infectadas requieren hospitalización.
En casi todos los estudios realizados hasta la fecha, los hombres son mucho más propensos a infectarse y a tener peores resultados, en comparación con las mujeres.
Robustos datos sobre el espectro de enfermedades, han surgido del experimento natural autónomo a bordo del crucero Diamond Princess, donde ocurrieron más de 700 casos entre 3.700 pasajeros (en su mayoría, mayores) y miembros de la tripulación (en su mayoría, más jóvenes).
De estos casos, más de 380 fueron sintomáticos y más de 330 fueron asintomáticos (el 18% de estos casos, nunca desarrollaron síntomas); entre los casos sintomáticos, 37 requirieron cuidados intensivos y 9 fallecieron (todos tenían más de 70 años) (30).
Hasta el 5% de los pacientes con COVID-19 han desarrollado el síndrome de dificultad respiratoria aguda.
El manejo clínico involucra atención de apoyo, que incluye soporte hemodinámico, oxígeno suplementario y soporte de ventilación mecánica cuando esté indica do. Se ha demostrado claramente la hipercoagulabilidad, incluida la embolia pulmonar y el accidente cerebrovascular (hasta el 1% de los casos hospitalizados; incluso en personas jóvenes), y niveles muy elevados de dímero-D.
Se ha informado de un síndrome inflamatorio multisistémico similar a la enfermedad de Kawasaki, raro pero severo, en niños y adolescentes, y se presenta con fiebre persistente, hipotensión, dolor abdominal, compromiso cardíaco y marcadores inflamatorios elevados.
El tiempo de recuperación es de aproximadamente 2 semanas para personas con enfermedad leve y de 3 a 6 semanas para personas con enfermedad grave o crítica, muchas de las cuales requieren cuidados intensivos. Las secuelas de enfermedades graves incluyen fibrosis pulmonar, lesión miocárdica, arritmias, cardiomiopatía e insuficiencia cardíaca.
Por otra parte, los pacientes con COVID-19, con enfermedad típica de leve a moderada (que representan más del 90% de los casos), han demostrado que el virus con capacidad infectante no puede aislarse después de 8 días de síntomas (31).
Los datos de 129 pacientes con COVID-19 grave o crítico, muestran que la duración de la eliminación del virus infeccioso varió de 0 a 20 días (mediana de 8 días), después del inicio de los síntomas.
La probabilidad de detectar virus con capacidad infectante cayó por debajo del 5% después de 15 días. Los pacientes graves o críticos, generalmente requieren 30 o más días de hospitalización y convalecencia domiciliaria prolongada. Estos nuevos datos no tienen implicaciones para el regreso al trabajo o la comunidad, para pacientes típicos.
Para los pacientes con enfermedades leves, el desprendimiento de ARN viral de la saliva y las secreciones nasofaríngeas, está en su valor máximo el día del inicio de los síntomas, permanece alto durante aproximadamente 6 días, disminuye de forma significativa en la segunda semana de enfermedad y, generalmente, cesa en el día 14 (32).
El máximo de duración de la prueba de PCR nasofaríngea positiva es de 43 días, desde el inicio de los síntomas, y 28 días desde la resolución de los síntomas.
El 19% de los pacientes son PCR positivos 2 semanas después de la resolución de los síntomas, pero esto no significa que la persona sea infectante (33). La eliminación del ARN viral del esputo (tracto respiratorio inferior), generalmente persiste durante 21 días desde el inicio de los síntomas (más tiempo para pacientes gravemente enfermos).
La eliminación del ARN nasofaríngeo, fluctúa de positivo a negativo en muchas personas y puede ser negativo durante 2 o más días, antes de ser detectable nuevamente. Tales fluctuaciones no deben interpretarse como reinfección o recrudecimiento de la replicación viral infecciosa.
Seroconversión pacientes con COVID-19
Con respecto a la seroconversión de los pacientes con COVID-19, la mayoría seroconvierten a la proteína de la espiga del SARS-CoV-2. Los anticuerpos IgG se desarrollan durante 7 a 50 días desde el inicio de los síntomas, y 5 a 49 días desde la resolución de los síntomas. Las medianas para títulos de anticuerpos más altos, son: 24 días desde el inicio de los síntomas y 15 días desde la resolución de los síntomas.
Por lo anterior, las pruebas de anticuerpos deben realizarse al menos 3 a 4 semanas después del inicio de los síntomas y, al menos 2 semanas después, de la resolución de los síntomas. No todos los ensayos de anticuerpos disponibles están dirigidos a la proteína de pico de SARS-CoV-2.
La presencia simple de anticuerpos en suero, aún no se ha demostrado de manera definitiva, que sea uniformemente efectiva contra la reinfección, pero la mayoría de las personas con COVID-19 clínicamente significativa desarrollarán anticuerpos neutralizantes contra la proteína de la espiga del SARS-CoV-2. Los datos están menos disponibles para la infección asintomática o leve.
La transmisión asintomática y presintomática entre los contactos del hogar (rango estimado 46% –62% de las transmisiones del hogar) es significativa, y la cuarentena de todos los contactos del hogar es una estrategia de mitigación importante.
No se ha demostrado que la transmisión por aerosoles se produzca en la comunidad. El posible papel de los sistemas de ventilación en interiores en la propagación viral, sigue sin estar claro. La transmisión en aerosol ocurre durante los procedimientos médicos y, quizá más ampliamente, en entornos hospitalarios (34). La transmisión fecal no parece ocurrir, a pesar del desprendimiento de ARN del SARS-CoV-2 en muestras de heces, durante períodos prolongados después de la resolución de la enfermedad (35).
Por otra parte, la secuenciación secuencial de más de 11.000 aislados virales a lo largo del tiempo, hasta la fecha, indica una alta homología (pequeñas mutaciones en 10-20 ubicaciones). A pesar de las frecuentes publicaciones teóricas en la literatura, no se han demostrado nuevas mutaciones virales funcionalmente significativas, aunque el virus ahora se puede dividir en múltiples clados (S, G, V y otros) (36). Los clados son útiles para rastrear el tiempo y las rutas de propagación del SARS-CoV-2.
Con respecto a tratamientos y vacunas, hasta la fecha, no hay un tratamiento efectivo que pueda se recomendado masivamente y, es posible, que aparezcan algunas alternativas para un subgrupo de pacientes. Mientras tanto, con las vacunas se ha avanzado a pasos agigantados y en la actualidad, hay dos estudios en fase 3, en los que el mundo tiene centradas sus esperanzas.
Consideraciones Finales
La posibilidad de otras zoonosis asociadas con coronavirus es alta y, por lo tanto, es un desafío, no solo evitar que aparezca con nuevas epidemias, sino mitigar las que ya están presentes.
Controlar una pandemia como la del COVID-19 resulta complejo con un R0 tan alto en condiciones normales, con un período de incubación tan largo y con manifestaciones clínicas tan amplias. La transmisión de persona a persona en Wuhan, China, parece haber estado en curso desde mediados de diciembre.
El número reproductivo, R0, se estima en 2-3 durante los períodos pico de brote, tanto por las autoridades en China como por múltiples estimaciones externas. R0 mayor que 1 indica que cada caso lleva a más de 1 caso posterior, lo que hace que el control sea mucho más difícil y, en la actualidad, la mayoría de los países están por encima de 1 o lograron llevarlo a menos con confinamientos severos, que no son sostenibles en el tiempo (38).
El control, solo se ha podido lograr reduciendo el R0 a menos de 1 con medidas de mitigación no farmacológicas, y a esto se le deben sumar las dificultades en el diagnóstico y de tratamientos efectivos.
Lecciones aprendidas de los brotes de MERS y SARS
Las lecciones aprendidas de los brotes de MERS y SARS, pueden proporcionar información valiosa sobre cómo manejar la pandemia actual.
Otros países pueden copiar las exitosas tácticas de respuesta a brotes de salud pública del gobierno chino o coreano, en medidas de mitigación no farmacológicas, desde el autocuidado como la higiene de manos, el uso de tapabocas, el aislamiento selectivo, la cuarentena, el distanciamiento físico y la contención de la comunidad, de acuerdo con la situación socioeconómica de cada país.
A medida que la pandemia continúa y se expande, aumentará la experiencia y la literatura de investigación de cada uno de los países.
Vale agregar nn comentario especial sobre los modelos, ya que son herramientas útiles, pero dependen de los supuestos en los que son construidos.
Supuestos débiles, basados en la falta de conocimiento significativo de un parámetro, en el momento en que se ejecuta el modelo, pueden cambiar drásticamente los resultados.
Varios supuestos en versiones anteriores de los modelos actuales, se basan en datos disponibles del brote de China; los datos de China se ven limitados por la débil capacidad de pruebas diagnósticas y la verificación de casos, y algunos componentes de datos pueden ser parcialmente ficticios.
Los supuestos sobre las tasas de infección asintomática, no se apoyan en estudios de anticuerpos basados en la población, y los supuestos sobre la transmisión asintomática se basan, principalmente, en la transmisión doméstica y no en la transmisión comunitaria al azar.
Muchos de los modelos suponen tasas de transmisión asintomáticas muy altas en la comunidad.
Los modelos pueden considerarse como bases para los peores escenarios de planificación, dado el conocimiento de las situaciones y la comprensión actual de las intervenciones propuestas o en curso; los modelos deben repetirse con frecuencia a medida que evoluciona el conocimiento.
Las variables e intangibles (para los cuales no existen datos actuales), solo son posibles de incluir en futuras ejecuciones del modelo en particular.
El impacto de las medidas de prevención y tratamientos no farmacológicos -y cuando existan los farmacológicos pueden aclarar futuras evoluciones de la pandemia-, pruebas diagnósticas cada vez más precisas y un mejor conocimiento de la inmunidad en los individuos recuperados dentro de una comunidad, permitirán obtener modelos más precisos.
En los países europeos que implementaron diversas medidas de mitigación (cancelación de reuniones masivas; cierre de espacios públicos, escuelas y centros de cuidado infantil; o una política recomendada de quedarse en casa), para el tiempo promedio desde la implementación del esfuerzo de mitigación hasta el caso diario, el número máximo fue de aproximadamente 3 semanas.
Para aquellos países que implementaron una política forzada de quedarse en casa, el tiempo promedio fue de 2 semanas.
Un análisis separado (utilizando datos de estudios serológicos) modeló las intervenciones no farmacéuticas, incluidos el distanciamiento social y los bloqueos nacionales, en Europa hasta el 4 de mayo de 2020, cuando algunos países comenzaron a relajar las medidas nacionales de distanciamiento social. Este estudio encontró que las intervenciones pueden haber evitado aproximadamente 3,1 millones de muertes por COVID-19 en 11 países europeos (38) .
Referencias
- 1.World Health Organization [Internet]. Novel Coronavirus (2019-nCoV): Situation Report – 1 21 January 2020. [Acceso: 15 mayo de 2020]. Disponible en: https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200121-sitrep-1-2019-ncov.pdf?sfvrsn=20a99c10_4.
- 2. World Health Organization [Internet]. Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19). [Acceso: 15 mayo de 2020]. Disponible en https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pd.
- 3. Cui J, Li F, Shi Z. Origin and evolution of pathogenic coronaviruses. Nat Rev Microbiol. 2019; 17: 181–192.
- 4. Peng GW, He JF, Lin JY. Epidemiological study on severe acute respiratory syndrome in Guangdong province. Chin J Epidemiol. 2003; 24: 350–352.
- 5. Zhong NS, Zheng BJ, Li YM, et al. Epidemiology and cause of severe acute respiratory syndrome (SARS) in Guangdong, People’s Republic of China, in February, 2003. Lancet. 2003; 362(9393): 1353-1358. Doi: 10.1016/s0140-6736(03)14630-2.
- 6. De Wit E, van Doremalen N, Falzarano D, Munster VJ. SARS and MERS: recent insights into emerging coronaviruses. Nat Rev Microbiol. 2016; 14(8): 523-534. Doi:10.1038/nrmicro.2016.81.
- 7. Song Z, Xu Y, Bao L, et al. From SARS to MERS, Thrusting Coronaviruses into the Spotlight. Viruses. 2019; 11(1): 59. Published 2019 Jan 14. Doi: 10.3390/ v11010059.
- 8. Cheng VC, Lau SK, Woo PC, Yuen KY. Severe acute respiratory syndrome coronavirus as an agent of emerging and reemerging infection. Clin Microbiol Rev. 2007; 20(4): 660-694. Doi:10.1128/CMR.00023-07.
- 9. World Health Organization [Internet]. Novel coronavirus infection – update. [Acceso: 30 de mayo de 2020]. Disponible en: https://www.who.int/csr/don/2012_09_25/en/.
Bibliografías
- 10. Zaki AM, van Boheemen S, Bestebroer TM, Osterhaus AD, FouchierRA. Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia.NEngl J Med. 2012; 367: 1814–1820. Disponible en: http://dx.doi.org/10.1056/NEJMoa1211721.
- 11. de Groot RJ, Baker SC, Baric RS, Brown CS, Drosten C, Enjuanes L,Fouchier RA, Galiano M, Gorbalenya AE, et al. Middle East respiratory syndrome coronavirus (MERSCoV): announcement of the Coronavirus Study Group. J Virol. 2013; 87: 7790–7792. Disponible en: http://dx.doi.org/10.1128/JVI.01244-13.
- 12. van Boheemen S, de Graaf M, Lauber C, Bestebroer TM, Raj VS, ZakiAM, Osterhaus AD, Haagmans BL, Gorbalenya AE, Snijder EJ,Fouchier RA. Genomic characterization of a newly discovered coronavirus associated with acute respiratory distress syndrome in humans. mBio. 2012; 3(6): e00473–12. Disponible en: http://dx.doi.org/10.1128/mBio.00473-12.
- 13. Al-Abdallat MM, Payne DC, Alqasrawi S, et al. Hospital-associated outbreak of Middle East respiratory syndrome coronavirus: a serologic, epidemiologic, and clinical description. Clin Infect Dis. 2014; 59(9): 1225-1233.
- 14. Chan JF, Lau SK, To KK, Cheng VC, Woo PC, Yuen KY. Middle East respiratory syndrome coronavirus: another zoonotic betacoronavirus causing SARS-like disease. Clin Microbiol Rev. 2015; 28(2): 465-522. Doi: 10.1128/ CMR.00102-14.
- 15. World Health Organization [Internet]. Middle East respiratory syndrome coronavirus (MERS-CoV). [Acceso: 10 de mayo de 2020]. Disponible en: https://www.who.int/emergencies/mers-cov/en/.
- 16. Abroug F, Slim A, Ouanes-Besbes L, Hadj Kacem MA, Dachraoui F,Ouanes I, Lu X, Tao Y, Paden C, Caidi H, Miao C, et al. Family cluster of Middle East respiratory syndrome coronavirus infections, Tunisia, 2013. Emerg Infect Dis. 2014; 20: 1527–1530. Disponible en: http://dx.doi.org/10.3201/eid2009.140378.
Fuentes
- 17. Assiri A, McGeer A, Perl TM, Price CS, Al Rabeeah AA, Cummings, DA, Alabdullatif ZN, et al. Hospital outbreak of Middle East respiratory syndrome coronavirus. N Engl J Med. 2013; 369: 407–416. Disponible en: http://dx.doi.org/10.1056/NEJMoa1306742.
- 18. Peiris JS, Chu CM, Cheng VC, et al. Clinical progression and viral load in a community outbreak of coronavirus-associated SARS pneumonia: a prospective study. Lancet. 2003; 361(9371): 1767-1772. Doi: 10.1016/s0140- 6736(03)13412-5
- 19. Petrosillo N, Viceconte G, Ergonul O, Ippolito G, Petersen E. COVID-19, SARS and MERS: are they closely related? Clin Microbiol Infect. 2020; 26(6): 729-734. Doi:10.1016/j.cmi.2020.03.026.
- 20. Xie M, Chen Q. Insight into 2019 novel coronavirus – An updated interim review and lessons from SARS-CoV and MERS-CoV. Int J Infect Dis. 2020; 94: 119-124. Doi:10.1016/j.ijid.2020.03.071
- 21. World Health Organization [Internet]. WHO MERS Global Summary and Assessment of Risk. [Acceso: 1 de Junio de 2020]. Disponible en: https://www.who.int/csr/disease/coronavirus_infections/risk-assessment-august-2018.pdf?ua=1&ua=1&ua=1.
- 22. WHO [Internet]. Emergencies preparedness, response. Pneumonia of unknown origin – China. Disease outbreak news. [Acceso: 1 de Junio de 2020]. Available at: https://www.who.int/csr/don/12-january-2020-novel-coronavirus-china/en/.
- 23 Hui DS, I Azhar E, Madani TA, et al. The continuing 2019-nCoV epidemic threat of novel coronaviruses to global health – The latest 2019 novel coronavirus outbreak in Wuhan, China. Int J Infect Dis. 2020; 91: 264- 266. Doi: 10.1016/j.ijid.2020.01.009.
Lecturas Recomendadas
- 24. Lam TT, Jia N, Zhang Y, et al. Identifying SARS-CoV- 2-related coronaviruses in Malayan pangolins. Nature. 2020; Disponible en: https://doi.org/10.1038/s41586-020-2169-0
- 25. Li X, Giorgi EE, Marichann MH, et al. Emergence of SARS-CoV-2 through Recombination and Strong Purifying Selection. Science Advances. 29 May, 2020: eabb9153. Doi: 10.1126/sciadv.abb9153
- 26. WHO [Internet]. Coronavirus disease (COVID-19) Situation Report – 148. [Acceso: 16 de junio de 2020]. Disponible en: https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200616-covid-19-sitrep-148-draft.pdf?sfvrsn=9b2015e9_2.
- 27. Liu Z, Chu R, Gong L, Su B, Wu J. The assessment of transmission efficiency and latent infection period on asymptomatic carriers of SARS-CoV-2 infection [published online ahead of print, 2020 Jun 13]. Int J Infect Dis. 2020; S1201-9712(20): 30471-9. Doi:10.1016/j. ijid.2020.06.036
- 28. Verity R, Okell LC, Dorigatti I, et al. Estimates of the severity of coronavirus disease 2019: a model-based analysis [published correction appears in Lancet Infect Dis. 2020 Apr 15;
- 29. Cummings MJ, Baldwin MR, Abrams D, et al. Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: a prospective cohort study. Lancet. 2020; 395(10239): 1763-1770. Doi: 10.1016/S0140-6736(20)31189-2
- 30. Tabata S, Imai K, Kawano S, et al. Clinical characteristics of COVID-19 in 104 people with SARS-CoV-2 infection on the Diamond Princess cruise ship: a retrospective analysis [published online ahead of print, 2020 Jun 12]. Lancet Infect Dis. 2020; S1473-3099(20): 30482-5. Doi: 10.1016/S1473-3099(20)30482-5
Referencias Bibliográficas
- 31. Oran DP, Topol EJ. Prevalence of Asymptomatic SARS-CoV-2 Infection: A Narrative Review [published online ahead of print, 2020 Jun 3]. Ann Intern Med. 2020; M20- 3012. Doi:10.7326/M20-3012.
- 32. Wölfel R, Corman VM, Guggemos W, et al. Virological assessment of hospitalized patients with COVID-2019. Nature. 2020; 581(7809): 465-469. Doi:10.1038/s41586- 020-2196-x
- 33. Alvarez-Moreno CA, Rodríguez-Morales AJ. Testing Dilemmas: Post negative, positive SARS-CoV-2 RT-PCR – is it a reinfection? [Published online ahead of print, 2020 May 15]. Travel Med Infect Dis. 2020; 101743. Doi:10.1016/j.tmaid.2020.101743
- 34. Omano-Bertrand S, Aho-Glele LS, Grandbastien B, Gehanno JF, Lepelletier D. Sustainability of SARS-CoV-2 in aerosols: Should we worry about airborne transmission? [Published online ahead of print, 2020 Jun 12]. J Hosp Infect. 2020; S0195-6701(20): 30303-0. Doi:10.1016/j. jhin.2020.06.018
- 35. Wong MC, Huang J, Lai C, Ng R, Chan FKL, Chan PKS. Detection of SARS-CoV-2 RNA in fecal specimens of patients with confirmed COVID-19: a meta-analysis [published online ahead of print, 2020 Jun 11]. J Infect. 2020; S0163-4453(20): 30394-7. Doi:10.1016/j. jinf.2020.06.012
- 36. Naqvi AAT, Fatima K, Mohammad T, et al. Insights into SARS-CoV-2 genome, structure, evolution, pathogenesis and therapies: Structural genomics approach [published online ahead of print, 2020 Jun 13]. Biochim Biophys Acta Mol Basis Dis. 2020; 165878. Doi:10.1016/j. bbadis.2020.165878.
Fuentes Bibliográficas
- 37. Kim JS, Jang JH, Kim JM, Chung YS, Yoo CK, Han MG. Genome-Wide Identification and Characterization of Point Mutations in the SARS-CoV-2 Genome. Osong Public Health Res Perspect. 2020; 11(3): 101-111. Doi:10.24171/j.phrp.2020.11.3.05.
- 38. Flaxman S, Mishra S, Gandy A, et al. Estimating the effects of non-pharmaceutical interventions on COVID-19 in Europe. Nature (2020). Disponible en: https://doi.org/10.1038/s41586-020-2405-7
Recibido: 18 de junio de 2020
Aceptado: 28 de junio de 2020
Correspondencia:
Carlos Arturo Álvarez-Moreno
caalvarezmo@unal.edu.co
Autor
1 Carlos Arturo Álvarez-Moreno. MD, MSc, PhD. Profesor titular de Enfermedades Infecciosas y Medicina Tropical, Departamento de Medicina Interna, Facultad de Medicina, Universidad Nacional de Colombia. Vice-Presidente de Salud, Clínica Colsanitas. Miembro correspondiente, Academia Nacional de Medicina. Bogotá, Colombia.






