Sofía Isabel Freyre-Bernal1, Jhan Sebastián Saavedra-Torres2, Luisa Fernanda Zúñiga-Cerón2, Andrés Felipe Olaya-Castañeda3 y Carolina Salguero4
Resumen
Se sabe que las células tumorales consumen más glucosa que las no tumorales. Además, las células tumorales expresan isoformas embrionarias de enzimas para la glucólisis, permitiendo su mayor actividad y obtención de energía en los diversos procesos cancerígenos.
Algunos autores han sugerido que la hipoxia del tumor actúa como regulador del metabolismo energético y que puede redirigir a las células tumorales a utilizar la glucólisis como fuente de provisión de ATP cuando hay limitación de oxígeno.
Otros autores sugieren que ese es el resultado de mutaciones en oncogenes, genes supresores y enzimas de la vía glucolítica o del metabolismo oxidativo mitocondrial (Myc, Akt, p53, HIF1-α).
La aplicación de la tomografía de emisión de positrones (PET) en los servicios de medicina nuclear y radiología ha permitido usar la mitocondria como un organelo para el diagnóstico de cáncer cuantificando una mayor captación de glucosa por las células tumorales respecto del tejido no tumoral adyacente, mediante el uso del análogo radioactivo no metabolizable de la glucosa (18FDG, 18F-2-desoxiglucosa).
Así pues, las investigaciones se han centrado en el metabolismo alterado como parte del desarrollo y crecimiento tumoral con el objetivo de inhibir la progresión a la metástasis de esta patología en los pacientes que no se pueden recuperar recibiendo tratamiento con quimioterapia y la radioterapia.
El objetivo de esta revisión documental consiste en resaltar las generalidades e importancia de las mitocondrias en los mecanismos que promueven el cáncer. (Vea también: Artículo de Investigación: Pacientes con Enfermedad Pulmonar Obstructiva Crónica en Bogotá, Colombia)
Palabras claves: mitocondria; adenosín trifosfato; biogénesis de organelos; apoptosis; cáncer; medicina nuclear. (DeCS)
Cancer and Mitochondria: a Central Aspect to Tumor Development and Growth
Abstract
Tumor cells consume more glucose than the non-tumor cells. In addition, tumor cells express isoforms of embryonic glycolytic enzymes with higher activity to obtain energy in the various carcinogenic processes.
Some authors have suggested that hypoxia of the tumor acts as a regulator of energy metabolism and can redirect to tumor cells to use the glycolysis as source for the supply of ATP when there is limitation of oxygen. In contrast, other authors suggest that this phenomena is the result of mutations in oncogenes, tumor suppressor genes and enzymes of the glycolytic pathway or oxidative metabolism mitochondrial including Myc, Akt, p53, HIF1-α.
The application of Positron Emission Tomography (PET) in nuclear medicine services and radiology has allowed the use of mitochondria as an organelle that serves to diagnose cancer, quantify greater uptake of glucose by tumor cells on adjacent non-tumor tissue using analogue radioactive non-metabolizable glucose (18FDG, 18F-2-desoxiglucosa).
Such research has fo- cused on altered metabolism as part of development and tumor growth to inhibit the progression of cancer to metastases in patients that cannot be recovered by chemotherapy and radiation therapy. The aim of this review is to highlight the generalities and importance of mitochondria in the mechanisms that promote cancer.
Key words: mitochondria; adenosine triphosphate; organelle biogenesis; apoptosis; cancer; nuclear medicine. (DeCS)
Introducción
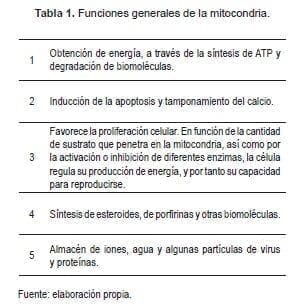
Las mitocondrias desempeñan diversas funciones entre ellas la producción de ATP y la de algunos intermediarios biosintéticos y también contribuye a dar respuesta ante el estrés celular mediante mecanismos como la autofagia y la apoptosis. Conforman una red dinámica que está integrada a otros compartimentos celulares (1).
En este sentido, cumplen un papel fundamental en la generación de energía metabólica en las células eucariotas, responsables de la producción de la mayor parte de la energía útil derivada de la descomposición de los carbohidratos y ácidos grasos, que se convierte en ATP mediante el proceso de la fosforilación oxidativa (2) (Tabla 1).
 Metodología
Metodología
Se desarrolló una revisión bibliográfica en un margen de tiempo de 100 años, entre 1916 y 2016, con el objetivo de rastrear la evidencia actual validada y la evidencia histórica que aborda los estudios sobre la mitocondria.
De ese modo, se recolectó un total de 106 documentos seleccionados a partir de la búsqueda bibliográfica en las bases de datos: Scielo, Elsevier, Pubmed, Redalyc, Springer, ScienceDirect, Medwave, Nature Reviews, Cochrane, EBSCO, Naxos y algunas bases de datos a las que ofrecen acceso la Universidad del Cauca y la Universidad de Harvard.
La búsqueda se limitó a la revisión de artículos publicados en el idioma inglés y español. Se desarrolló utilizando los términos DeCS: proteínas mitocondriales, ADN mitocondrial, cáncer, fosforilación oxidativa y angiogénesis.
Para la gestión y la organización de la información, se utilizó el programa de libre acceso Mendeley; y se seleccionaron únicamente los estudios de los tipos: estudios experimentales, artículos originales y artículos de revisión documental que demostraran rigor sistemático en los análisis y que se enfocaran en los aspectos bioquímicos, biológicos, patológicos y experimentales acerca de los descubrimientos innovadores sobre la función de la mitocondria en los procesos cancerígenos.
Adicionalmente, se realizaron revisiones de libros, manuales, mapas conceptuales y archivos que contuvieran información relevante y constatada sobre la biología y fisiopatología del cáncer en la actualidad. Finalmente, se construyó un marco teórico representado en la estructura del presente artículo.
La Mitocondria y la Síntesis de Energía: la Fosforilación Oxidativa
La fosforilación oxidativa, que tiene lugar en la membrana interna mitocondrial, constituye un proceso de obtención de energía a partir de dos mecanismos íntimamente relacionados: el transporte de electrones, cuya ocurrencia se da en la cadena respiratoria, y la gestión del gradiente de protones a través de la ATP sintasa (3).
Los substratos para estos procesos, en especial el poder reductor en forma de NADH y FADH, se obtienen a través de los procesos degradativos que tienen lugar en la matriz mitocondrial, tales como el ciclo de Krebs y la beta oxidación de ácidos grasos (4).
La cadena respiratoria se encuentra formada por cuatro complejos proteicos (numerados del I al IV), por los cuales transitan los electrones desde el NADH y FADH2 hasta su incorporación en el oxígeno para formar agua, y dos complejos transportadores que se encargan de canalizar los electrones entre los complejos proteicos (4).
Todos los complejos proteicos tienen en común un centro metálico que en el caso de los complejos I, II y III es sulfoférrico, mientras que en el complejo IV es de cobre (3). La diferencia en la disposición y número de moléculas metálicas que intervienen en el proceso condicionan las diferencias del poder reductor de los complejos (4).
Adicionalmente, el tránsito de los electrones a través de los diferentes complejos proteicos de la cadena respiratoria genera un potencial REDOX que se utiliza para crear un gradiente de protones entre el espacio intermembrana y la matriz mitocondrial, ahí los protones ingresan a dicho espacio.
El retorno a la matriz de los protones a favor de gradiente a través de la ATP sintasa produce cambios en la configuración espacial de esta, lo cual posibilita la fosforilación del ADP y la producción de ATP (4).
Por otra parte, los complejos I, III y IV atraviesan la membrana mitocondrial interna y participan en el paso de protones desde la matriz mitocondrial al espacio intermembrana, mientras que el complejo II solo contacta con la matriz mitocondrial e interviene en el ciclo de Krebs aportando la enzima succinato deshidrogenasa.
Esta enzima facilita el paso de succinato a fumarato y la consiguiente reducción del FAD + a FADH (4). Sin embargo, cada complejo cumple con otras funciones (4) así, el complejo IV recibe y almacena los electrones cedidos por el complejo III para entregarlos adecuadamente al oxígeno y formar agua, mientras que el complejo III posibilita la interrelación con los otros complejos transportadores dependientes de la ubiquinol-citocromo-c reductasa (CoQ y CytC-cardiolipina) (4).
En consecuencia, como se decía anteriormente, la cadena respiratoria se completa con dos complejos trasportadores: uno dentro de la membrana interna y de naturaleza lipídica (CoQ) que se encarga del transporte de electrones desde los complejos I y II al III; y otro de naturaleza proteica con centro férrico ubicado en el espacio intermembrana (CytC-cardiolipina) que se encarga del transporte de electrones desde el complejo III al IV.
Cuando la cesión de electrones entre los complejos no es adecuada, se producen especies reactivas del oxígeno (ROS) (4).
El Efecto Warburg
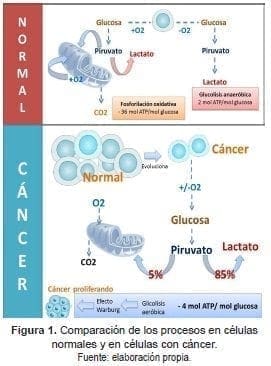
En el proceso conocido como glucólisis, la glucosa se introduce en la célula a través de los transportadores de glucosa y se metaboliza en piruvato en el citosol. Este proceso produce una pequeña cantidad de ATP, dos moléculas.
En las células normales quiescentes, el piruvato derivado de la glucólisis se importa a la matriz mitocondrial donde posteriormente se convierte en acetil-CoA por la acción del complejo enzimático piruvato deshidrogenasa (PDH).
La molécula de acetil-CoA participa en el ciclo de los ácidos tricarboxílicos (TCA) (ciclo de Krebs) en el que se genera poder reductor (NADH y FADH2) el cual se oxida mediante la fosforilación oxidativa. Este proceso es altamente eficiente para la generación de ATP. La oxidación completa de una molécula de glucosa produce 36 moléculas de ATP (38 si se incluyen los 2 ATPs producidos por la glucólisis) (5, 6).
La mayoría de las células cancerosas presentan alteraciones en el metabolismo de la glucosa (7). Comparadas con las células normales, las células cancerosas describen un incremento en la captación de glucosa y anomalías en la glucólisis.
Este incremento en el consumo de glucosa genera una mayor cantidad de metabolitos glucolíticos y aumenta la cantidad de ATP generado por la glucólisis. Una gran parte del carbono proveniente de la glucosa, en la forma de varios intermediarios glucolíticos, se introducen en múltiples vías biosintéticas.
La mayoría del piruvato generado durante la glucólisis se convierte ulteriormente en lactato en el citoplasma por la acción de la enzima lactato deshidrogenasa (LDH), se secreta y no se oxida en la mitocondria (5, 6).
Este cambio en el metabolismo fue observado por primera vez por Otto Warburg en 1924 quien lo nombró glucólisis aerobia o efecto Warburg. La hipótesis de Warburg sostenía que este metabolismo alterado era específico de las células del cáncer y que se originaba por defectos mitocondriales que inhiben la capacidad de oxidar de manera efectiva la glucosa a CO2. Una extensión de esta hipótesis propuso que las mitocondrias disfuncionales provocan cáncer (8, 9).
En la Figura 1, se aprecia cómo en la mitocondria normal sin activación de oncogenes se puede desarrollar la fosforilación oxidativa y la glucolisis anaeróbica en un equilibrio. Los tejidos tumorales metabolizan aproximadamente diez veces más glucosa a lactato que los tejidos normales en un tiempo dado.
El efecto Warburg sostiene que lo que conduce a la carcinogénesis es una respiración celular defectuosa causada por un daño en las mitocondrias, además describe que las células cancerosas hacen uso de la glicólisis seguida de fermentación láctica como fuente de energía, incluso si hay oxígeno en cantidad apropiada para la respiración.
 El Superóxido Dismutasa (SOD) Antioxidante Vital para la Célula
El Superóxido Dismutasa (SOD) Antioxidante Vital para la Célula
Por otra parte, la mitocondria posee un antioxidante vital para la célula, el superóxido dismutasa (SOD), el cual permite que la célula no entre en oxidación temprana como ocurre en las enfermedades de envejecimiento precoz y en otras patologías como el cáncer.
En estas enfermedades los oxidantes degradan las células en menor tiempo y se genera la destrucción de los tejidos por causas metabólicas, ambientales, genéticas y hormonales (10- 12).
Todos esos cambios causan daño oxidativo en la célula por acumulación de oxígeno reactivo en las especies (ORE). Esos compuestos inestables le pueden producir daño a los lípidos, a las proteínas y al ADN.
Eso explicaría por qué se envejece y se puede tener predisposición al cáncer. Algunos genes mutados pueden hacer que la célula entre en lo que podría considerarse ‘vida eterna’, término inapropiado, pero que por motivos didácticos se contrapone con el de envejecimiento y muerte celular (apoptosis).
Sin embargo, hay otros factores que contribuyen a conducir a las células a la apoptosis y hacer crecer nuevas células normales, el ADNmt se considera uno de los protagonistas de este proceso (10- 12).
Cuando falta el SOD, el antioxidante, la célula entra en oxidación y degeneración. En ese momento, cambia la información de los telómeros que cada vez se hacen más cortos y presentan pérdida de genes.
Este proceso es producido por la enzima telomerasa que causa que estos se mantengan casi iguales a los normales y conduce a que la célula que presentaba inmortalidad, se reproduzca indiscriminadamente y se multiplique por todo el cuerpo; a ese proceso se le denomina cáncer (10-12).
En condiciones normales, cuando el ADN del núcleo celular nota una alteración en la producción y formación de las células hijas, frena dicha producción e induce a la célula a la apoptosis. No obstante, si no puede hacerlo porque el daño ya es demasiado grave y no puede repararlo, la célula se sigue multiplicando en forma anómala y como consecuencia el paciente puede manifestar un cáncer o cualquier otra enfermedad degenerativa de origen neurológico o metabólico (10-12).
1 Bioquim. MSc. Docente. Departamento de Ciencias Fisiológicas, Facultad de Ciencias de la Salud, Universidad del Cauca, Popayán, Colombia.
2 Estudiantes del programa de Medicina, Facultad de Ciencias de la Salud, Universidad del Cauca, Grupo de Investigación en Salud (GIS), Popayán, Colombia.
3 Estudiante del programa de Biología, Facultad de Ciencias Naturales, Exactas y de la Educación, Universidad del Cauca, Popayán, Colombia.
4 Bioquim, PhD. Departamento de Biología Celular y Molecular, Universidad de Harvard, Cambridge, Massachusetts 02138, USA.
Los Genes Mitocondriales
La mitocondria posee su propio ADN el cual, aunque pequeño, codifica ciertas proteínas y complejos importantes para todas las funciones mitocondriales. Justamente por esa propiedad fue posible decodificarlo relativamente temprano, para 1981 todas sus secuencias fueron decodificadas (13).
El ADN mitocondrial posee estructura circular y contiene aproximadamente 16.500 pares de bases, lo que lo hace más pequeño que el ADN nuclear. Todas las mitocondrias contienen muchas copias de cada molécula de ADN que se encuentran distribuidas en diferentes grupos por toda la matriz mitocondrial y se cree que se encuentran adheridas a la membrana mitocondrial interna.
No se sabe con seguridad si el ADN mitocondrial se encuentra empacado, pero se cree que se parece más al bacteriano, que no posee histonas, que al nuclear. Aunque la cantidad de proteínas codificadas a partir de este ADN mitocondrial es muy poca, este genoma sufre procesos como la replicación, transcripción y traducción (13).
A partir del ARN de transferencia mitocondrial y de las secuencias de aminoácidos de proteínas codificadas por el genoma mitocondrial ha sido posible localizar todos los genes mitocondriales humanos en la molécula (13). Las mitocondrias contienen ADN y ARN, además de ribosomas para la biosíntesis de algunas proteínas en la matriz (14, 15).
El ADN mitocondrial solo codifica el 1% de las proteínas de este orgánulo, la mayoría de ellas son codificadas en los genes nucleares, sintetizadas en los ribosomas del citosol e importadas a la mitocondria a través de señales de direccionamiento reconocidas por la translocasa del complejo de la mitocondria externa (16).
Los genomas mitocondriales muestran una gran variación como consecuencia de la evolución divergente (14). Los genes mitocondriales que se han conservado a través de la evolución incluyen genes ARNr, ARNt, y un pequeño número de genes que codifican proteínas implicadas en el transporte de electrones y la síntesis de ATP (17).
Así pues, el genoma mitocondrial conserva similitud con su antepasado procariota, como hacer parte de la maquinaria para sintetizar proteínas. Además, algunos de los codones que las mitocondrias utilizan para especificar aminoácidos se diferencian de los codones eucariotas estándar.
Sin embargo, la gran mayoría de las proteínas mitocondriales se sintetizan a partir de genes nucleares que se transportan hacia la mitocondria. Estos incluyen las enzimas requeridas para el ciclo del ácido cítrico, las proteínas implicadas en la replicación del ADN y la transcripción, y proteínas ribosomales (17).
Así pues, los complejos de proteínas de la cadena respiratoria comprenden una mezcla de proteínas codificadas por genes mitocondriales y proteínas codificadas por genes nucleares. Las proteínas tanto en las membranas mitocondriales externas e internas ayudan a transportar los compuestos recién sintetizados (17).
La Apoptosis Guiada por la Mitocondria
Los procesos de apoptosis se ejecutan normalmente durante el desarrollo para suprimir las células innecesarias o para eliminar las células que han sido dañadas por distintos agentes estresantes tales como la radiación o la oxidación (18).
Si la apoptosis no opera correctamente se pueden presentar tumores (19), inmunodeficiencia, autoinmunidad o trastornos neurodegenerativos (20). Cuando los genes mutan y generan proteínas con acción antiapoptosis, la célula presenta una actividad de proliferación y supervivencia elevada; de esa forma se crea una actividad de hiperpolarización en la mitocondria para realizar los procesos de fermentación y regulación energética de la mitocondria oncogénica.
A su vez, la mutación de estos genes posibilita que la célula pueda producir un desequilibrio aumentando en su producción de radicales libres, en la permeabilidad de los poros sin inducir a la apoptosis ni dañarla (Figura 2).
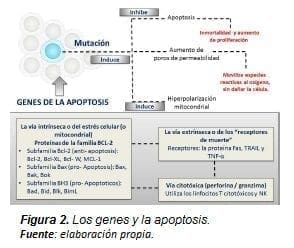 En la década de 1990, se obtuvo el primer indicio sobre el papel que desempeña la mitocondria en la inducción de la apoptosis cuando se demostró que la presencia de este organelo era necesaria para estimular la apoptosis en un tubo de ensayo (20).
En la década de 1990, se obtuvo el primer indicio sobre el papel que desempeña la mitocondria en la inducción de la apoptosis cuando se demostró que la presencia de este organelo era necesaria para estimular la apoptosis en un tubo de ensayo (20).
Desde entonces, los estudios se centraron en analizar diferentes características esenciales de este organelo para que desempeñe ese papel como por ejemplo: la capacidad de regular la permeabilidad de sus membranas controlando la liberación de componentes proteicos al citoplasma y la producción de radicales libres como el superóxido (20).
En ese contexto, la principal vía para la transmisión de una señal apoptótica (20) ocurre cuando el sistema nervioso se sobreexcita por la presencia de glutamato como pasa en los procesos isquémicos (21). En ellos, se ha observado una entrada masiva y prolongada del ion Ca2+ al citoplasma que es ‘detectada’ por la mitocondria (20).
La unión de ligandos a receptores ‘de muerte’ como el TNFR1 o Fas localizados en la membrana citoplasmática activa las rutas de señalización que se dirigen a la mitocondria (22). Además, la célula también posee receptores de factores tróficos y citocinas que, en el caso de que dejen de estimularse, desencadenan cascadas que conducen a modificaciones en la permeabilidad de las membranas de la mitocondria (20).
Por último, el daño en el genoma celular puede ser detectado por ciertos factores de transcripción, como el p53, que inducen al incremento de las concentraciones citoplasmáticas de algunas proteínas que se traslocan a la mitocondria para ejercer el efecto proapoptótico (20, 23).
El gen p53 constituye el segundo gen supresor de tumores. La pérdida de su función se involucra en el desarrollo de cáncer de colon, mama, pulmón y cerebro. La inactivación puede ocurrir mediante la pérdida cromosómica o mutación.
El gen Bcl-2 opera como gen regulador de la muerte celular programada (apoptosis). La proteína Bcl-2 funciona en la membrana celular de la mitocondria prolongando la vida de la célula individual y previniendo su apoptosis.
El incremento en la vida de las células afectadas puede no conferir una transformación maligna, pero permite la activación de protooncogenes o la pérdida de la función de los genes supresores de tumores (24- 30).
Todos los miembros antiapoptóticos de la familia de genes Bcl-2 se pueden comportar como oncogenes potenciales y algunas mutaciones pueden incrementar su expresión indirectamente como, por ejemplo, en las translocaciones observadas en linfomas y leucemias.
Por otra parte, los miembros proapoptóticos de esta familia pueden actuar como genes supresores de tumores. Así, el gen Bax se encuentra mutado en algunas formas de cáncer gastrointestinal y en leucemias (24).
En ese sentido, el desafío que se encuentra por delante consiste en mapear las funciones, en las vías bioquímicas de apoptosis, de las proteínas apoptóticas encontradas recientemente. Eso permitirá entender mejor cómo la célula toma la decisión entre la vida y la muerte.
Igualmente, es importante estudiar cómo estas vías se modifican en ciertas enfermedades humanas como las patologías neurodegenerativas y el cáncer; y cuánto de esta desregulación contribuye con su patogenia. De esa manera, se podrían diseñar nuevas estrategias terapéuticas para esas enfermedades (24, 31, 32).
Las Caspasas, Enzimas de la Apoptosis que convergen en la Mitocondria
Las caspasas son enzimas fundamentales para la muerte. La mayoría de estímulos que conducen a la apoptosis convergen en la mitocondria y provocan una permeabilización de su membrana externa. Con la permeabilización, se libera una serie de proteínas que activan las caspasas (33).
Estas se localizan en forma de procaspasas en el citoplasma y en el espacio intermembranal de las mitocondrias, se activan mediante clivaje y actúan como ejecutoras que escinden moléculas de supervivencia celular y ponen en marcha las actividades que inducen a la muerte de la célula (33).
Actualmente, se han identificado 14 caspasas en mamíferos. Las caspasas 1 y 11 funcionan principalmente en el procesamiento de citocinas, mientras que las caspasas 2, 3, 6, 7, 8, 9, 10 y 12 participan en la regulación y ejecución de la apoptosis (33).
La función de las otras caspasas todavía está por describirse. Así pues, estas son divididas en dos grupos: las caspasas iniciadoras con un dominio largo y las caspasas efectoras con un domino corto las cuales actúan sobre las endonucleasas y son las responsables directas de la fragmentación del ADN (33).
La cadena de degradación proteica presenta sucesivos clivajes dependientes de la ubicación del ácido aspártico que se repite en la estructura de la enzima. Por lo pronto, se reconocen dos vías alternativas para activar las caspasas: la primera es iniciada por señales externas que activan un receptor de muerte en la superficie celular (vía extrínseca); y la segunda es activada por cambios en la integridad mitocondrial (vía intrínseca) (33).
Una Baja Apoptosis, el proceso responsable de la Patología Oncológica
De acuerdo con lo desarrollado anteriormente, cuando se descontrola la regulación de la apoptosis, se inicia el caos. La apoptosis constituye el proceso fundamental para que el desarrollo embrionario celular transcurra correctamente, para que se eliminen los linfocitos B y T autorreactivos y para que tengan lugar muchas otras funciones normales del organismo.
Como mecanismo auto protector, la apoptosis se encarga de contrarrestar la proliferación celular descontrolada que se evidencia en los cánceres y que tiene lugar por la acumulación de mutaciones del ADN (11, 34- 36).
Si se muta una proteína importante para la defensa del organismo, como la p53, se pone en riesgo la función protectora de la apoptosis y se podrían acumular otras mutaciones sin que nada pueda impedirlo.
Muchas funciones que se regulan con esta proteína se suelen considerar las principales inductoras del cáncer. Otro ejemplo de la importancia de este proceso se ve reflejado en el hecho de que algunos virus tienen la capacidad de bloquear la apoptosis y eso les permite replicarse con menos impedimentos permitiendo que se diseminen con mayor rapidez.
Simultáneamente, con una situación de ese tipo coexiste la posibilidad de modificar el ADN de la célula buena para estimular la progresión del cáncer (11, 37, 38).

 El Superóxido Dismutasa (SOD) Antioxidante Vital para la Célula
El Superóxido Dismutasa (SOD) Antioxidante Vital para la Célula