Introducción
A través de la historia se ha reconocido la importancia del estado nutricional en la evolución de las enfermedades, así como el papel que desempeña una buena nutrición en la recuperación y rehabilitación del paciente. Desde tiempos remotos, se ha intentado dar soporte nutricional a personas con incapacidad para alimentarse por la vía oral normal, utilizando la vía rectal. Más recientemente, se han utilizado la vía gástrica directa o la vía yeyunal. El soporte nutricional por vía parenteral fue popularizado por Dudrick y asociados del grupo de J. E. Rhoads de Filadelfia, y actualmente representa un poderoso elemento terapéutico.
El paciente con cáncer exhibe una variedad de alteraciones fisiológicas y metabólicas, las cuales se hacen más pronunciadas con las terapias quirúrgicas o antineoplásicas. El soporte nutricional es un componente importante del tratamiento del paciente que padece una neoplasia maligna.
Las consecuencias de la desnutrición:
Han sido evaluadas en numerosos estudios clínicos que demuestran que en el paciente malnutrido la cicatrización es defectuosa y que aquellos con desnutrición severa presentan una elevada tasa de complicaciones, más de dos veces mayor que en los individuos con buen estado nutricional, con la consiguientes repercusiones en cuanto a tiempo de hospitalización y costos.
Se han realizado trabajos sobre nutrición enteral y parenteral temprana pre y postratamiento en pacientes con enfermedades graves y con trauma severo, los cuales muestran una reducción importante en el número y calidad de las complicaciones, con la reducción, correspondiente, de la mortalidad y de los costos.
Estos parámetros adquieren mayor importancia en los pacientes con cáncer, no sólo por el efecto que sobre la nutrición tiene el tumor, sino sobre los resultados del tratamiento. Por ello, hoy se reconoce que es esencial lograr un estado nutricional adecuado para la recuperación y la tolerancia a los distintos tipos de tratamiento, y que el soporte nutricional es un elemento de gran importancia en el manejo de los pacientes con enfermedad neoplásica maligna.
La desnutrición se define según los siguientes criterios:
- Pérdida de peso reciente y no intencionada mayor o igual al 10%
- Albumina sérica menor 3,5 g/l
- Transferrina menor 2 g/l.
- Linfopenia 1,2 x103 /ml
- Alteración de los parámetros antropométricos:
EPT menor 10 mm en hombres y menor de 13 mm en mujeres
CMB menor 23 cm en hombres y menor de 22 cm en mujeres
En algunos casos seleccionados se hace estudio de la inmunidad celular retardada con antígenos cutáneos para determinar anergia. Esta prueba no es de uso rutinario y tiene poca especificidad, en particular en pacientes con cáncer.
La caquexia, con pérdida de masa proteica y de grasa corporal, es un fenómeno común en la enfermedad neoplásica. La pérdida de peso ocurre en forma pronunciada en pacientes con cáncer visceral, especialmente del estómago y del páncreas, y es menos notoria en casos de cáncer tiriodeo o cáncer mamario. Los tumores de esófago producen disfagia por obstrucción mecánica al paso del alimento.
La quimioterapia puede producir estomatitis y mucositis severas, fenómenos que interfieren con la alimentación oral.
Evaluación Nutricional
La valoración nutricional se practica, según un método estándar, en todo paciente con cáncer que acude para tratamiento al Instituto Nacional de Cancerología.
Como primer paso se realiza la Valoración Global Subjetiva en la consulta de ingreso o en la consulta especializada, la cual incluye los siguientes parámetros:
- Cambios recientes en el peso corporal.
- Cambios en el hábito alimentario (ingestión de menos del 50% del requerimiento básico; dieta líquida, dieta hipocalórica, ayuno).
- Síntomas gastrointestinales (vómito, náusea, anorexia, disfagia, odinofagia, sensación de plenitud precoz, tratamientos quirúrgicos recientes sobre el tracto GI, diarrea, estreñimiento, dolor o sangrado con las evacuaciones. Antecedentes de mala absorción o de ingestión de drogas de acción directa sobre el tracto GI y su causa).
- Capacidad funcional (autosuficiente, requiere ayuda, está reducido al lecho).
- Diagnóstico primario y su relación con el estado nutricional (trauma, sepsis, cirugía).
- Signos físicos (estomatitis, queilitis, glositis, fracturas).
- Hallazgos al examen físico (pérdida de grasa subcutánea, hipotrofia muscular, edemas).
Con estos datos fundamentales que aporta el examen físico, se clasifica el paciente según su estado nutricional:
- Bien nutrido
- En riesgo de desnutrición
- Desnutrido
En aquellos pacientes en las dos últimas categorías, se procede con la valoración nutricional formal de mayor profundidad, procedimiento que está a cargo de una nutricionista.
La valoración nutricional formal incluye los siguientes componentes:
Antropometría
- Datos generales: Peso (actual, usual, ideal), pérdida de peso y porcentaje de la pérdida. Talla y edad.
- Masa muscular: Circunferencia del brazo (CB), circunferencia muscular del brazo (CMB) y área muscular del brazo (AMB).
- Masa grasa: Espesor del pliegue cutáneo del tríceps (PCT) y/o el promedio de 4 pliegues.
Los parámetros antropométricos se determinan mediante las siguientes ecuaciones:
- Circunferencia muscular a nivel del triceps CMB = circunferencia brazo menos el producto de 0,314 x PCT AMB = CMB²/2
- Índice creatinina/Talla
- Indice de riesgo nutricional IRN= Albúmina (g/l) x 1,519 + 0,417 x % pérdida de peso
- E Indice de masa corporal IMC = Peso/talla²
Bioquímica
- Creatininuria en orina de 24 horas • Proteína total, albúmina y pre-albúmina en plasma
- Recuento de linfocitos
- Transferrina
- En casos especiales, colesterol y triglicéridos
Diagnóstico y Plan Nutrticional
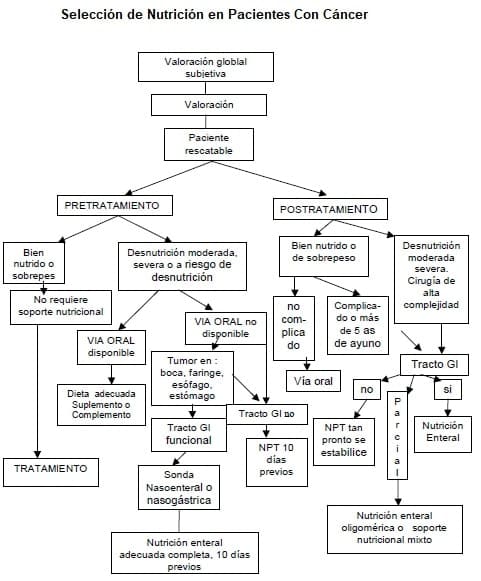
La valoración permite establecer el diagnóstico nutricional y hacer las recomendaciones correspondientes, las cuales quedan contenidas en un plan nutricional específico para cada caso particular. El plan debe contemplar reposición, mantenimiento o rehabilitación.
La nutrición parenteral (NP) en el paciente con cáncer está indicada cuando el pronóstico es bueno y se ha tomado la decisión de emprender terapia antineoplásica. La manera de administrarla, o sea el acceso, la composición y las dosis, se define según los resultados de la valoración nutricional y el tiempo estimado de ayuno.
Cuando sea posible, se prefiere la nutrición por vía enteral (NE) para la mayoría de los pacientes, según sus condiciones particulares. En el paciente hospitalizado, la NE se administra, al igual que la NP, según estrictos protocolos de manejo.
Una vez definido el diagnóstico y establecido el plan de soporte, el Grupo de Soporte Nutricional asume el manejo según indicaciones, y siempre de acuerdo con las condiciones individuales.
Indicaciones para soporte nutricional
- Primero, paciente en desnutrición moderada o severa que vaya a ser sometido a cirugía mayor.
- Segundo, Paciente en riesgo de desnutrición y con ayuno mayor de 5 días.
- Tercero, Pacientes en el postoperatorio de cirugía de alta complejidad y que tengan la imposibilidad de usar la vía oral.
- Cuarto, Pacientes en postoperatorio de intervenciones sobre cavidad oral, faringe o esófago cervical que impidan la ingestión por vía oral y/o en quienes se prevé un período de ayuno prolongado (más de 5 días).
- Quinto, Pacientes en postoperatorio de intervenciones que comprometan el tracto gastrointestinal y que obligan a un ayuno mayor de 5 días.
- Sexto, Pacientes con íleo adinámico de más de 5 días de duración o con alta posibilidad de hacerlo por el tipo de intervención practicada.
- Décimo, Pacientes sometidos a cirugías de rescate (exenteración pélvica) o reconstrucciones (bolsa de Indiana o similares).
- Once,Fístulas intestinales.
- Doce, Estados sépticos.
- Trece, Estados con déficit de la conciencia por trastornos cerebrales postquirúgicos o por enfermedad de base.
- Catorce, Regímenes de quimio o radioterapia que se compliquen por intolerancia a la vía oral o alteraciones del tubo digestivo que ameriten el reposo absoluto (colitis o enteritis neutropénica, etc.).
- Quince, Complicación postoperatoria que no permitan el uso de la vía oral, cuya enfermedad de base tiene supervivencia mayor de 6 meses.
- Dieciseis, Pacientes en estado terminal, para mejorar la calidad de vida.
Vía de administración
Siempre que sea posible, se utiliza la vía enteral.
Se utiliza la vía parenteral en aquellos casos en los cuales hay alteraciones del tracto digestivo que impiden o limitan su uso, o en aquellos casos en los cuales la vía enteral no ha tenido el efecto deseado.
En los pacientes en quienes se han realizado intervenciones operatorias de alta complejidad, la colocación de las sondas enterales o de catéteres venosos centrales para la administración del soporte nutricional la hará el mismo grupo tratante, dado el peligro de causar daños (perforaciones, desgarros de las líneas de sutura). Esto es particularmente importante en casos de intervenciones sobre faringe o esófago. En su defecto, la hará el Grupo de Soporte Metabólico y Nutricional, pero siempre en acuerdo con el grupo tratante.
En pacientes bien nutridos que vayan a ser sometidos a radio o quimioterapia, se emplea nutrición enteral o nutrición parenteral cuando el tratamiento es con propósito curativo y el pronóstico es bueno. Si el tracto gastrointestinal no es funcional, o si sólo se pude usar parcialmente, se inicia un régimen combinado de NE y NP.
Los pacientes sometidos a trasplante de medula reciben soporte nutricional especial, enteral o parenteral, si:
- La ingestión oral es inferior al 50% de lo suministrado diariamente, durante 5 días.
- Hay esofagitis o mucositis oral moniliásica que impida el uso de la vía oral.
- Cuando se presentan complicaciones por rechazo o falla multisistémica.
Formulación de nutrición
La Tasa Metabólica Basal (TMB) o Gasto Metabíco Basal (GMB), antiguamente denominado Metabolismo Basal, se define como el gasto energético o calórico de un organismo medido 12 a 18 horas después de la ingesta de comida y en completo reposo muscular.
El Gasto Energético en reposo (GER) es el gasto calórico de un organismo en reposo, medido en cualquier momento del día. Es 10% mayor que la TMB o GMB, y es la determinación más utilizada en la práctica clínica.
Para el cálculo de la TMB o GMB se puede emplear dos métodos:
- Ecuación de Harris Benedict: Varones = 66,47+13,75 (Peso) + 5(Talla) – 6.76 (Edad) Mujeres = 655,10 + 9,56 (Peso) + 1,85 (Talla) – 4,68(Edad)
- O más sencillo, el peso multiplicado por las necesidades calóricas basales (25 kcal) y por el factor de estrés. El valor obtenido se usa para prescribir el régimen de soporte, dividiéndolo para lograr 15-20 % de proteínas, 20 a 25% de lípidos y 60% de carbohidratos.
Nutrición parenteral
Se inicia de acuerdo a las necesidades del paciente y aplicando las fórmulas mencionadas para el GMB.
En general se inicia una mezcla que contiene 1-2 gramos de aminoácido por kg de peso, 3 a 5 mg de carbohidratos por kg y 0,5 a 1 g de lípidos por kg, lo cual es equivalente al gasto energético basal o en reposo, y siempre de acuerdo con las condiciones del paciente. La administración se ajusta según tolerancia y según el balance de nitrógeno, para llegar lo más cerca al equilibrio entre pérdidas y suministro.
A la mezcla de NP se agregan electrolitos, vitaminas y elementos traza según los requerimientos básicos, la patología y el grado de estrés. Es fundamental el aporte de fosfato y magnesio, según monitoría de los niveles séricos.
Nutrición enteral
La nutrición por vía enteral es preferida siempre que el tacto digestivo esté disponible. Tiene las ventajas de ser más fisiológica y segura, reduce la tasa de infecciones y, supuestamente, inhibe la translocación bacteriana. Es significativamente menos costosa que la NP.
En pacientes con malabsorción intestinal, según la patología presente y la funcionalidad del tracto gastrointestinal, se utilizan diversas fórmulas nutricionales. En general, se prefieren dietas isotónicas, elementales o semielementales, de fácil digestión y absorción, bajas en grasas y residuos y de alto contenido de triglicéridos de cadena media (TCM).
Pacientes con síndrome de dumping se emplean fórmulas isotónicas con carbohidratos (CHO) del tipo maltodextrinas, almidón, polímeros de glucosa o sacarosa, administradas en bajo goteo de infusión para evitar grandes cargas osmolares. Si no da resultado, se prescribe dieta seca.
En pacientes con trauma craneoencefálico, ACV, neurocirugía, etc., se prefiere la alimentación por sonda nasogástrica o nasoduodenal, con fórmulas completas y ricas en fibra.
En aquellos que han sido sometidos a operaciones mayores en cabeza y cuello y que requieren alimentación por sonda, se prefieren alimentos con alto contenido de nitrógeno.
Cuando hay ruptura del conducto torácico y fístula quilosa (quilotórax), se utilizan fórmulas con alto contenido de triglicéridos cadena media (TCM) y bajos contenidos de triglicéridos cadena larga (TCL). Si no se logra reducir el drenaje quiloso, se pasa a vía parenteral.
En los casos de pancreatitis aguda:
Se inicia soporte nutricional parenteral a las 72 horas del ingreso. Si el paciente es llevado a cirugía, se coloca una sonda para alimentación yeyunal (yeyunostomía de catéter) para administrar dietas de tipo elemental u oligomérica.
En pancreatitis crónica se emplean productos con baja carga de carbohidratos (CHO) por la intolerancia a la glucosa que suele acompañar esta entidad, y se administran enzimas pancreáticas en dosis altas. En los pacientes con esteatorrea, los TCM son bien tolerados.
También, en caso de ascitis, pseudoquiste, derrame pleural o alguna complicación que impida el uso del tracto gastrointestinal, se utiliza NPT.
Y en la enfermedad Inflamatoria intestinal se pierden proteínas, vitaminas K y B12 y los elementos Mg, Se, Zn, Ca y Fe, por lo cual deben suministrarse en cantidades hasta en 5 veces la RDA (Recommeded Dietary Allowance). De igual manera, el aporte calórico debe ser de 40-50 Kcal y de 1,5- 2,0 gramos de proteína por kilogramo de peso corporal. Si falla el soporte enteral, se pasa a la vía parenteral.
En casos de fístula enterocutánea, el primer paso es identificar si es de alto o de bajo gasto. Si es de alto gasto, se emplea NPT inicialmente; si es de bajo gasto, y según la ubicación anatómica, se puede elegir una fórmula enteral.
Se prefieren alimentos oligomérico ricos en glutamina, y si hay más de 80 cm de intestino delgado disponible se adicionan otras medidas:
- Corrección de deshidratación y desequilibrio ácido base y de electrolitos. Suplencia de las pérdidas, reducción de secreciones (octreótido 0,1 a 0,25 mg 3 veces día s.c).
- Cuidado de la piel y drenaje colecciones y trayectos subcutáneos.
- Canalización de la fístula y fijación a la pared abdominal.
- Descartar sepsis.
- Mantenimiento de la integridad intestinal por administración de líquidos vía enteral y NE, tan pronto sea posible.
En el síndrome de intestino corto se ha demostrado adecuada absorción de CHO, pero no de las grasas, por lo cual es recomendable el uso de TCM en cantidad máxima de 460 cal/día (si es mayor ocasiona diarrea).
Se recomienda el siguiente orden de manejo:
- Iniciar con NPT.
- Cambio gradual a nutrición enteral si hay más de 60 cm de intestino residual, y con prontitud para evitar la atrofia (algunos inicial dieta normal baja en grasas y calcio)
- La nutrición enteral debe ser rica en glutamina y en TCM. No ingerir bebidas alcohólicas ni cafeína durante un año, al menos.
- Retirar lo más pronto posible los analgésicos narcóticos.
- Suplemento parenteral de calcio y vitamina B 12.
En el síndrome de asa ciega se encuentra malabsorción de grasas y de vitamina B12. Se recomienda dieta sin lactosa, TCM, vitamina B12 y antibióticos de amplio espectro. En la mayoría de los casos se practica cirugía correctora.
En pacientes con enfermedades inmunosupresivas se recomienda el uso de nutrientes inmunomoduladores como los ácidos grasos omega 3 (aceite de pescado), arginina, glutamina, nucleótidos, etc.
Para diabéticos, se recomiendan dietas bajas en CHO (o con CHO de bajo índice glicémico) y, si no son obesos, altas en grasas.
En el paciente con falla renal, las dietas deben ser de alto valor calórico por CHO, de baja cantidad de proteínas y con aminoácidos esenciales.
En los casos de EPOC se emplean dietas bajas en CHO.
Para hipercolesterolemia, la dieta debe ser baja en grasas y rica en fibra. También existen módulos de nutrientes con los cuales se puede complementar la dieta de acuerdo a las necesidades del paciente
Momento de inciación
La nutrición parenteral se inicia tan pronto las condiciones cardiovasculares sean estables y con parámetros hemodinámicos adecuados. En el postoperatorio, luego de intervenciones mayores, se debe esperar 24 horas o el paso de la fase “ebb” (o fase hipometabólica).
La nutrición enteral se inicia siempre que el tracto gastrointestinal esté funcional e íntegro, o cuando se resuelva el íleo adinámico en los casos de cirugía abdominal, a menos que exista una sonda avanzada en el intestino delgado.
Controles
Nutrición parenteral
- Radiografia de tórax para comprobar la posición del catéter venoso central, inmediatamente después de ser colocado.
- Controles de glicemia, creatinina y electrolitos según el estado y la evolución del paciente.
- Semanalmente se realizan estudios bioquímicos de perfil general que incluyen: cuadro hemático, plaquetas, VSG, glicemia, creatinina, BUN, colesterol, triglicéridos, AST, ALT, fosfatasa alcalina, DHL, T y C de protrombina, bilirrubina total y diferencial, albúmina, pre-albúmina, electrolitos, nitrógeno ureico en orina de 24 horas (para determinar balance de nitrógeno) y creatininuria.
- Cuando se sospeche sepsis por catéter, se toman tres hemocultivos y se realiza cultivo de la parte interna y del exterior del catéter, por separado. Se procede al cambio por un nuevo catéter, ubicándolo en otro sitio. Nutrición enteral
- Radiografía para corroborar la posición de las sondas, cuando la clínica no lo pueda establecer.
- Cuando la sonda esté en la cámara gástrica, se mide el residuo cada 4 horas; si es mayor del 50% de lo administrado durante ese período, se suspende una hora y se reinicia; se debe investigar la causa para su corrección. Si no se encuentra la causa, se puede avanzar la sonda distal al píloro para evitar mayores complicaciones.
- Control semanal de laboratorio que incluye cuadro hemático, plaquetas, VSG, glicemia, creatinina, BUN, colesterol, trigliceridos, AST, ALT, fosfatasa alcalina, DHL, T y C de protrombina, bilirrubina total y diferencial, albúmina, pre-albúmina, electrolitos. Nitrógeno uréico en orina de 24 horas para determinar balance de nitrógeno y creatinina en orina.
- En caso de intolerancia por diarrea, se disminuye la velocidad de infusión y antes de retirar la sonda, se busca la causa para hacer la corrección específica.
Finalización de la Terapéutica
Tan pronto como el paciente tolere la vía oral o sea posible administrar dieta institucional (casera) por sonda, se considera la suspensión de la alimentación parenteral o enteral con productos especiales. Para suspender la alimentación parenteral se administrará dextrosa al 10% en agua destilada por 8 horas, retirando luego el catéter, el cual, si se considera necesario, se envía a cultivo.
Lecturas Recomendadas
- 1. AVILA A. Fisiopatología, Prevención y Tratamiento de la Mucositis oral inducida por quimioterapia y radioterapia. Rev Col de Cancerol. 4: 36-53. 2000
- 2. BOZZETTI F, PAGNONI AM, DEL VECCHIO M. Excessive caloric expenditure as a cause of malnutrition in patients with cancer. Surg Gynecol Obstet 150:229, 1980.
- 3. BRENNAN MF. Malnutrition in patients with gastrointestinal malignancies. Significance and management. Dig Dis Sci 31:755, 1986.
- 4. CHLEBOWSKI RT, HEBER D. Metabolic abnormalities in cancer patients: carbohydrate metabolism. Surg Clin North Am 66:957, 1986.
- 5. DALY JM, REDMOND HP, GALLAGHER H. Perioperative nutrition in cancer patients. JPEN 16 (No.6, Supplement): 100s, 1992.
- 6. DALY JM, REDMOND HP, LIEBERMAN MD, JARDINES L. Nutritional support of patients with cancer of the gastrointestinal tract. Surg Clin North Am 71:523, 1991.
- 7. DUDRICK SJ, WILMORE DW, VARS HM, RHOADS JE. Can intravenous feeding as the sole means of nutrition support growth in the child and restore weight loss in the adult? An afirmative answer. Ann Surg 169: 974, 1969.
- 8. HOLROYDE CP, REICHARD GA JR. General metabolic abnormalities in cancer patients: anorexia and cachexia. Surg Clin North Am 66:947, 1986.
- 9. KERN KA, NORTON JA. Cancer cachexia. JPEN 12:286, 1988.
- 10. KOEA JB, SHAW JHF. The effect of tumor bulk on the metabolic response to cancer. Ann Surg 215:282, 1992.
Referencias
- 11. MOLDAWER LL, ROGY MA, LOWRY SF. The role of cytokines in cancer cachexia. JPEN 16 (No.6, Supplement): 43S, 1992.
- 12. MORA R. Soporte Nutricional Especial. Segunda edición. Editorial Médica Panamericana. Buenos Aires, Bogotá, 1997.
- 13. PATIÑO JF. Soporte nutricional en el paciente con cáncer. En: Lecciones de Cirugía. Por JF Patiño. (ed.) Médica Panamericana. Buenos Airtes, Bogotá, pp 210-214, 2000.
- 14. PATIÑO JF. Soporte nutricional en el paciente quirúrgico. Mi manera de hacerlo. ¿Cuándo? ¿Cómo? ¿Con qué? En: Lecciones de Cirugía. JF Patiño (ed.). Editorial Médica Panamericana. Buenos Aires, Bogotá, pp 217-223, 2000.
- 15. RECOMMENDED DIETARY ALLOWANCES. 10th edition. Subcommittee on the Tenth Edition of the RDAs. Food and Nutrition Board, Commission on Life Sciences, National Research Council. National Academy Press. Washington, DC, 1990.
- 16. RUMLEY TO, COPELAND EM. Value of nutritional support in adult cancer patients. Surg Clin North Amer 66:1177, 1986.