3.2
Marie Claire Berrouet Mejía Médico Especialista en Toxicología Clínica UDEA Toxicóloga Clínica Hospital General de Medellín -Clínica Soma Docente de Farmacología y Toxicología Universidad CES, Medellín Miembro de la Asociación de Toxicología Clínica Colombiana – ATCC–
Andrés Felipe Estrada Atehortúa Médico Especialista en Medicina de Urgencias CES Urgentólogo Hospital Pablo Tobón Docente de Universidad Pontificia Bolivariana
Ubier Eduardo Gómez Calzada Médico Especialista en Toxicología Clínica Profesor de Farmacología y Toxicología Universidad de Antioquia, Medellín Toxicólogo Hospital San Vicente Fundación de Medellín Miembro de la Asociación de Toxicología Clínica Colombiana – ATCC–
Generalidades
En Colombia se puede observar como las intoxicaciones vienen en aumento en los últimos años, reportando al SIVIGILA durante el período del 2010 al 2012 23.844, 27.126 y 27.252 intoxicaciones respectivamente. Hasta la semana epidemiológica 41 del año 2016 se habían reportado 27.117 casos con una incidencia de 55.6 por cada 100.000 habitantes siendo las causas más comunes los medicamentos, con 8.292 casos, luego plaguicidas con 6.857 casos y finalmente sustancias psicoactivas con 6.172 casos1.
Las complicaciones que más frecuentemente se presentan en el paciente urgente, agudamente intoxicado, son: convulsiones, depresión respiratoria y arritmias.
Entendiendo lo anterior dentro de las ayudas diagnosticas más pertinentes y costoefectivas del paciente intoxicado está el electrocardiograma (ECG), ya que tiene utilidad diagnóstica, pronóstica y su buena interpretación permite tomar decisiones terapéuticas, incluida la administración de medicamentos.
El ECG constituye un método económico, objetivo y rápido de obtener información sobre la etiología de la intoxicación y su gravedad, facilita la toma de decisiones preventivas y permite evaluar la eficacia de las medidas terapéuticas implementadas3-5.
Con frecuencia, se omite ordenar el ECG basándose en el hallazgo clínico de un pulso rítmico o bien se sustituye por el monitoreo cardíaco.
El monitoreo cardíaco no permite visualizar la totalidad de las derivaciones y hace subjetiva la apreciación de los intervalos ya que toma solo dos derivaciones y la ubicación de los electrodos es diferente con respecto a los del ECG perdiendo así información valiosa que puede contribuir tanto al diagnóstico como al manejo del paciente.
Para identificar las diferentes manifestaciones de toxicidad:
Es importante identificar algunos aspectos básicos del proceso de despolarización y repolarización en el miocardiocito. El flujo rápido de iones hacia el interior de la célula miocárdica origina la despolarización normal. Cuando este flujo es sobrepasado por el flujo de potasio que va hacia el exterior, se da la repolarización miocárdica.
En el potencial de acción se identifican diferentes fases3-5:
- Primero, Fase 0: se provocan cambios súbitos en la permeabilidad iónica, de forma que el sodio (predominantemente), entra en la célula mientras que el potasio inicia su salida.
- Segundo, Fase 1: el pico del potencial de acción está dado por el cierre de los canales de sodio y la activación de los canales de potasio.
- Tercero, Fase 2: es también conocida como fase de repolarización lenta. En ella todavía persiste la entrada de iones sodio y comienza la entrada de calcio mientras que el potasio sale del interior celular. Esto explica la meseta en el potencial de acción.
- Cuarto, Fase 3: se caracteriza por la salida masiva de potasio de la célula, y se aumenta la permeabilidad de la membrana para el sodio.
- Quinto, Fase 4: se activa la bomba de sodio-potasio ATPasa que saca de la célula cardiaca tres iones de sodio, intercambiándolos por dos iones de potasio para mantener el potencial eléctrico del miocito3-5.
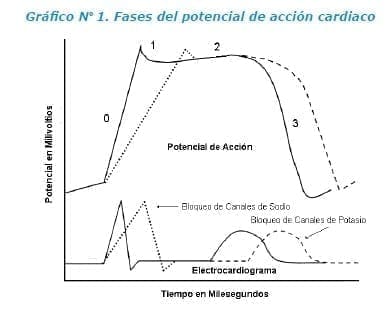
Entendiendo que el electrocardiograma es una representación de la actividad eléctrica del corazón, la descripción juiciosa de las alteraciones en ondas, segmentos e intervalos asociados a la clínica permitirá establecer asociaciones.
Dentro de las alteraciones más comúnmente encontradas en el electrocardiograma están10-13:
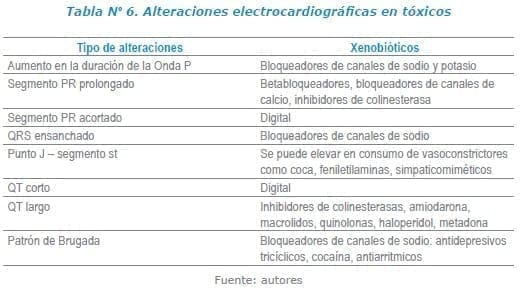
En resumen, la despolarización ventricular se representa en el ECG:
Por el intervalo QRS, la repolarización por el segmento ST y la onda T. La actividad eléctrica ventricular en conjunto, es reflejada por el intervalo QT. El intervalo QT se mide desde el principio de la onda Q hasta el final de la onda T y se debe corregir según la frecuencia cardiaca. Se acepta que su valor normal sea menor a 440 ms. Otros autores establecen el límite superior del QTc en varones a 450 ms, mientras que en las mujeres se asume un valor normal del QTc hasta los 470 ms6-8.

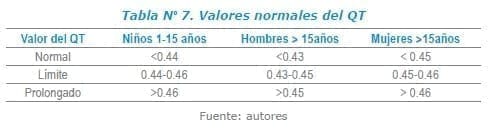
Existen diversas fórmulas: Bazett, Frederica, Hodges y Framinghan para calcular el QT, siendo la más común Bazett QTc =2√ RR. Así como es importante la medición de este, la utilización de otros parámetros como la dispersión del QT también son indicativos de variaciones en la repolarización de los ventrículos, asociándose a mayor riesgo de aparición de arrtimias. En la práctica, la dispersión se calcula como la diferencia entre el QT máximo y mínimo en un ECG de 12 derivaciones9.
El aumento del intervalo QTc refleja una alteración en la repolarización ventricular, de tal manera que, si durante el retraso de la repolarización un foco ectópico ventricular se activa, se puede desencadenar una taquicardia ventricular polimorfa (TVP).
Esta arritmia se asocia más comúnmente a intervalos QTc mayores de 500 mseg y se caracteriza en el ECG por ser una taquicardia en la cual los complejos QRS son de diferente amplitud y porque las puntas de dichos complejos QRS varían alrededor de la línea isoeléctrica en forma sinusoidal.
Existen numerosas causas de alteración del QT prolongado adquirido:
Dentro de éstas están alteraciones hidroelectrolíticas, (hipomagnesemia, hipocalemia), medicamentos (antibióticos como linezolid, macrólidos, quinolonas, psicofármacos como haloperidol, olanzapina, ziprasidona), opioides como la metadona y antiarritmicos como sotalol y bloqueadores de canales de sodio (especialmente antiarrítmicos tipo IA por prolongar el periodo vulnerable)9.
Los xenobióticos pueden producir alteraciones electrocardiográficas por varios mecanismos:
- Primero, Efecto central: como en el caso de la intoxicación por opioides, en el que la depresión central lleva a la hipoxemia y secundariamente a bradicardia con extrasistolia.
- Segundo, Efecto periférico: sustancias, tales como los bloqueadores tipo alfa 1 llevan a disminución de la resistencia periférica y a taquicardia compensadora.
- Tercero, Efecto mixto: tóxicos como la cocaína y anfetaminas producen inhibición de la recaptación de catecolaminas, con taquicardia por efecto en receptores beta 1 en corazón y cerebro, vasodilatación por efecto en receptores beta 2 vasculares y vasoconstricción por efecto en los receptores alfa 1 vasculares.
- Cuarto, Efecto cardíaco directo: para producir daño directo los mecanismos moleculares más comunes son el bloqueo de canales de sodio, potasio, calcio, el bloqueo de la bomba sodio potasio ATPasa o de receptores beta 1.
Luego de entender los diferentes mecanismos generales de toxicidad, las manifestaciones de cardiotoxicidad se pueden agrupar en alteraciones del ritmo y alteraciones de la conducción.
Las alteraciones del ritmo a su vez se pueden agrupar en taquiarritmias siendo asociadas a un aumento en la producción de catecolaminas, estímulo de receptores beta, inhibición de la fosfodiesterasa o en compensación a alteraciones en la resistencia vascular periférica o como respuesta a la acidosis.
Con respecto a las bradiarritmias éstas pueden ser por bloqueo de receptores adrenérgicos, aumento del tono vagal o efectos centrales (ejemplo clonidina, gabamiméticos tipo fenobarbital).
De manera general los mecanismos que explican la arritmogénesis son tres:
- Formación anormal del impulso (las sustancias que aumenten la pendiente de la fase 4, disminuyen el umbral de disparo o aumenten el potencial de membrana de reposo, producirán aumento en la frecuencia de disparo).
- Conducción anormal del impulso (reentrada).
- Aumento del automatismo10.
Considerando las causas de daño directo es importante reconocer los hallazgos asociados al bloqueo de canales y bombas que impactan el miocardiocito.
Toxicidad por bloqueadores de canales de sodio:
A esta categoría pertenece una amplia cantidad de medicamentos, si bien es cierto los principales son los antidepresivos tricíclicos, es importante recordar que muchos psicofármacos como la carbamazapina, topiramato, fenitoina y la lacosamida bloquean canales de sodio, con respecto a drogas de abuso tal vez la más frecuentemente asociada es cocaína y dentro de los betabloqueadores el propranolol.
Es de suma importancia identificar hallazgos que sugieran bloqueo de canales de sodio para hacer una elección adecuada del medicamento responsable y evitar mayores riesgos cardiovasculares y neurológicos, entendiendo que algunos estudios han evidenciado que estas alteraciones no solo predicen alteraciones cardiovasculares sino neurológicas como las convulsiones11-15.
El efecto del bloqueo de canales de sodio se puede manifestar por ensanchamiento del QRS (> 100 mseg), Desviación a la derecha del eje (S > R en la derivación DI y R en AVR > 3mv)11-15.
Respecto a los antidepresivos tricíclicos puntualmente se pueden observar otras manifestaciones como: taquicardia sinusal por bloqueo de receptores muscarinicos, y como efecto compensador por disminución de la resistencia vascular periférica por bloqueo de receptores alfa 1, este hallazgo puede persistir una vez se han resulto otros hallazgos de toxicidad11-15.
Toxicidad por bloqueadores de la Na+K+ATPasa
Los glucósidos cardiacos son sustancias que inhiben la bomba de sodio-potasio adenosina trifosfatasa (Na+K+ATPasa). Además de la digoxina en nuestro medio existen otras fuentes como plantas y toxinas animales como: Thevetia peruviana (adelfa amarilla, india, nuez de la india, haba de San Ignacio o amancay), Nerium oleander (laurel de flor, rosa laurel, baladre o trinitaria), (y los bufadienólidos presentes en las glándulas venenosas del sapo de caña (Bufo marinus).
La inhibición de esta bomba lleva a un aumento del potasio extracelular y del sodio intracelular, el cual reduce el gradiente de transmembrana y aumenta la actividad del intercambiador sodio-calcio. La elevación intracelular de calcio aumenta la contractibilidad, adicionalmente se reporta un aumento del tono vagal generando cronotropismo negativo.
Dentro de los cambios electrocardiográficos característicos están el denominado “efecto digital” que se ve puede dar en concentraciones normales viéndose como una onda T bifásica, con un componente inicial negativo y uno final positivo, acoplada con el segmento S-T, por lo tanto puede verse con un descenso de concavidad hacia arriba, se puede observar el intervalo QTc acortado y prolongación del intervalo PR16.
La intoxicación iatrogénica se asocia frecuentemente a condiciones como insuficiencia renal, falla cardiaca, trastornos hidroelectrolíticos, alcalosis metabólica, hipotiroidismo, medicamentos simpaticomiméticos o interacciones medicamentosas (omeprazol, macrólidos, amiodarona, betabloqueadores).
Dentro de las anormalidades electrocardiográficas en el paciente intoxicado por digitálicos se reportan taquiarritmias y bradiarritmias y combinación de actividad excitatoria e inhibitoria, como taquicardia auricular con bloqueo AV.
La bradicardia o la aparición de un ritmo regular en un paciente con fibrilación auricular previa, sugiere la intoxicación. Adicionalmente se pueden ver hallazgos por las alteraciones hidroelectrolíticas asociadas como hipercalemia en el escenario agudo y en la toxicidad crónica hipocalemia. Las taquiarritmias bidireccionales son un indicador de severidad17,18.
(Lea También: Alteraciones Hidroelectrolíticas y Ácido Base en el Paciente Intoxicado)
Toxicidad por bloqueadores de canales de potasio
El bloqueo de la salida de potasio desde el espacio intracelular hacia el extracelular se asocia a prolongación del intervalo QT.
Como se planteó, el aumento del intervalo QTc refleja una alteración en la repolarización ventricular, aumentando el riesgo de taquicardia ventricular polimorfa (TVP), la cual se caracteriza en el ECG por ser una taquicardia en la cual los complejos QRS son de diferente amplitud y porque las puntas de dichos complejos varían alrededor de la línea isoeléctrica en forma sinusoidal.
Dentro de las causas adquiridas es importante tener en cuenta hipocalemia, hipomagnesemia, macrólidos, quinolonas, amiodarona, metadona, azoles, haloperidol, antihistamínicos y productos naturales como aloe vera, naranja amarga (bebidas energizantes), guaraná, regaliz, organofosforados y litio. Es importante tener presente fuentes de consulta como www.torsades.org19,20.
Toxicidad por bloqueadores de canales de Calcio y betabloqueadores
El impacto fisiológico común de estos antihipertensivos es el calcio: los bloqueadores de canales de calcio (BCC) inhiben los canales de calcio voltaje sensibles, de tipo L, inhibiendo el paso transmembrana de calcio desde el e spacio extracelular al intracelular, generando lentitud en la conducción, disminución del inotropismo, del gasto cardíaco y vasodilatación con hipotensión.
Los BCC de la clase dihidropiridínicos tienen más afinidad por el músculo liso periférico, asociándose a hipotensión y taquicardia; por otra parte, los BCC no dihidropiridínicos, tienen mayor afinidad por los canales de calcio a nivel cardíaco, generando bradicardia con hipotensión.
En general los BCC inicialmente generan bradicardia y en la medida que la intoxicación progresa, se presentan grados variables de bloqueo AV y bradiarritmias de la unión o ventriculares.
Se puede encontrar ensanchamiento del QRS causado tanto por el rimo de escape ventricular como por el bloqueo de los canales de calcio. Finalmente sobreviene la asistolia21,22,23.
Por su parte, los betabloqueadores (βBs) al inhibir los receptores β1 producen inotropismo y cronotropismos negativos, la inhibición de los receptores β2 produce disminución en la glucogenolisis, disminución en la gluconeogénesis y en la relajación del músculo liso vascular, bronquios y tracto gastrointestinal.
Es importante resaltar que algunos betabloqueadores tienen capacidad de bloqueo α1 como carvedilol, o bloqueo de canales sodio asociándose con ensanchamiento de QRS como el propranolol o bloqueo de canales de potasio como sotalol asociándose a prolongación del QTc.
Dentro de las manifestaciones electrocardiográficas se puede ver grados variables de bloqueo AV e hipotensión24,25.
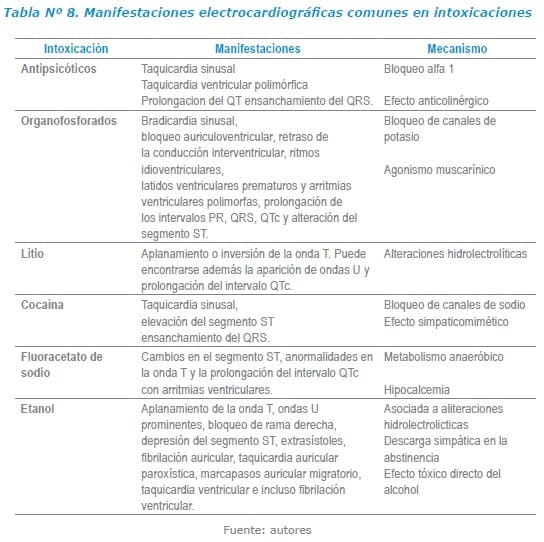
A continuación se hace un listado de manifestaciones electrocardiográficas comunes de intoxicaciones frecuentemente reportadas en nuestro medio.
Referencias
- 1. Instituto Nacional de Salud –Semana epidemiológica, número 41 de 2016, 09 octubre – 15 octubre.
- 2. Delk Christopher, Holstege, Brady W. Electrocardiographic abnormalities associated with poisoning. American Journal of Emergency Medicine. 2007; 25: 672 – 687.
- 3. Aristizabal JM, Restrepo A. Los trastornos electrolíticos farmacológicos y toxicos del equilibrio acido básico que alteran el electrocardiograma. Capítulo 9 en: Uribe W. electrocardiografía clínica de lo básico a lo complejo. Editorial distribuna.
- 4. Lanza Tarricone, Giuseppe. Fórmulas para el QT corregido y consideraciones clínicas. Gaceta Médica de Caracas, 2008; 116(3): 224-234.
- 5. Yap YG, Camm AJ. Drug induced QT prolongation and torsades de pointes. Heart. 2003; 89(11):1363–72.
- 6. Khan IA. Long QT syndrome: Diagnosis and management. Am Heart J. 2002;143:7-14.
- 7. Rautahazju PM, Zhou SH, Wong S, Calhoun HP, Berenson GS, Prineas R, et al. Sex differences in the evolution of the electrocardiohgraphic QT interval with age. Can J Cardiol. 1992; 8:690-695.
- 8. Tolvonen L. More light on QT interval measurement. Heart. 2002; 87:193-194.
- 9. Molina, R. Z., Garriga, R. E. D., & Sánchez, M. D. Dispersión del intervalo QT: un predictor de arritmias ventriculares malignas. Revista Cubana de Cardiología y Cirugía Cardiovascular, 2014. 14(2).
- 10. Restrepo A, Berrouet M, peña L. Cambios electroardiograficos en el paciente intoxicado. Guía para el manejo del paciente intoxicado. Cuarta edición DSSA.
- 11. Effects of drugs on the electrocardiogram. En Chou`s Electrocardiography in clinical practice. Borys Surawicz, Timothy K. Knilans. Saunders, Elsevier. 6th ed. 2008.
- 12. Barish et al. The electrocardiographic manifestations of cyclic antidepressant therapy and overdose: a review. Journal of Emergency Medicine 1990; 8,5: 597-605
- 13. Camm et al. Drug induced Brugada syndrome. Europace 2009; 11(8):989-994.
Bibliografía
- 14. Thanacoody, HK Ruben; Thomas, Simon HL. Tricyclic antidepressant poisoning. Toxicological reviews, 2005; 24(3): 205-214.
- 15. Liebelt, Erica L et al. ECG Lead aVR Versus QRS Interval in Predicting Seizures and Arrhythmias in Acute Tricyclic Antidepressant Toxicity. Ann Emerg Med August 1995; 26:195-201.
- 16. Chen JY, Liu PY, Chen JH, et al. Safety of transvenous temporary cardiac pacing in patients with accidental digoxin overdose and symptomatic bradycardia. Cardiology 2004; 102(3):152–5.
- 17. Harrigan RA, Perron AD, Brady WJ. Atrioventricular dissociation. Am J Emerg Med 2001; 19(3):218–22.
- 18. Irwin J. Intensive care medicine. In: Kirk M, Judge B, editors. Digitalis poisoning. 5th edition. Baltimore: Lippincott Williams & Wilkins; 2003.
- 19. Sides GD. QT interval prolongation as a biomarker for torsades de pointes and sudden deathin drug development. Dis Markers 2002; 18(2):57–62.
- 20. Kaye P, O’Sullivan I. The role of magnesium in the emergency department. Emerg Med J 2002; 19(4):288–91
- 21. Goldfrank L Goldfrank’s toxicologic emergencies. In: DeRoos F, editor. Calcium channel blockers. 10th edition. New York: McGraw-Hill; 2002.
- 22. Holstege C, Kirk M, Furbee R. Wide complex dysrhythmia in calcium channel blocker overdose responsive to sodium bicarbonate therapy [abstract]. J Toxicol Clin Toxicol 1998; 36(5):509.
- 23. Tanen DA, Ruha AM, Curry SC, et al. Hypertonic sodium bicarbonate is effective in theacute management of verapamil toxicity in a swine model. Ann Emerg Med 2000; 36(6):547–53
- 24. Love JN, Enlow B, Howell JM, et al. Electrocardiographic changes associated with betablocker toxicity. Ann Emerg Med 2002; 40(6):603–10.
- 25. Reith DM, Dawson AH, Epid D, et al. Relative toxicity of beta blockers in overdose. J Toxicol Clin Toxicol 1996; 34(3):273–8.