4
4.1 Conformación del grupo de adopción
Se conformó un grupo desarrollador para la adopción de las recomendaciones integrado por expertos metodológicos y temáticos.
Los expertos metodológicos incluyeron profesionales del área de la salud con formación en epidemiología clínica y experiencia en el desarrollo de novo, adopción y adaptación de guías de práctica clínica (GPC). Los expertos temáticos incluyeron bacteriólogos y médicos especializados en Hematología, Medicina Interna, Cuidado Crítico, Pediatría, Neonatología, Ginecobstetricia, Medicina Transfusional, Bioética, Medicina General, Enfermería, entre otras; todos con experiencia en hematología y transfusión de sangre. (Ver también: Uso de Componentes Sanguíneos, Resumen de Recomendaciones)
Este grupo de trabajo llevó a cabo el siguiente proceso:
- Revisión sistemática de la literatura
- Evaluación de calidad y selección de GPC.
- Solicitud de permiso para adopción de las recomendaciones.
- Evaluación y ajuste a las recomendaciones para su implementación al contexto nacional.
- Identificación de barreras de implementación.
- Coordinación del proceso participativo para el ajuste de las recomendaciones para su implementación al contexto nacional.
- Elaboración de propuesta para la implementación de las recomendaciones.
- Elaboración del documento final
Todos los miembros del grupo declararon sus intereses y un comité evaluó sus posibles conflictos de interés y las consecuentes limitaciones de participación en el proceso de adopción de la GPC. Posterior al análisis de los intereses declarados, ninguno de los miembros del equipo desarrollador tuvo limitación parcial o total para participar en el proceso.
De igual manera los expertos invitados realizaron la declaración de intereses, los cuales fueron sometidos al análisis y ninguno de ellos presentó limitación parcial o total.
4.2 Búsqueda, evaluación de calidad y selección de GPC
Se llevó a cabo una revisión sistemática de la literatura (RSL) con el propósito de buscar GPC relacionadas con el uso de componentes sanguíneos, posteriormente se evaluó la calidad de las GPC encontradas y se seleccionaron aquellas con alta calidad para extraer las recomendaciones para adopción. A continuación, se describe el proceso de manera detallada:
4.2.1 Búsqueda de guías de práctica clínica
Se realizó una búsqueda sistemática de GPC en bases de datos especializadas (Medline, Embase y LILACS), bases de datos genéricas (Google Scholar), sitios web de organismos desarrolladores y compiladores, páginas especializadas y consulta con expertos, siguiendo las indicaciones de la “Guía Metodológica para elaboración de Guías de Práctica Clínica con Evaluación Económica en el Sistema General de Seguridad Social en Salud Colombiano” (GM) (6).
Todo el proceso se acogió a los estándares de calidad internacional utilizados en revisiones sistemáticas de la literatura. Las búsquedas fueron llevadas a cabo por personal previamente entrenado y se realizaron sin restricción de fecha.
Se combinaron los resultados de la búsqueda en bases de datos electrónicas y la búsqueda mediante otros métodos, y se realizó una eliminación de duplicados utilizando el programa EndNote X6®. Los resultados de las búsquedas y la selección se encuentran en el diagrama de flujo PRISMA
4.2.2 Tamización
Las referencias obtenidas fueron seleccionadas mediante revisión de título y resumen, de forma independiente por dos expertos metodológicos en revisiones sistemáticas de literatura (AP y NVC), con los siguientes criterios de inclusión:
- ¿Es una GPC?
- ¿Incluye recomendaciones dirigidas a población general tanto en atención primaria como especializada?
- ¿El documento está publicado en idioma inglés o español?
Las referencias que cumplieron todos los criterios de inclusión o en las que hubo duda de su cumplimiento, fueron revisadas en texto completo para orientar la decisión de inclusión.
4.2.3 Preselección
Los documentos seleccionados para revisión en texto completo se tamizaron mediante la herramienta 7 recomendada por la “Guía Metodológica para elaboración de Guías de Práctica Clínica con Evaluación Económica en el Sistema General de Seguridad Social en Salud Colombiano” (6), excluyendo aquellas GPC que no cumplieron con los criterios para considerarse como basadas en evidencia o que no cumplen con los objetivos del proyecto; los ítems que evalúa este instrumento son:
- ¿Los alcances y objetivos de nuestra guía están incluidos en la guía evaluada?
- ¿Es una GPC basada en la evidencia? ¿Es replicable la búsqueda de evidencia primaria?
- ¿Tiene un proceso de desarrollo y grupo desarrollador?
- ¿Establece recomendaciones?
- ¿Año de publicación ≤ 4 años? Se consideró la fecha de la última búsqueda de la literatura o actualización de la evidencia.
Si alguna GPC no cumplió uno o más de estos criterios no se evaluó su calidad. Tampoco se evaluó la calidad de guías adaptadas o adoptadas.
4.2.4 Evaluación de calidad de las guías de práctica clínica
La calidad de las GPC fue evaluada por medio de la herramienta AGREE II. Este instrumento fue diseñado para evaluar el rigor metodológico y la transparencia con la cual son desarrolladas las guías de práctica clínica, proporcionar una estrategia metodológica para el desarrollo de guías, establecer la información y la forma en que esta debe ser presentada. El instrumento tiene 23 ítems, con calificación en escala tipo Likert de 7 puntos, organizados en 6 dominios: alcance y objetivos, participación de los implicados, rigor en la elaboración, claridad en la presentación, aplicabilidad e independencia editorial. En cada uno de estos dominios la calificación máxima posible es del 100% (13).
Las GPC que cumplieron todos los criterios de la Herramienta 7 fueron incluidas y evaluadas con el instrumento AGREE II por tres revisores de manera independiente, quienes utilizaron los algoritmos propuestos en el manual del AGREE II para obtener la calificación de las GPC en cada uno de los dominios.
4.2.5 Selección de guías de práctica clínica
La selección de guías se realizó por medio de un trabajo conjunto entre expertos metodológicos y temáticos. Se utilizó como criterio de selección una calificación de 60% o más en los dominios 3 (rigor en la elaboración) y dominio 6 (independencia editorial) del AGREE II. Además, se tuvieron en cuenta los aspectos clínicos considerados en las diferentes GPC.
4.3 Solicitud de permiso para adopción de las recomendaciones
El Consejo Nacional de Salud e Investigación Médica del Gobierno de Australia y la AABB Advancing Transfusion and Cellular Therapies Worldwide, autorizaron al Instituto de Evaluación Tecnológica en Salud de Colombia (IETS) y al Ministerio de Salud y Protección Social (MSPS) para usar las recomendaciones y el contenido de sus guías en el proceso de adopción de la guía de práctica clínica basada en evidencia para el uso de componentes sanguíneos para Colombia. Las autorizaciones fueron obtenidas por medio de correo electrónico los días 3 y 5 de enero de 2017.
4.4 Evaluación y ajuste de las recomendaciones para su implementación en el contexto colombiano
Con el fin de contextualizar las recomendaciones a la realidad del país y al sistema general de seguridad social en salud, el grupo de trabajo revisó para cada una de las recomendaciones la vigencia, la disponibilidad de tecnologías, la aprobación de tecnologías por parte de agencias regulatorias (Invima), el entrenamiento del personal de salud, el acceso y arquitectura del sistema de salud.
Este proceso dio lugar a seis conductas con respecto a cada una de las recomendaciones:
-
Adopción sin modificación alguna:
La recomendación no requirió cambios en su redacción. -
No adopción de la recomendación:
La recomendación no se incluyó debido a que la tecnología propuesta se consideró obsoleta. -
Adopción de la recomendación como punto de buena práctica clínica:
Dado que ya no existe variabilidad en la conducta incluida en la recomendación, esta se consideró como un punto de buena práctica clínica. -
Adopción de la recomendación como punto para la implementación de la guía:
La recomendación indicó una conducta necesaria para la implementación de otras recomendaciones. Por lo tanto, se consideró su inclusión en el capítulo de consideraciones para la implementación. -
Adopción con modificaciones:
Sin cambiar la conducta propuesta en la recomendación original, la recomendación requirió cambios en su redacción o cambios necesarios para facilitar su implementación, tales como ajustes en las dosis propuestas, ajuste a las unidades de medida en Colombia, exclusión de medicamentos o tecnologías sin registro Invima e inclusión de escalas de valoración adicionales a las propuestas en las recomendaciones originales.
Las recomendaciones que correspondieron a la última opción (adopción con modificaciones) se presentaron en una reunión de consenso formal de expertos; en esta se revisó la recomendación original y la propuesta de modificación, y se discutieron aspectos relacionados con su implementación en el contexto nacional.
Los ajustes se consensuaron por votación individual utilizando una escala tipo Likert con cinco opciones de respuesta:
- Totalmente en desacuerdo
- En desacuerdo
- Ni en acuerdo ni en desacuerdo
- De acuerdo
- Totalmente de acuerdo
Se define consenso cuando el 70% o más de los votos están en los niveles 4 y 5 (se adopta la recomendación con las modificaciones propuestas) o en los niveles 1 y 2 (no se adopta la recomendación). Cuando no hay consenso, se llevó a cabo una segunda ronda de votación precedida de un espacio de discusión y modificación de los ajustes propuestos. En caso de no llegar a consenso en la segunda ronda el ajuste se realizará teniendo en cuenta las preferencias de los representantes de los pacientes.
El panel de expertos se conformó por especialistas de las diferentes áreas relacionadas con transfusión de sangre y sus componentes, quienes previamente declararon sus intereses, los cuales se evaluaron por un comité para determinar potenciales conflictos de interés y consecuentes limitaciones parciales o totales en su participación. El desarrollo de esta GPC tuvo 2 momentos de participación, tipo consenso formal, los cuales se dieron a través de una metodología Delphi, y el segundo a través de una reunión presencial.
4.5 Resultados derivados del proceso metodológico
4.5.1 Búsqueda y selección de GPC
Se identificaron un total de 2960 referencias mediante la búsqueda en bases de datos electrónicas (Medline: 1192; Embase: 698; Lilacs: 104), 962 mediante otros métodos de búsqueda (organismos recopiladores, productores, guías iberoamericanas y consulta de expertos). Luego de eliminar duplicados se obtuvieron 2744 referencias, las cuales fueron revisadas, de estas, 33 documentos fueron revisados en texto completo y tamizadas mediante la Herramienta 7. Un total de 12 documentos cumplieron con los criterios de inclusión y fueron seleccionados para la evaluación de calidad con el instrumento AGREE II (13).
4.5.2 Evaluación de calidad de guías mediante el instrumento AGREE II
Las 12 GPC seleccionadas posterior a la tamización a través de la Herramienta 7, fueron evaluadas con el instrumento AGREE II (13). El objetivo de la evaluación fue seleccionar las guías de alta calidad, específicamente aquellas en las que los dominios “Rigor en la Elaboración” e “Independencia Editorial” tuvieron un puntaje igual o superior a 60% y 30%, respectivamente.
Tres expertos evaluadores independientes, realizaron la evaluación de cada una de las guías. Se obtuvieron puntuaciones estandarizadas por dominio, acordes con lo estipulado en el manual de aplicación del instrumento. Las puntuaciones de cada una de las GPC consideradas para el ejercicio de selección.
Las referencias de las siete guías que cumplieron los criterios de calidad para ser adoptadas, de acuerdo con los resultados de la evaluación con el instrumento AGREE II fueron las siguientes (15-16):
- National Blood Authority (NBA) (2011). Patient Blood Management guidelines module 1 Critical Bleeding/Massive Transfusion. NBA, Canberra, Australia.
- National Blood Authority (NBA) (2012). Patient Blood Management guidelines module 2 Perioperative. NBA, Canberra, Australia.
- National Blood Authority (NBA) (2012). Patient Blood Management guidelines module 3 Medical. NBA, Canberra, Australia.
- National Blood Authority (NBA) (2015). Patient Blood Management guidelines module 4 Critical Care. NBA, Canberra, Australia.
- National Blood Authority (NBA) (2015). Patient Blood Management Guidelines: Module 5 – Obstetrics and Maternity. NBA, Canberra, Australia.
- National Blood Authority (NBA) (2016). Patient Blood Management guidelines module 6 Neonatal and Paediatrics. NBA, Canberra, Australia.
- Kaufman RM, Djulbegovic B, Gernsheimer T, Kleinman S, Tinmouth AT, Capocelli KE, et al. Platelet Transfusion: A Clinical Practice Guideline From the AABB. Ann Intern Med.162 (3):205-13. 2015. Doi: 10.7326/M14-1589.
4.5.3 Descripción de las guías de práctica clínica seleccionadas para la adopción
Las recomendaciones incluidas en la presente GPC fueron adoptadas con permiso del “Consejo Nacional de Salud e Investigación Médica del Gobierno de Australia” y la “AABB Advancing Transfusion and Cellular Therapies Worldwide de EEUU”.
Los detalles metodológicos, el plan de actualización y los documentos de las GPC originales los encuentra en los enlaces:
Patient blood management guidelines module 1-6:
https://www.blood.gov.au/system/files/documents/pbm-module-1.pdf
- https://www.blood.gov.au/system/files/documents/pbm-module-.pdf
- https://www.blood.gov.au/system/files/documents/pbm-module-1.pdf
- https://www.blood.gov.au/system/files/documents/pbm-module-2.pdf
- https://www.blood.gov.au/system/files/documents/pbm-module-3.pdf
- https://www.blood.gov.au/system/files/documents/pbm-module-4.pdf
- https://www.blood.gov.au/system/files/documents/pbm-mod-5_0.pdf
- https://www.blood.gov.au/system/files/documents/pbm-module-6.pdf
Platelet Transfusion: A Clinical Practice Guideline From the AABB:
http://annals.org/aim/article/1930861/platelet-transfusion-clinical-practice-guideline-from-aabb2
a.) Guía de práctica – Pautas para la Gestión intrahospitalaria de hemocomponentes.
El objetivo de esta guía es proporcionar recomendaciones para la gestión de la sangre del paciente y como mejorar los resultados clínicos al evitar la exposición innecesaria a los componentes sanguíneos. Incluye los tres pilares:
- La optimización del volumen de sangre y el volumen eritrocitario.
- Minimización de la pérdida de sangre
- Optimización de la tolerancia a la anemia por el paciente.
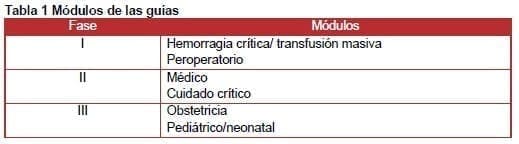
Esta GPC se desarrolla en seis módulos que se centran en la práctica basada en la evidencia. La necesidad de estas directrices para el gobierno Australiano fue la revisión de la GPC del año 2001.
Los seis módulos de las guías se desarrollaron en tres fases (Tabla 1).
b.) Transfusión de plaquetas: una guía de práctica clínica de la AABB
El objetivo de esta guía es generar pautas para proveer recomendaciones, basadas en las mejores evidencias, sobre la transfusión de plaquetas en pacientes adultos. Estas pautas se basan en una revisión sistemática de ensayos clínicos aleatorios y estudios observacionales (1900 a septiembre de 2014) que informaron resultados clínicos en pacientes que recibieron transfusiones plaquetarias profilácticas o terapéuticas.
Referencias
- 1. Bolton P, Hannah M. Serius Hazards of transfusion (SHOT) haemovigilance and progress is improving transfusion safety. Br J Haematol. 2013; 163 (3):303-314.
- 2. Minck S, Robinson K, Saxon B, et al. Patient blood management. The GP´s guide. Aust Fam Physician. 2013; 42(5): 291-297.
- 3. Resolución 2003 2014 – Ministerio de Salud y Protección Social. Colombia. “Por la cual se definen los procedimientos y condiciones de inscripción de los Prestadores de Servicios de Salud y de habilitación de servicios de salud”.
- 4. Manual de Hemovigilancia, Instituto Nacional de Salud, subdirección Red Nacional de Laboratorios, Coordinación Red Nacional de Bancos de Sangre y Servicios Transfusioanles, Bogotá Colombia 2010.
- 5. Política Nacional de Sangre. Ministerio de la Protección Social. 5, Ejes de la política, estrategias, líneas de acción, inciso 5.2 solidaridad, estrategia Número 4. 2008.
- 6. Ministerio de Salud y de la Protección Social, Fundación Santafé de Bogotá. Guía Metodológica para la elaboración de Guías de Práctica Clínica con Evaluación Económica en el Sistema General de Seguridad Social en Salud Colombiano. 2014.
- 7. Presentación “Informe anual programa de hemovigilancia”, Reunión anual Red Bancos de Sangre y Servicios de Transfusión – Instituto Nacional de Salud, 2016. Disponible en: http://www.ins.gov.co/lineas-de-accion/Red-Nacional Laboratorios/Publicacio/Informe%20Hemovigilancia%202015.pdf 8. World Health Organization, Screnning donated blood for transfusion – trasmisible infection. ISBN 978 92 4 154788
- 8. 2010.[Internet] http://www.who.int/bloodsafety/ScreeningTTI.pdf Consultada febrero 2017.
- 9. Corwin H. RBC Transfusion in the ICU Is there a Reason? Chest. 1995; 108:767-771.
- 10. Bonnet MP, Deneux C, Bouvier MH. Critical care and transfusion management in maternal deaths from postpartum haemorrhage. European journal of Obstetrics and Gynecology and Reproductive Biology. 2011;158:183-188.
Bibliografías
- 11. Patient Blood Mamagement Guidelines. [Internet]. https://www.blood.gov.au/pbm-guidelines. Consultada Febrero 2017.
- 12. Cotton B, Au B, Nunez T, Gunter O, Robertson A, Young P. Predefined massive transfusion protocols are associated with a reduction in organ failure and postinjury complications. J Trauma. 2009;66(1):41-48
- 13. The AGREE Research Trust. Instrumento AGREE II. Mayo 2009.
- 14. National Blood Authority (NBA) (2015). Patient Blood Management guidelines module 4 Critical Care. NBA, Canberra, Australia.
- 15. National Blood Authority (NBA) (2015). Patient Blood Management Guidelines: Module 5 – Obstetrics and Maternity. NBA, Canberra, Australia.
- 16. Blood transfusion. National Institute for Clinical Excellence 2015.
2 Todos los apéndices están disponibles en el sitio Web