3.2
2. En mujeres con lesión intraepitelial escamosa del cuello uterino en quienes la biopsia no es concluyente para establecer el grado de la lesión, ¿se deben realizar pruebas de inmunohistoquímica (P16 y Ki67) con el fin de hacer el diagnóstico diferencial y orientar la conducta?

3.2.1 Introducción
Las lesiones intraepiteliales escamosas del cérvix, son definidas como alteraciones de las células escamosas, que ocurren en o en vecindad a la zona de transformación y que están relacionadas con la infección por virus del papiloma humano. (1)
La nomenclatura de las lesiones intraepiteliales ha cambiado, denominadas inicialmente Displasias (leve, moderada y severa), luego neoplasia intraepitelial cervical (NIC 1, 2, 3) y actualmente lesión intraepitelial escamosa (Bajo y Alto Grado) (2-4). La clasificación de las lesiones intraepiteliales del cérvix en bajo y alto grado, está basada en criterios histopatológicos conocidos y define riesgo para presentar un carcinoma invasivo concurrente o en un futuro (4).
Dentro de las lesiones intraepiteliales de alto grado se incluyen el NIC 2 y el NIC 3, pero hay que reconocer que el NIC 2 tiene la peor reproductibilidad interobservador de todos los diagnósticos histopatológicos realizados en las biopsias de cérvix (5), lo cual puede traducirse en tratamiento quirúrgico en pacientes que no lo ameritan (6).
Para tratar de evitarlo, se plantea la posibilidad de utilizar biomarcadores por medio de inmunohistoquímica; de los cuales los más estudiados y utilizados son el P16 y KI-67 (7,8). El P16 es sobreexpresado en las lesiones causadas por virus del papiloma humano de alto riesgo y detectado en el 100% de las lesiones de alto grado (NIC 2 – 3) y en el 5%, de las biopsias negativas. El Ki-67, es un marcador de proliferación celular, utilizado especialmente como apoyo para graduar las lesiones intraepiteliales.
No existe evidencia suficiente para el uso rutinario de biomarcadores por inmunohistoquímica
En las lesiones intraepiteliales del cérvix, debido a diferencias en los anticuerpos que se utilizan, a los criterios para definir una prueba como positiva y por las diferencias en la interpretación entre patólogos; entre otras causas.
Sin embargo, hay algunas circunstancias especiales en las que su uso es recomendable como ayuda para realizar un diagnóstico histopatológico acertado; tales como apoyar diagnóstico de NIC 2, diferenciar entre LEI de alto grado (NIC 2 – 3) y simuladores, cuando exista desacuerdo importante entre patólogos y cuando la biopsia sea negativa en pacientes con diagnóstico citológico de LEI de alto grado (NIC 2 – 3), ASCUS-H, ASCUS con prueba HPV – 16 + y AGUS (9).
3.2.2 Resumen de la evidencia
Los expertos sugirieron una guía existente, la cual por su baja calidad metodológica fue descartada y en su lugar se incorporaron los estudios primarios relevantes al bloque de evidencia (11).
La revisión sistemática publicada por Tsoumpou et al describe el papel de los biomarcadores en la detección del cáncer de cuello uterino y su eficacia como un marcadores de riesgo de progresión de las lesiones cervicales de bajo grado (NIC 1) (10).
De la revisión se tomaron únicamente los resultados provenientes de los 40 estudios hechos en muestras histológicas, los cuales son descriptivos.
Estos estudios incluyen muestras histológicas de las zonas del ponche, bucle, zona de transformación, biopsias de cono y especímenes de histerectomía. Hubo marcada variabilidad entre los estudios en cuanto al tipo de anticuerpos utilizados y el método de tinción según la indicación de cada fabricante.
Los estudios histológicos incluidos fueron aquellos que adoptaron la distribución de la tinción propuesto por Klaes o que podrían ser convertidos a este sistema de clasificación; según este sistema la distribución de positividad se define en una escala semicuantitativa de la siguiente manera:
- Negativo: <1% de las células son positivas.
- Células esporádicas aisladas positivas: <5%.
- Grupos de células focales positivas: <25%.
- Difuso: >25 % de las células son positivas.
Se consideró además como punto de corte positivo para inmunoreactividad de P16 el patrón difuso que incluye dos capas de células basales y parabasales e indica la transformación por VPH. Las características generales de los estudios y el porcentaje de biopsias P16 positivas por grado de lesión histológica de la neoplasia intraepitelial se resumen en la Tabla 3.2.1.
3.2.3 Calidad de la evidencia
La calidad de la evidencia fue muy baja debido a limitaciones en la consistencia, la precisión, y la evidencia directamente aplicable.
Para la evaluación de la calidad de la revisión sistemática se empleó la herramienta AMSTAR, La Revisión (AMSTAR 7/11) presentó limitaciones de calidad debido a la no evaluación ni el reporte del riesgo de sesgos de los estudios incluidos y su consecuente inclusion en el reporte de los resultados, el no reporte de la evaluación de un posible sesgo de publicación, y el no reporte de posibles conflictos de interés.
Teniendo en cuenta que la revisión no incluyó la evaluación de riesgo de sesgos para los estudios primarios, se procedió a la descarga y evaluación mediante la herramienta SIGN para pruebas diagnósticas. La calidad global de los estudios fue aceptable.
Las principales limitaciones de los estudios incluidos en la fueron la inclusión de población distinta a la población objeto de la pregunta de la guía, la incertidumbre del cegamiento del personal en la medición de la prueba índice respecto a los resultados del estándar de referencia, la incertidumbre del tiempo transcurrido entre la medición del estándar de referencia y la prueba índice.
En menor frecuencia, otras limitaciones encontradas fueron la incertidumbre sobre el muestreo de la población, las exclusiones inapropiadas, el uso de metodologías de casos y controles y la incertidumbre sobre la similitud de la interpretación y reporte de los resultados en comparación con lo reportado en la práctica.
3.2.4 Resumen de los resultados
La evidencia encontrada no cubrió ninguno de los desenlaces propuestos en la estructura PICO de la pregunta (cáncer invasor, supervivencia, calidad de vida y efectos adversos). Los estudios evaluados calcularon el porcentaje de muestras positivas para P16 en muestras clasificadas histológicamente como normales, de bajo o alto grado (NIC 2 – 3). Esto se consideró un desenlace indirecto para la detección de lesiones de alto grado (NIC 2 – 3).
La proporción de P16 positivo aumentó con la severidad de la anormalidad histológica; en promedio sólo el 2% de las biopsias normales (IC 95% 0.4 a 30%) y el 38% de NIC 1 (IC 95% 23 a 53%) mostró tinción positiva para P16 en comparación con un 68% del NIC 2 (IC 95% 44 a 92%) y 82% de NIC 3 (IC 95% 72 a 92%). No obstante, la alta heterogeneidad de los resultados es evidente: por ejemplo, el porcentaje de P16 positivo para NIC 1 varió entre 0 y 100% en los diferentes estudios (Tabla 3.3). Pese a la alta imprecisión encontrada, la evidencia sugiere una asociación entre el resultado de P16 y los hallazgos histológicos.
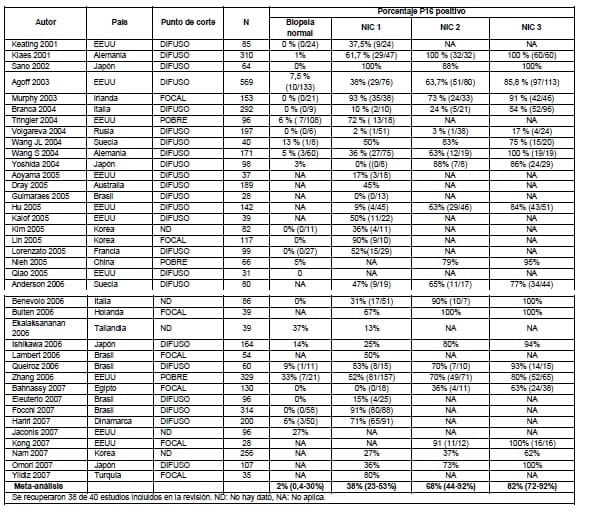
Se reportaron como valores de sensibilidad el porcentaje resumido de p16 en los grupos de NIC II y NIC III
Como valor de especificidad, se indicaron el valor complementario al porcentaje positivo de p16 en el grupo NICI. Como prevalencias se utilizaron los datos reportados por Mendoza y colaboradores, quienes determinaron la prevalencia de lesiones intraepiteliales cervicales en una ciudad colombiana (12).
Se extrajeron los datos de los estudios recuperados de la revisión de Tsoumpou et al para obtener información adicional. La sensibilidad para NIC 2 y NIC 3 osciló entre 3 y 80% (10 estudios) y entre 17 y 100% (11 estudios) respectivamente, el valor predictor de la prueba positiva varió entre 80 y 100% para NIC 2 (7 estudios) y entre 86 y 100% para NIC 3 (5 estudios), y la especificidad varió entre 86 y 100% (6 estudios) (13-34).
(Lea También: Tamización en Mujeres con Histerectomía por Patología no Maligna)
3.2.5 De la evidencia a la recomendación
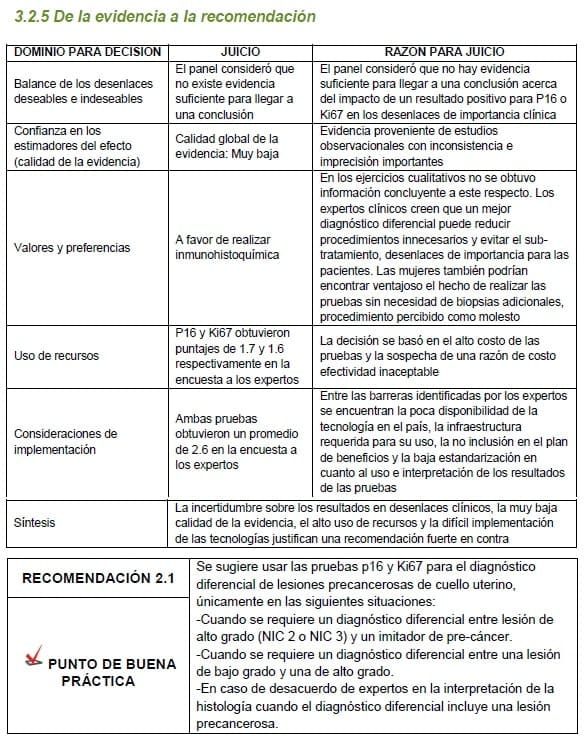
Detalles de la recomendación
No hay beneficio en el uso de P16 como un complemento de rutina para la evaluación histológica de muestras de biopsia con sospecha de lesión precancerosa.
La identificación de las indicaciones así como la elección e interpretación de las pruebas debe ser únicamente a cargo del Médico Patólogo y de acuerdo a la disponibilidad de las pruebas en cada institución.
Necesidades de investigación
Se requieren estudios de prueba diagnóstica en los que se calculen la sensibilidad y especificidad de un resultado positivo de P16 o Ki67 para la detección de lesiones de alto grado (NIC 2 – 3) en las circunstancias consideradas de mayor utilidad. Es deseable además realizar estudios que evalúen la incidencia de cáncer invasor en las pacientes positivas para P16 en la biopsia diagnóstica.
Los estudios deben estandarizar la definición de positividad de la prueba o en su defecto proveer la información necesaria para calcular las características operativas con cada punto de corte. Dado su impacto potencial al prevenir procedimientos innecesarios en las pacientes, es deseable una evaluación formal de tecnología para estas pruebas.
Referencias
- 1. Crum ChP, Nucci MR,Lee KR. Diagnostic Gynecologic and Obstetric Pathology. 2nd ed. Philadelphia, PA. Elsevier Saunders; 2011. 163.
- 2. Rubin IC. The pathological diagnosis of incipient carcinoma of the cervix. Am J Obstet Gynecol 1910;62:668-76.
- 3. Tabbara S, Saleh AD, Andersen WA, Barber SR, Taylor PT, Crum CP. The Bethesda classification for squamous intraepithelial lesions: histologic, cytologic, and viral correlates. Obstet Gynecol 1992;79:338-346.
- 4. Kurman R.WHO Classification of Tumours of Female Reproductive Organs. 4th ed. International Agency for Research on Cancer. Lyion, 2014.
- 5. Galgano MT,Castle PE, Stoler MH, Solomon D, Schiffman M. Can HPV-16genotyping provide a benchmark for cervical biopsy specimen interpretation?.Am J ClinPathol 2008;130: 65-70.
- 6. DijkstraMG, HeidemanDA, De Roy SC, Rozendaal L, Berkhof J, Van Krimpen K, et al. p16(INK4a) immunostaining as an alternative to histology review for reliable grading of cervical intraepithelial lesions. J Clin Pathol 2010;63:972-977.
- 7. Galgano MT, Castle PE, Atkins KA, Brix WK, Nassau SR, Stoler MH. Using biomarkers as objective standards in the diagnosis of cervical biopsies. Am J Surg Pathol 2010;34:1077-1087.
- 8. Klaes R, Benner A, Friedrich T, Ridder R, Herrington S, Jenkins D, et al. p16INK4a immunohistochemistry improves interobserver agreement in the diagnosis of cervical intraepithelial neoplasia. Am J Surg Pathol 2002;26:1389-1399.
- 9. American Society for Colposcopy and Cervical Pathology and College of American Pathologists. Journal of Lower Genital Tract Disease, Volume 16, Number 3, 2012, 205-242.
- 10. Tsoumpou I, Arbyn M, Kyrgiou M, Wentzensen N, Koliopoulos G, Martin-Hirsch P, et al. p16(INK4a) immunostaining in cytological and histological specimens from the uterine cervix: a systematic review and meta-analysis. Cancer Treat Rev [Internet]. 2009 May [cited 2014 Dec 3];35(3):210–20. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2784486
Bibliografías
- 11. Darragh TM, Colgan TJ, Thomas Cox J, Heller DS, Henry MR, Luff RD, et al. The Lower Anogenital Squamous Terminology Standardization project for HPV-associated lesions: background and consensus recommendations from the College of American Pathologists and the American Society for Colposcopy and Cervical Pathology. Int J Gynecol Pathol [Internet]. 2013 Jan [cited 2014 Dec 5];32(1):76–115. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23202792
- 12. Mendoza T Luis Alfonso, Pedroza P Marly Julieta, Micolta C Paul Hernando, Ramirez R Andrés, Cáceres G Christian Ramiro, López S Darling Viviam et al . Prevalencia de lesiones de bajo y alto grado de cuello uterino en una ciudad colombiana. Rev. chil. obstet. ginecol. 2012 ; 77( 2 ): 129-136.
- 13. Keating JT, Cviko A, Riethdorf S, Riethdorf L, Quade B, Sun D, et al. Ki-67, cyclin E, and p16INK4aare complimentary surrogate biomarkers for human papilloma virus-related cervical neoplasia. Am J Surg Pathol. 2001;25:884–91
- 14. Klaes R, Friedrich T, Spitkovsky D, Ridder R, Rudy W, Petry U, et al. Overexpression of p16INK4a as a specific marker for dysplastic and neoplastic epithelial cells of the cervix uteri. Int J Cancer. 2001;92:276–84.
- 15. Sano T, Oyama T, Kashiwabara K, Fukuda T, Nakajima T. Expression status of p16 protein is associated with human papillomavirus oncogenic potential in cervical and genital lesions. Am J Path.1998;153:1741–8
- 16. Agoff SN, Lin P, Morihara J, Mao C, Kiviat NB, Koutsky LA. P16INK4a expression correlates with degree of cervical neoplasia: a comparison with Ki-67 expression and detection of high-risk HPV types. Mod Pathol. 2003;16:665–73
Fuentes
- 17. Branca M, Ciotti M, Santini D, Di Bonito L, Giorgi C, Benedetto A, et al. P16INK4a expression is related to grade of CIN and high-risk human papillomavirus but does not predict virus clearance after conization or disease outcome. Intl J Gynecol Pathol. 2004;23:354–65.
- 18. Volgareva G, Zavalishina L, Andreeva Y, Frank G, Krutikova E, Golovina D, et al. Protein p16 as a marker of dysplastic and neoplastic alterations in cervical epithelial cells. BMC Cancer. 2004;4:58.
- 19. Wang JL, Zheng BY, Li XD, Angstrom T, Lindstrom MS, Wallin KL. Predictive significance of the alterations of p16INK4a, p14ARF, p53, and proliferating cell nuclear expression in the progression of cervical cancer. Clin Cancer Res. 2004;10:2407–14
- 20. Wang SS, Trunk M, Schiffman M, Herreo R, Sherman M, Burk R, et al. Validation of p16INK4a as a marker of oncogenic human papillomavirus infection in cervical biopsies form a population-based cohort in Costa Rica. Cancer Epidemiology Biomarkers Prev. 2004;23:1355–60
- 21. Yoshida T, Fukuda T, Sano T, Kanuma T, Owada N, Nakajima T. Usefulness of Liquid-Based Cytology specimens for the immnocytochemical study of p16 expression and Human Papillomavirus testing.Cancer. 2004;102:100–8
- 22. Aoyama C, Liu P, Ostrzega N, Holschneider CH. Histologic and immunohistochemical characteristics of neoplastic and non-neoplastic subgroups of atypical squamous lesions of the uterine cervix. Am J Clin Pathol. 2005;123:699–706
- 23. Dray M, Russell P, Dalrymples C, Wallman N, Angus G, Leong A, et al. P16INK4a as a complementary marker of high-grade intraepithelial lesions of the uterine cervix. I: Experience with squamous lesions in 189 consecutive cervical biopsies. Pathology. 2005;37:112–24.
Lecturas Recomendadas
- 24. Guimaraes M, Goncalves M, Soares C, Bettini J, Duarte R, Soares E. Immunohistochemical expression of p16INK4a and bcl-2 according to HPV type and to the progression of cervical squamous intraepithelial lesions. J Histochem Cytochem. 2005;53:509–16
- 25. Hu L, Guo M, He Z, Thornton J, McDaniel LS, Hughson MD. Human papillomavirus genotyping and p16INK4a expression in cervical intraepithelial neoplasia of adolescents. Mod Pathol. 2005;18:267–73.
- 26. Kalof AN, Evans MF, Simons-Arnold L, Beatty BG, Cooper K. P16INK4a immunoexpression and HPV In Situ hybridization signal patterns. Am J Surg Pathol. 2005;29:674–9.
- 27. Lorenzato M, Caudroy S, Bronner C, Evrard G, Simon M, Durlach A, et al. Cell cycle and/or proliferation markers: what is the best method to discriminate cervical high-grade lesions? Hum Pathol.2005;36:1101–7.
- 28. Andersson S, Wangsa D, Flores-Staino C, Safari H, Mints M, Hjerpe A, et al. Expression of p16INK4a in relation to histopathology and viral load of “high-risk” HPV types in cervical neoplastic lesions. Eur J Cancer. 2006;42:2815–20.
- 29. Ishikawa M, Fujii T, Saito M, Nindl I, Ono A, Kubushiro K, et al. Overexpression of p16INK4a as an indicator for human papillomavirus oncogenic activity in cervical squamous neoplasia. Int J Gynecol Cancer.2006;16:347–53.
- 30. Queiroz C, Silva TC, Alves VA, Villa LL, Costa MC, Travassos AG, et al. P16INK4a expression as a potential prognostic marker in cervical pre-neoplastic and neoplastic lesions. Pathol Res Pract. 2006;202:77–83
- 31. Eleuterio J, Giraldo P, Goncalves A, Cavalcante D, Ferreira F, Mesquita S, et al. Prognostic markers of high-grade squamous intraepithelial lesions: the role of p16INK4a and high-risk human papillomavirus. Acta Obstet Gynecol Scand. 2007;86:94–8.
Referencias Bibliográficas
- 32. Focchi G, Silva I, Nogueira-de-Souza N, Dobo C, Oshima C, Stavale J. Immunohistochemical expression of p16(INK4A) in normal uterine cervix, nonneoplastic epithelial lesions, and low-grade squamous intraepithelial lesions. J Low Genit Tract Dis. 2007;11:98–104.
- 33. Hariri J, Oster A. The negative predictive value of p16INK4a to assess the outcome of cervical intraepithelial neoplasia 1 in the uterine cervix. Int J Gynecol Pathol. 2007;26:223–8.
- 34. Omori M, Hashi A, Nakazawa K, Yuminamochi T, Yamane T, Hirara S, et al. Estimation of prognoses for Cervical Intraepithelial Neoplasia 2 by p16INK4a immunoexpression and High-Risk HPV In Situ Hybridization signal types. Am J Clin Pathol. 2007;128:208–17.