Dr. FRANCISCO J.RODRÍGUEZ, M.D.
Profesor Asistente de Oftalmología
Fundación Oftalmológica Nacional
Facultad de Medicina
Colegio Mayor de Nuestra Señora del Rosario
Resumen
En este artículo resume los mecanismos, los signos y síntomas, los métodos diagnósticos para detectarla, el tratamiento y el diagnóstico diferencial de toxicidad retiniana y del epitelio pigmentario de la retina por la cloroquina e hidroxicloroquina.
Palabras clave: Toxicidad retiniana, Antimaláricos, Epitelio Pigmentario
Summary
This article summarizes the mechanisms, the signs, symptoms, and the diagnostic methods to detect it, the treatment and the differential diagnosis of the retinal toxicity and of the retinal pigmentary epithelium by the choroquine and the hydroxychloroquine.
Key words: Retinal toxicity, Antimalarials, Pigmentary epithelium
Introducción
La cloroquina y la hidroxicloroquina son miembros del grupo de 4 amino-quinolinas que son substitutos sintéticos de la quinina. La diferencia radica en que la segunda se caracteriza por la b-hidroxilacion de uno de los substitutos N-etil (Figura 1). Estas drogas fueron utilizadas inicialmente como antimaláricos durante la segunda guerra mundial. También han sido usadas para el tratamiento de amebiasis extraintestinal y con sus propiedades anti-inflamatorias han sido útiles en el manejo de algunos casos de artritis reumatoidea, lupus eritematoso discoide y lupus eritematoso sistemico1,2.
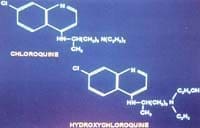
Figura 1. Composición de la cloroquina y la hidroxicloroquina.
La diferencia radica en la b-hidroxilacion de uno de los substitutos N-etil en la hidroxicloroquina.
Los efectos farmacológicos de 400 mgr de hidroxicloroquina son equivalentes a 500 mgr de cloroquina y es utilizada para las mismas indicaciones. Aunque la hidroxicloroquina puede producir toxicidad retiniana incluyendo la maculopatía en ojo de buey (“bull’s eye”), la incidencia de toxicidad retiniana es menor, probablemente debido a que el grupo hidroxi limita la habilidad de la hidroxicloroquina de cruzar la barrera hemato-retiniana 3.
Mecanismos de toxicidad
El mecanismo por el cual estas drogas producen toxicidad es desconocido. La cloroquina y la hidroxicloroquina se unen a la melanina y por lo tanto se concentran en la uvea y el epitelio pigmentario. Los factores que pueden influir en el desarrollo de la toxicidad podrían incluir inhibición enzimática e interferencia con funciones metabólicas de las células del epitelio pigmentario de la retina y/o fotoreceptores. La retención prolongada de la droga en estos tejidos, probablemente es la responsable de la progresión de la retinopatía o la aparición de la retinopatía de inicio tardío a pesar de haberse suspendido la droga. Pequeñas cantidades de las drogas pueden ser detectadas en orina hasta 5 años después de ser suspendidas4 -7.
Histopatológicamente los hallazgos informados son la presencia de cuerpos citoplasmáticos membranosos y cambios degenerativos en segmentos externos de los fotoreceptores. Estos cambios son típicos de drogas que interfieren con la ruptura de los fosfolípidos, con daño probable de los lisosomas. Sin embargo, los cambios más tempranos suceden en las células ganglionares. No se han informado alteraciones en el epitelio pigmentario de la retina.5, 8-10
Signos y síntomas de la toxicidad
La toxicidad retiniana en pacientes en tratamiento con cloroquina fue reportada inicialmente en 1957 por Cambiaggi 11, en una paciente con lupus eritematoso sistémico . Aunque inicialmente los hallazgos fundoscópicos fueron atribuídos al lupus eritematoso sistémico, los hallazgos histopatológicos reportados años más tarde, comprobaron la toxicidad.5
El signo más temprano de toxicidad puede ser la presencia asintomática de pigmento granular perifoveal asociado a pérdida del brillo foveal (Figura 2A,B). Esto puede progresar a alteraciones pigmentarias más prominentes o a la configuración de “ojo de buey” (“bull’s eye”) (Figura 3A,B). La periferia de la retina también puede presentar una granularidad pigmentaria no específica asociada a una pérdida del reflejo foveal. En casos avanzados de toxicidad la apariencia de la retina puede parecer una degeneración tapetoretiniana avanzada con degeneración pigmentaria difusa, palidez del nervio óptico y atenuación vascular, dando una apariencia similar a la observada en pacientes con retinitis pigmentosa.12 – 15
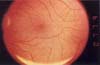
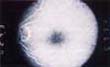
Figura 2. A. Pigmento granular perifoveal, el cual constituye la primera etapa de la toxicidad por la cloroquina. El diagnóstico diferencial en esta etapa debe hacerse con drusas maculares y alteraciones del epitelio pigmentario de la retina. B. Angiografía fluoresceinica del mismo paciente, mostrando que las lesiones presentan un centro ligeramente hipofluorescente que corresponde a la ligera hiperpigmentación de las lesiones observadas en A, rodeadas de una ligera hiperfluorescencia que no se modifica durante el transcurso del estudio.
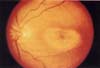
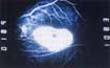
Figura 3.A . Clásica lesión “bull’s eye” u ojo de buey, que se caracteriza por un centro hiperpigmentado rodeado de un halo hipopigmentado y que compromete el área foveal. B. Angiografía fluoresceinica del mismo ojo que muestra que la lesión presenta un centro hipofluorescente con un halo hiperfluorescente que no se modifica durante el transcurso del estudio.
En los estadios tempranos de la toxicidad el paciente puede ser asintomático. Sin embargo, si la retinopatía progresa, el paciente puede notar visión borrosa, nictalopia y presencia de escotomas paracentrales.
Métodos diagnósticos
Los métodos para diagnosticar los estadios tempranos de retinopatía por cloroquina son controversiales. El desarrollo de escotomas paracentrales para objetos rojos en una pantalla tangente pueden presentarse mientras el paciente es asintomático y los cambios en el polo posterior no son aparentes. La retinopatía también puede ser detectada tempranamente con pruebas electrofisiológicas, como las pruebas de umbrales escotópicos para objetos rojos o azules y la perimetría estática mesópica. Por lo tanto exámenes del campo visual central con objetos rojos como la prueba de Amsler rojo (Figura 4) pueden ser utilizados para detectar el estado “premaculopatía”. Esta prueba tiene un bajo costo, es rápida y es un sustituto efectivo de la campimetría. El electroretinograma y el electrooculograma pueden ser anormales en las fases tardías y no son útiles en la detección temprana de la toxicidad. La angiografía fluoresceínica puede mostrar cambios pigmentarios pero no es tan sensible como un buen examen oftalmoscópico de la retina con biomicroscopía con lente de contacto y oftalmoscopia indirecta y estaría indicada únicamente en casos con patología macular preexistente al inicio del tratamiento. Las fotos a color serían prácticas para el seguimiento de los pacientes.12, 15-25

Figura 4. Prueba de Amsler rojo. Con ella se miden los 10 grados centrales de la mácula. Esta prueba se realiza con la mejor iluminación posible y con la corrección para cerca si el paciente la utiliza. Se le pide al paciente que la coloque a 30 centímetros, que fije en el punto central y se le pregunta si observa las cuatro esquinas de la cuadrícula, si hay alguna línea distorsionada y si observa alguna “mancha” dentro de la cuadrícula.
Tratamiento
El seguimiento a largo plazo de pacientes con retinopatía ha demostrado que los cambios retinianos y la función visual permanecen estables una vez la cloroquina ha sido suspendida. Además, los cambios iniciales maculares son reversibles. En casos mas avanzados la retinopatía y la pérdida de visión pueden progresar aun si la cloroquina es suspendida. Los reportes iniciales de estudios de pacientes con cloroquina sugirieron que el riesgo de retinopatía estaba relacionado con la dosis total de la droga y la duración del tratamiento. Sin embargo, estudios recientes han sugerido que la dosis diaria es el factor mas importante, raramente sucediendo una retinopatía con dosis de 250 mgr/día o menos.13,14,17,26 – 32
Diagnóstico diferencial
Las entidades que pueden entrar a considerarse dentro del diagnóstico diferencial del “bull’s eye” u ojo de buey, incluyen aquellas que producen un compromiso bilateral y simétrico como son las enfermedades hereditarias de la retina. Las más frecuentes son la enfermedad de Stargardt y/o fundus flavimaculatus y la distrofia de conos. Sin embargo, en estas entidades las pruebas electrofisiológicas son características y de gran ayuda para el diagnóstico diferencial.33,34
Conclusiones
No hay en la literatura un número importante de Iinformes de toxicidad por cloroquina e hidroxicloroquina, lo que implicaría que el riesgo sería bajo. Los análisis de todos los casos y los informes de la FDA sobre la incidencia de retinopatía inducida por hidroxicloroquina no han mostrado evidencia alguna de escotomas permanentes cuando la dosis diaria no excede 6.5 mgr/kgr. Sin embargo, debido a que la mayoría de pacientes en tratamiento son pacientes de edad y la mayoría de patologías maculares no relacionadas con estas drogas ocurren por encima de los sesenta años, estos deberán ser valorados cada 6 meses por un especialista en retina quien determinará el seguimiento en cada caso en particular. Además, es recomendable que los pacientes practiquen la prueba de Amsler en sus casas como método de detección temprana.35,36
Referencias
1. Gilman AG, Goodman LS. Gilman and Goodman the pharmacological basis of therapeutics. 6th ed. New York : Mac Millan; 1980.
2. Rubin M, Bernstein HN, Zvaifler NJ. Studies on the pharmacology of chloroquine. Arch. Ophthalmol 1963; 70: 80-7.
3. Raines MF, Bhargava SK, Rosen ES. The blood-retinal barrier in chloroquine retinopathy. Invest Ophthalmol Vis Sci 1989; 30: 1726-31.
4. Bernstein H, Zvaifler N, Rubin M, Mansour M. The ocular deposition of chloroquine. Invest Ophthalmol 1963; 2: 384-92.
5. Bernstein HN, Ginsberg J. The pathology of chloroquine retinopathy. Arch Ophthalmol 1964; 71: 146-53.
6. Yanoff M, Tsou KC. A tetrazolium study of the whole eye. Effect of chloroquine in the incubation medium. Am J Ophthalmol 1965; 59: 808-10.
7. Ehrenfeld M, Nesher R, Merin S. Delayed onset chloroquine retinopathy. Br J Ophthalmol 70: 281, 1986.
8. Wetterholm DH, Winter FC. Histopathology of chloroquine retinal toxicity. Arch Ophthalmol 1964; 71: 116-20.
9. Rosenthal AR, Kolb H, Bergsma D. Chloroquine retinopathy in the Rhesus monkey. Invest Ophthalmol Vis Sci 1978; 17: 1158-75.
10. Drenckhahn D, Lullmann-Rauch R. Drug induced retinal lipidosis: Differential susceptibilities of pigment epithelial and neural retina toward several amphiphilic cationic drugs. Exp Mol Pathol 1978; 28: 360-71.
11. Cambiaggi A. Unusual ocular lesions in a case of systemic lupus erythematosus. Arch Ophthalmol 1957; 57: 451-53.
12. Ruiz RS, Saatci OA. Chloroquine and Hydroxychloroquine retinopathy: How to follow affected patients. Ann Ophthalmol 1991; 23: 290-91.
13. Marks JS. Chloroquine retinopathy: Is there a safe daily dose?. Ann Rheum Dis 1982; 41: 52-8.
14. Henkind P., Rothfield N. Ocular abnormalities in patients treated with antimalarial drugs. N Engl J Med. 1963; 269: 433-39.
15. Henkind P, Carr RE, Siegel IM. Early chloroquine retinopathy. Clinical and functional findings. Arch Ophthalmol 1964; 71: 157-65.
16. Percival SPB, Berhman J. Ophthalmological safety of chloroquine. Br J Ophthalmol 1969; 53: 101-109.
17. Carr RE, Gouras P, Gunkel RD. Chloroquine retinopathy. Arch Ophthalmol 1966; 75: 171-78.
18. Hart WM, Burde RM, Johnston GP. Static perimetry in chloroquine retinoapthy. Perifoveal patterns of visual field depression. Arch Ophthalmol 1984; 102: 377-80.
19. Pinkers A, Broekuyse RM. The EOG in rheumatoid arthritis. Acta Ophthalmol (Copenh) 1983; 61: 831-37.
20. Raines MF, Bhargava SK, Rosen E. The blood-retinal barrier in chloroquine retinopathy. Invest Ophthalmol Vis Sci 1989; 30: 1726-31.
21. Al Khamis AR, Easterbrook ML. Critical flicker fusion frequency in early chloroquine retinopathy. Can J Ophthalmol 1983; 18: 217-19.
22. Bishara SA, Matamocos N. Evaluation of several tests in screening for chloroquine maculopathy. Eye 1989; 3: 777-82.
23. Easterbrook M. The use of Amsler grids in early chloroquine retinopathy. Ophthalmology. 1984; 91: 1368.
24. Easterbrook M. The sensitivity of Amsler grid testing in early chloroquine retinopathy. Trans Ophthalmol Soc UK 1985; 104: 204-207.
25. Cruess AF, Schachat AP, Nicholl J, et al. Chloroquine retinopathy. Is fluorescein angiography necessary? Ophthalmology 1985; 92: 1127-1129.
26. Brinkley JR, Dubois EL, Ryan SJ. Long term course of chloroquine retinopathy after cessation of medication. Am J Ophthalmol 1979; 88: 1-11.
27. Burns RP. Delayed onset of chloroquine retinopathy. N Engl J Med 1966; 275: 693-96.
28. Frenkel M. Safety of hydroxychloroquine. Arch Ophthalmol 1982; 100: 841.
29. Johnson MV, Vine AK. Hydroxychloroquine therapy in massive total doses without retinal toxicity. Am J Ophthalmol 1987; 104: 139-144.
30. Mills PB, Beck M, Power BJ. Assessment of the retinal toxicity of hydroxychloroquine. Trans Ophthalmol Soc UK 1981; 101: 109-13.
31. Sassani JW, Brucker AJ, Cobbs W. Progressive chloroquine retinopathy. Ann Ophthalmol 1983; 15: 19-22.
32. Tobin DR, Krohel GB, Rynes RI. Hydroxychloroquine. Seven years experience. Arch Ophthalmol 1982; 100: 81-83.
33. Weise EE, Yannuzzi LA. Ring maculopathies mimicking chloroquine retinopathy. Am J Ophthalmol 1974; 78: 204-10.
34. Gass JDM. Stereoscopic atlas of macular diseases: diagnosis and treatment. 4th de. St Louis: Mosby-Year Book, Inc; 776-778, 1997.
35. Bernstein HN. Ocular safety of hydroxichloroquine. Ann Ophthalmol 1991; 23: 292-296.
36. Levy GD, Munz SJ, Paschal J, Cohen HB, Pince KJ, Peterson T. Incidence of Hydroxychloroquine retinopathy in 1207 patients in a large multicenter outpatient practice. Arthritis Rheum 1997; 40: 1482-86.
