En nuestra paciente se identificaron características clínicas que hicieron sospechar el diagnóstico:
1. Antecedente TCE mastoides derecha y frontal izquierda.
2. Presentación aguda 72 horas.
3.Sodio sérico 128 meq/l, 122 meq/l.
4. Sodio urinario > 80 meq/l: 147meq/l.
5. Gasto urinario 106 cc/m2/h.
6. Evidencia clínica de depleción de volumen TA 80/40, FC 121
7. Duración variable 4 semanas.
8. Función renal normal. Cr 0.5mg%, BUN 8 mg%.
9. No medicación con efectos natriuréticos.
10. Respuesta adecuada al tto con SSN y sodio oral.
La infusión de SS hipertónica en los ventrículos cerebrales de ratas causaron una natriuresis que persistía después de una denervación renal24,25. Sugirieron la presencia en sangre de un factor natriurético capaz de mediar en el SCPS. Smith26, 1957 fue el primero en proponer la existencia de hormonas natriuréticas en sangre.
En 1981 Bold y cols al infundir extractos de tejido atrial en ratas notaron una copiosa natriuresis27. Varios factores natriuréticos han sido identificados PNAtrial, PNB (cerebral) y PN tipo C.

Animo acid sequences of the three human natriuretic peptides.
Secuencia de aminoacidos de los 3 péptidas natriuréticos humanas
PNA se produce en el atrio cardíaco y se estimula su secreción por endotelina, vasopresina y catecolaminas. Se expresa en el riñón como urodilatina con 32 aa regulando el sodio y agua en el riñón28.
PNB aislado en cerebro de porcino, con pro-PNB de 108 aa. Altos niveles en ICC e hipertrofia ventricular.
PNT-C en SNC pituitaria anterior, riñón, endotelio vascular.
Otros péptidos relacionados incluyen guanilina y uroguanilina con 15-16 aa regulan el transporte de agua y sal por la mucosa intestinal.
Se han descrito 3 tipos de receptores A, B, C identificados en todas las células de mamíferos. Los tipo A se unen a PNA, PNB. El PNTC se une al receptor tipo B, este predomina en el cerebro. Ambos receptores en las células adrenales y el riñón28.
PNA reduce la resistencia vascular periférica y disminuye la tensión arterial, reduce el tono simpático. El PNB tiene efectos similares al PNA a nivel cardiovascular.
Todos tienen capacidad para inhibir la mitogénesis en pared vascular y glía31.
PNA estimula la dilatación de la arteria aferente y constricción de la eferente con aumento de la presión intraglomerular y filtración glomerular. Incrementa el GMPc mesangial con relajación de las mismas e incremento de la superficie de filtración29. PNA inhibe la Angiotensina II estimulando el transporte de agua y sodio en túbulo proximal, antagoniza la vasopresina inhibiendo el transporte de agua en túbulo colector31.
Todos los péptidos se producen en el cerebro, en los núcleos centrales del hipotálamo, pre-óptico, antero-ventral, y arcuato.
La acción periférica en corazón y riñón de los péptidos es reforzada por la acción central al inhibir el apetito de sal y agua28-31 (figura No. 1)
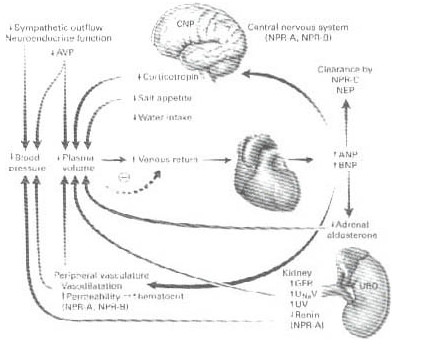
Figura 1
La concentración del PNA es 10.000 veces > que PNB y PNTC30.
La concentración plasmática es 5-45 pg/ml. En pacientes con I.C.Congestiva los niveles de PNA, PNB se elevan, correlacionándose con la disfunción ventricular, arritmias y pobre sobre-vida.
Weinang25, en 1989 determinó los niveles de PNA en plasma en 6 de 8 pacientes neuro-quirúrgicos. Diringer18 en 1988 determina también el PNA en 25 pacientes con aneurismas intracraneales y HSA encontrando niveles elevados comprobados en 4, los cuales retornaron a la normalidad a las 2 semanas.
Yamamoto32 en 1989 describe un paciente con hiponatremia después de HSA. La ADH y PNA se encontraron elevadas a los cinco días después de la hemorragia. Pero solo el PNA permaneció elevado por 13 – 28 días con una hiponatremia prolongada.
El PNA circulante está probablemente involucrado en SCPS; sin embargo, otros factores humorales o efectos neurales directos en los riñones tienen algún papel como la ouabain like, bradiquinina, oxitocina, ACTH, (hormona estimulante de los melanositos) alfa, beta (HSM), PTH, calcitonina33,34.
En el diagnóstico diferencial de hiponatremia considerar la hipervolemia, diuréticos, ICC, Enf. hepática, renal, hipotiroidismo e insuficiencia adrenal.
El diagnóstico diferencial entre SCPS Y SSIHAD se realiza teniendo en cuenta varios parámetros como se describe en el siguiente diagrama30, 31.

Tratamiento
Reemplazo volumen y balance positivo de sal, SSN, 3%, sal oral, varios según severidad y tolerancia. Requerimiento déficit na x agua corporal total (ACT) 50-60% peso. Na plasma no > de 0.7meq/l/h, día 20meq/l19,22,16,3,15,20.
Disminución de V.plasmático >10% en 50% pacientes HSA aneurisma, expansión.
Fludrocortisona, Ishikawa. Efectos secundarios: edema pulmonar, hipokalemia, HTA. Faltan estudios que confirmen eficacia como parte del tratamiento.
Reeder- Harbaugh, urea-salina, 40gr Urea en 100-150ml SSN IV C/8H, infusión 60-100ml/h 1-2 días. Cefalea, nauseas, vomito31. Se requieren mayores estudios para la difusión de dicho protocolo de tratamiento.
Conclusión
Es significativa la evidencia que muestra que algunos pacientes con hiponatremia, con enfermedad intracraneal y quienes fueron previamente diagnosticados como SSIHAD actualmente pueden ser considerados como SCPS. La crítica diferencia entre SSIHAD y SCPS es que este último involucra la pérdida de sal con hiponatremia y pérdida de volumen mientras que aquel su condición es de hiper o normo – volemia. La evaluación del volumen es esencial en hiponatremia. El tratamiento se basa en el reemplazo de agua y sal. El mecanismo aún no está bien entendido, pero involucra los péptidos natriuréticos, influencia directa neural y otros factores natriuréticos. Futuras investigaciones son necesarias para definir la incidencia de SCPS en pacientes con enfermedad intracraneal, identificar otros desórdenes que conlleven a SCPS y tratar de aclarar los mecanismos de este síndrome.
Bibliografía
- Fox JL, Falik JL, Shalhoub RJ. Neurosurgical hyponatremia: The role of inappropiate antidiuresis. J Neurosurg 1971; 34: 506 – 14
- Wijdicks EFM, Vermeulen M, Hijdra A. Hyponatremia and cerebral infarction in patients with ruptured intracranial aneurysms. Is fluid restriction harmful? Ann Neurol 1985;17:137-40,
- Peters JP, Welt LG,Sims EAH. A salt wasting syndrome associated with cerebral disease. Trans. Assoc. Am Physicians 1950; 63: 57 – 64.
- Welt LG, Seldin DW, Nelson WP III,Peters JP. Role of the central nervous system in metabolism of electrolytes and water. Arch Intern Med 1952;90:355-78
- Cort JH. Cerebral salt wasting. Lancet 1954;1:752-4
- Schwartz WB, Bennet W. A syndrome of renal sodium loss and hyponatremia probably resulting from inappropiate secretion of antidiuretic hormone. Am J Med 1957; 23:529-42
- Cooper WC, Green IJ. Cerebral salt wasting associated with Guillain-Barré syndrome. Arch Intern Med 1965;116:113-9
- Goldberg M, Handler JS. Hyponatremia and renal wasting of sodium in patients with malfunction of the central nervous system. N Engl J Med 1960;263:1037-43.
- Wise BL. Inappropiate secretion of ADH caused by obstruction of ventriculoatrial shunts. J Neurosurg 1968;28:429-33
- Zimmerman EA. Endocrine diseases, in Rowland LP. Merritt’s Textbook of Neurology. Philadelphia, Lea & Febiger, 1989: 823 -44.
- Zerbe R, Stropes L. Vassopressin function in the syndrome of inappropiate antidiuresis. Annu Rev Med 1980;31:315-27
- Nelson PB, Seif SM, Maroon JC, Robinson AG: Hyponatremia in intracranial disease. Perhaps not the syndrome of inappropriate secretion of antidiuretic hormone. J Neurosurg 1981;55:938-41
- Wijdicks EFM, Vermeulen M, Hijdra A. Volume depletion and natriuresis in patients with a ruptured intracranial aneurysm. Ann Neurol 1985;18: 211-6
- Vingerhoets F, de Tribolet N. Hyponatremia hypo-osmolarity in neurosurgical patients: “Appropiate secretion of ADH” and “cerebral salt wasting syndrome”.Acta Neurochir 1988;91:50-4
- Sivakumar V, Rajshekhar V, Chandy M. Management of neurosurgical patients with hyponatremia and natriuresis. Neurosurgery 1994;34:269-74
- Oster JR, Perez GO, Larios O, Emery WE. Cerebral salt wasting in a man with carcinomatous meningitis. Arch Intern Med 1983;143:2187-8
- Andrewus BT, Fitzgerald PA, Tyrell JB, Wilson CB. Cerebral salt wasting after pituitary exploration and biopsy: Case report. Neurosurgery 1986;18:469-71
- Diringer M, Ladenson PW, Stern BJ, Schleimer J. Plasma atrial natriuretic factor and subarachnoid hemorrhage. Stroke 1988; 19:1119-24
- Diringer M, Ladenson PW, Borel C, Hart GK, Hanley DF. Sodium and water regulation in a patient with cerebral salt wasting. Arch Neurol 1989;46:928-30
- Yamaki T, Tano-oka A, Takahashi A, Imaizumi T, Suetake K, Hashi K. Cerebral salt wasting syndrome distinct from the syndrome of inappropiate secretion of antidiuretic hormone. Acta Neurochir (Wien) 1992;115:156-62
- Ishikawa S, Saito T, Kaneko K, Okada K, Kusuya T. Hiponatremia responsive to fludrocortisone acetate in elderly patients after head injury. Ann Intern Med 1987;106:187-91
- Ganong CA, Kappy MS: Cerebral salt wasting in children. The need for recognition and treatment. Am J Dis Child 1993; 147: 167-9
- Lolin Y, Jackowski A: Hyponatremia in neurosurgical patients. Diagnosis using derived parameters of sodium and water homeostasis. Br J Neurosurg 1992;6:457-66
- Beasley D, Malvin RL, Mouw DR. CNS-induced natriuresis and renal hemodynamics in conscious rats. Am J Physiol 1983; 245: f763-f771.
- Weinand ME, O‘Boynick PL, Goetz KL. A study of serum antidiuretic hormone and atrial natriuretic peptide levels in a series of patients with intracraneal disease and hyponatremia. Neurosurgery 1989;25:781-5
- Smith HW: Salt and water volume receptors. Am J Med 1957;23:623-52
- Bold AJ, Borenstein HB. Arapid and potent natriuretic response to intravenous injection of atrial myocardial extracts in rats. Life Sci 1981:28:89-94.
- Levin ER, Gardner DG, Samson WK. Natriuretic peptides. N Eng J Med 339:5:321-328, Julio 30, 1998.
- Stockand JD, Sansom MD. Regulation of filtration rate by glomerular mesangial cellsin healthand diabetic renal disease. Am J Kidney Dis 1997;29971:81.
- Márquez LM, Ferrer T, Saldivar Muller CE. Síndrome cerebral perdedor de sal. Bol. Med. Hosp. Ifant Mex.:55:3:148-152, Marzo 1998.
- Harrigan MR: Cerebral salt wasting syndrome. A review: Neurosurgery, Vol 38, No1, January 1996
- Yamamoto N, Kuwayama A, Matsui N, Miyamoto N, Terashima K. Hyponatremia with high plasma ANP level: Report of two cases with emphasis on the pathophysiology of cerebral salt wasting. No Shinkei Geka 1987;15:1019-23
- Klahr S, Rodríguez HJ. Natriuretic hormone. Nephron 1975;15:387-408.
- Valentin JP, Wiedemann E. Natriuretic properties of melanocyte-stimulating hormones. J Cardiovasc Pharmacol 1993; 22 (suppl 2): S114-S8
