Dra. Diana Marcela Álvarez Vargas
Residente II de Pediatría
Universidad del Rosario
Dr. Ricardo Gastelbondo A.
Nefrólogo Pediatra
Docente Nefrología Pediátrica
Hospital Militar Central, Clínica Colsubsidio
Fundación Cardio Infantil
Resumen
El Lupus Eritematoso Sistémico (LES) es una enfermedad autoinmune que cursa con manifestaciones multisistémicas y en niños, en al menos un 75% de los casos, se manifiesta con compromiso renal. Existe correlación entre las manifestaciones renales y el grado histológico de lesión renal producido por la enfermedad; de acuerdo con la clasificación de la enfermedad se puede instaurar un tratamiento adecuado, el cual básicamente está constituido, actualmente, por corticoides e inmunosupresores, que buscan preservar la función renal produciendo el menor número de efectos secundarios. El curso y pronóstico de la enfermedad es impredecible y variable pero con la terapéutica disponible ha mejorado en las últimas décadas. Para el futuro la terapia inmunogenética promete mejorar las condiciones de los niños con esta severa enfermedad.
Palabras clave: Lupus eritematoso sistémico, nefropatía lúpica, glomerulonefritis proliferativa difusa, ciclofosfamida.
Summary
SLE is an autoimmune disorder which has a course with many sistemic manifestations. Olmost 75% of children with this illness manifest renal disturbances. There is a relationship between renal severity manifestations and the type and hystologic degree. Correct treatment is based on manifestations and degree of renal involvement. The treatment consist on corticosteroids and cytostaic drugs. This treatment finds preservation of renal function, improve renal outcome and has the smallest complications. The course of SLE is characterized by exacerbations and remissions that vary in severity. With actual terapeutic drugs it has improved in the last decades. Future immunogenetic therapy promise to get better results in child.
Key words: Systemic lupus erytematosus, lupus nephritis, diffuse proliferative glomerulonephritis, cyclophosphamide.
Introducción
El Lupus Eritematoso Sistémico (LES) es el prototipo de enfermedad autoinmune de los seres humanos1. Se caracteriza por la inflamación diseminada de vasos sanguíneos y del tejido conectivo, la presencia de anticuerpos antinucleares (ANAS) e inmunocomplejos, curso episódico, variable e historia natural impredecible, en ocasiones mortal1,2.
Historia
La enfermedad ha constituido un misterio para el cuerpo médico desde hace varios siglos. La palabra LUPUS procede del latín (lobo) y se utiliza desde el siglo XIII para describir lesiones faciales recurrentes3. En 1895 Osler describe la naturaleza sistémica de la entidad; en 1922 Rowntree y Keith informan el compromiso renal, en 1948 Hargrave, Richmond y Morton descubrieron el fenómeno de células LE1,3 y a partir de esa fecha se ha reconocido el amplio espectro de manifestaciones de la enfermedad.
El LES ha sido considerado de evolución tórpida y con una alta mortalidad. En la segunda mitad de este siglo con el empleo de los corticoides, antihipertensivos, antibióticos e inmunosupresores se ha cambiado el curso natural de esta enfermedad y se ha logrado disminuir considerablemente su mortalidad4.
Epidemiología
Afecta a todas las razas, edades y sexos5; predomina en la raza negra y más del 90% de los casos corresponden a mujeres de 13 a 30 años1 , con una relación 9-10:1 entre sexo femenino y masculino en adultos6, 7. En la primera década de la vida la diferencia por sexos es menor correspondiendo a una relación 3:1 en niños3, 7. El inicio de la enfermedad en la infancia corresponde al 15 a 17% de todos los casos de LES2.
La incidencia en mujeres es de 1 por cada 1.000 habitantes1 y en niños es de 0.6 por cada 100.000 habitantes2, 3, 7. Se ha descrito una prevalencia general de la enfermedad de 2.000.000 en Estados Unidos4. 5% de los casos en adultos y 25% de los casos en la población pediátrica tienen demostrada relación familiar1- 3. Se presenta con más frecuencia entre las familias que padecen linfomas, mielomas, inmunodeficiencias y 30% de los familiares presentan ANA (+) sin enfermedad1. Se ha observado en el 50% de los gemelos monocigotos y se relaciona con la presencia de antígenos de histocom-patibilidad tipo B8, DRw3, DR2, DRBA11, DQw1, DQA1, DQB1 y DRB351-2; en la raza negra con los tipos DR3 y DR71. El grupo étnico de mayor riesgo para padecer la enfermedad son los negros afrocaribes2, 4, 7.
Más del 75% de los pacientes en la edad pediátrica presentan compromiso renal y este es más frecuente y severo en niños3, 8-10. Parece que los pacientes de sexo masculino tienen más compromiso renal que las mujeres. Algunos antígenos HLA que se han asociado con mayor riesgo de nefritis lúpica son: HLA-DR2 y HLA-B81. También la presencia de polimorfismos en los receptores Fc para la IgG (FcGammaR) son factores de riesgo para desarrollar compromiso renal4.
De 40 pacientes atendidos por nefritis lúpica en la Clínica Colsubsidio, Hospital Militar Central, Fundación Cardio Infantil e Instituto del Seguro Social de Santafé de Bogotá (ver gráfico No 1) 80% correspondió al sexo femenino con una relación mujer : hombre de 4:1 (ver gráfico No 2). El 60% estuvo ubicado en el grupo etáreo de 11 a 15 años; como se describió antes, la enfermedad es más frecuente en la segunda década de la vida. Fue llamativo observar que el 5% de los pacientes es menor de cinco años y entre estos hubo un paciente de un año, lo cual es infrecuente y empeora el pronóstico (ver gráfico No 3).
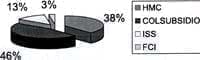
Gráfico No. 1 Pacientes con nefritis lúpica Santafé de Bogotá 1983-1999
Distribución según institución N=40

Gráfico No. 2 Pacientes con nefritis lúpica Santafé de Bogotá 1983-1999
Distribución según sexo N=40

Gráfico No. 3 Pacientes con nefritis lúpica Santafé de Bogotá 1983-1999
Distribución según grupos etáreos N=40
Patogénesis
La enfermedad es de etiología desconocida7. Se ha descrito como una pérdida del control de las funciones inmunológicas y del “auto reconocimiento” desencadenado en individuos con susceptibilidad genética (gen en el cromosoma 1)4, 11 que son expuestos a agentes ecológicos (sol, drogas, infecciones virales, alimentos, etc) y que bajo un ambiente hormonal predisponente (estrógenos)1, 2, sufren una alteración en la función de los linfocitos T, con disminución de los linfocitos T supresores (CD8) y aumento de los activadores (CD4)1. Lo anterior se traduce en hiperactividad y maduración policlonal de células B productoras de autoanticuerpos contra las células de vasos sanguíneos y tejido conectivo de todos los órganos de la economía corporal1, 3, (Ver gráfico No 4)
Las manifestaciones clínicas son el resultado de la injuria vascular e inflamación tisular recurrentes debido a depósitos de complejos inmunes, leucotrombosis, trombosis o secundario a la acción específica de anticuerpos contra antígenos celulares específicos que afectan la función de algunos órganos1,4. La lesión renal es el resultado del proceso inflamatorio desencadenado por los complejos inmunes depositados en el riñón, alteraciones de la coagulación y acción de anticuerpos específicos contra las membranas renales (Ver gráfico No 5).
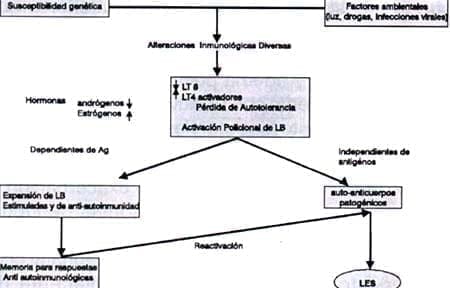
Gráfico No. 4 (Tomado de referencia No. 1)
Fisiopatología L.E.S.

Gráfico No. 5 Fisiopatología de la nefropatía lúpica
Las alteraciones inmunológicas son hete-rogéneas y esto explica las diferencias en las manifestaciones de la enfermedad.
1. Alteración de la función de los linfocitos T (LT): existe una alteración en la función de LT supresores que impide que estos regulen la producción de anticuerpos por los linfocitos B (LB)1, 2. Hay aumentada actividad de los linfocitos CD4 principalmente a nivel renal tanto en células renales parenquimatosas como no parenquimatosas que expresan la molécula CD40L, la cual al interactuar con los LB producen aumento de inmuno-globulinas y favorecen la elaboración de citoquinas inflamatorias como el gamma Interferón, moléculas de adhesión (CDG2E) y quimoquinas2, 12. Además, se ha descrito linfopenia de LT por la producción de anticuerpos y los pacientes con LES tienen alterada la respuesta a la IL2 por poseer receptores de baja afinidad para esta en los linfocitos1,2.
2. Función de células B: La enfermedad se caracteriza por hipergammaglobulinemia policlonal1, 12, con LB aumentados en número, que producen inmunoglobulinas en respuesta a la acción de la IL6 de los LT y por autoestímulo de su producción, con IgM antilinfocitos que se relacionan con linfocitopenia y alteraciones en el sistema nervioso central (reacción cruzada)2.
3. Complejos inmunes: En el LES los anticuerpos circulantes forman complejos inmunes (IgG Fc) que activan al complemento por la vía clásica o alterna y lo consumen2. Se producen lesiones por depósitos de complejos inmunes principalmente en el glomérulo (C3,C4, inmunoglobulinas, Properdina, DNA, RNP). En la patogenia de la nepropatía parece ser más importante la formación in situ de complejos inmunes que el depósito de complejos circulantes1.
El complejo C1q se une al DNA nativo y junto con este al colágeno tipo IV de la membrana basal glomerular produciendo lesiones1. El LES se asocia con alterado aclaramiento de complejos inmunes circulantes por baja expresión de CR1, defectos de la función de receptores RcFc o déficit de los factores del complemento temprano como C4A4.
El depósito de complejos inmunes en el glomérulo depende de varios factores:
• Presión de filtración
• Liberación de aminas vasoactivas por los basófilos sensibilizados por IgE
• Tamaño de los inmunocomplejos, fijación del complemento, afinidad de anticuerpos.
• Presencia de células del sistema retículo endotelial (normalmente las células mesangio glomerulares aclaran los complejos inmunes del compartimento vascular y tienen un rol central patogénico en la lesión renal)
4. Alteración en la producción de citoquinas y linfoquinas: En los pacientes con LES existe déficit de IL1 e IL2 y niveles anormales de interferón1,12. Estos fenómenos son considerados críticos en la perpetuación de la enfermedad1. Los pacientes con LES tienen LT con respuesta alterada a la acción de la IL2 por poseer receptores con baja afinidad para esta linfoquina1. Concomitan-temente, hay un aumento de receptores de IL2 que se relaciona con anticuerpos anti DNA nativo3. Los LB proliferan en respuesta a los altos niveles de IL6 producida en LT CD4 y por auto estimulación de IL61. En el LES también se encuentran aumentadas la IL4, IL5 e IL66.
5. Sensibilización al DNA nativo: Se interroga la existencia de una sensibilización al DNA nativo, porque las paredes de algunos virus, bacterias, linfocitos T, plaquetas y cardiolipinas tienen reacción cruzada con antígenos antiDNA1. Se ha observado partículas virales en el endotelio de pacientes con LES y antígenos virales tipo C en el glomérulo1,2.
6. Alteraciones de la coagulación: Los anticuerpos antifosfolípidos/anticardiolipinas producen interferencia con complejos de activación de protrombina (anticoagulante lúpico) y estos hallazgos se relacionan con lesiones glomerulares y retinianas1,2,6.
7. Déficit hereditario del complemento e inmu-noglobulinas: Se ha demostrado déficit de factores del complemento tipo C2, C4 y C1 estearasa inhibidor2,3,13. Algunos interrogan disminución de la capacidad del complemento para eliminar complejos inmunes2 y se ha descrito déficit selectivo de IgA2.
8. Medio hormonal alterado: Se considera que un aumento del nivel sanguíneo de estrógenos, hormona folículo estimulante, prolactina y hormona luteinizante, con niveles de testosterona disminuidos constituyen factores de riesgo para LES, mientras que las hormonas masculinas se consideran factores de protección1,2. El síndrome de Klinefelter en hombres se asocia en hombres con LES2.

