La segunda hipótesis que se pretende demostrar es que la ELP es debida a una serie de procesos traumáticos que determinarían la injuria de la circulación arterial de la epífisis proximal del fémur que originaría su isquemia y su necrosis.
La teoría traumática como causa de la enfermedad de Perthes fue inicialmente sospechada y descrita por Legg en su artículo original.
Numerosos autores han tratado de comprobarla experimentalmente; entre ellos: Trueta, Caffey, Freeman, Asir, England, Fergusson y más recientemente Thompson y Salter.
El mecanismo traumático ha sido interperetado en forma diversa por los diferentes investigadores, los cuales sin embargo, están de acuerdo en que el trauma puede ser uno de los determinantes de la interrupción del flujo sanguíneo a la epifísis femoral en un momento del desarrollo del hueso en que el cartílago de crecimiento constituye una barrera que aisla la circulación del cuello, de la cabeza del fémur.
La irrigación de la epífisis proximal del fémur y de su cartílago proximal de crecimiento está suministrada por pqueñas y frágiles arteriolas quje llegan a esta región por medio de los vasos retinaculares y que producen de dos arterias de mediano calibre: La arteria externa y la arteria metafisiaria interna, ambas ramas de las arterias circunflejas.
Es un hecho ya plenamente confirmado que la necrosisi de la epífisis sobreviene cuando su circulación sanguínea se interrumpe. De acuerdo con Ponseti se presume que estra interrupción ocurre en primera instancia, cuando los vasos retiniculares atraviesan la capa espesa de cartílago en el reborde del cartílago epifisiario.
El desgarro de la sacudida brusca de este cartílago debilitado sistemáticamente, y producido por la acción de un trauma, puede ser suficiente para alterar la continuidad de los vasos, antes de que estos alcancen el núcleo epifisiario de la cabeza femoral.
Se ha invocado como un posible mecanismo frecuente de este trauma un movimiento repentino de extrema abducción acompañado de rotación interna del muslo, hecho frecuente en los juegos infantiles, especialmente de los varones. Trueta, específicamente, señala la relación constante entre la frecuencia 4 a 5 veces mayor de la ELP en el niño que en la niña, por estar aquel mas expuesto a este tipo de trauma.
En este contexto es permisible también mencionar como las fracturas de la epífisis próxima del fémur en el niño pe pequeños son 3 a 2 veces más frecuentes que en la niña. Trueta y Lima señalan una historia de trauma en 33 por ciento de los niños y 37% de las niñas. Nosotros hemos encontrado al respecto una frecuencia total de 24%: En 39 de 163 pacientes.
Otra zona especialmente vulnerable de la circulación arterial tal como se verá más adelante, asienta en el centro de la epífisis próximal del fémur, en donde confluyen las fuerzas de presión y de tensión de la cadera, siendo asiento en casos especialmente de una fractura que a su vez compromete, como luego se verá, determinadas arteriolas que normalmente irrigan dicha epífisis.
Varios autores han propuesto la teoría de una doble interferencia vascular por lesión de la arteria epifisiaria externa como causa definitiva de la desión isquémica.
Los trabajos experimenteales llevados a cabno es perros por varios investigadores principalmente los realizados por Freeman y colaborasores del London Hospital, produciendo interrupciones de la suplencia vascular a la epífisis femoral superior, así como los estudios de biopsias de epífidid óseas femorales de niños con ELP llevados a cabo por Osaka y Mizuno de Japón y Freeman y vernon-Roberts en Inglaterra, tratan de demostrar lo indispensable de un doble de accidente vascular consecutivo para que tenga lugar una verdadera Enfermedad de Legg-Perthes.
Fisiopatología de la enfermedad de Legg-Perthes
1. La doble interferencia circulatoria y sus fases anatomopatológicas
Los autores anteriormente mencionados han demostrado experimentalmente la trascendencia de que existan dos fases sucesivas de insquemia en el curso anatomopatológico de la afección.
Cada una de ellas como resultante de sendos infartos posiblemente de orden traumático de los vasos nutricios de la epífisis femoral., en el curso de la ELP. De sólo ocurrir una sola fase, vale decir un solo infarto, tan sólo se desarrollaría una “ELP frustrada”, dando lugar a una alteración patológica, que se ha pretendido denominar Enfermedad de Legg-Perthes en Potencia; se requiriría, pues, la ocurrencia de dos infartos consecutivos para que se establezca una “verdadera enfermedad fe Legg-Perthes”.
En el caso de ser indudable la fisiopatología, aparentemente ya muy demostrada, se considera importante resaltar la existencia de varios hechos que serian comunes a los dos procesos señalados:
- En ambas fases existe una injuria vascular, que es mayor en la primera de ellas.
- En ambas fases se desarrolla un proceso de regeneración vascular por vasos procedentes de la periferia del cartílago de crecimiento próximal del fémur (parte basal-distal del núcleo de osificación).
- Existe igualmente, en las fases, una regeneración ósea, que es rápida en establkecer en la fase uno y lenta en la fase dos.
Fisiopatología de la enfermedad de Legg-Pertes
|
Necrosis aséptica de la epífisis proximal del fémur |
|
| Isquemia seguida de necrosisi Revascularización –Regeneración ósea Consolidación: Curación Secuelas |
9 meses |
Enfermedad de Legg-Perthes: Fisiopatología
|
Isquemia necrosis repetida de la epif.póx.fémur. |
|
|
Enfermedad de Legg-Perthes: fase resudual o secuelas |
|
Se aprecia también, en ambas fases una proliferación del cartílago articular, incluso de su capa profunda, correspondiente al cartílago de crecimiento de la epífisi. La nutrición de este cartílago depende del líquido sinovial y no de la circulación sanguínea.
De acuerdo con los investigadores arriba citados el proceso anatomopatológico, en el animal de experimentación tendría el siguiente desarrollo:
1. Primera fase
Infarto inicial (ELP potencial). Los siguientes acontecimientos se suceden en forma progresiva:
1. Depresión total de sangre en la epífisis femoral ocasionado por un evento extrínseco cuyo origen ya ha sido discutido.
2. Necrosis total de la epífisi. Detención de la osificación encondral del catílago epifisiario.
3. Rápida revascularización (4 semanas) del núcleo óseo. Lños nuevos vasos encuentran un fácil acceso a través de los canales vasculares primitivos, no alterados en la fase isquémica. El tejido de granulación invade el espacio medular.
4. Pronta reparación del núcleo óseo, sin pérdida de su forma original. Se logra este hecho por el depósito de nuevo hueso en el andamiaje o estructura del hueso muerto. Radiográficamente, el núcleo de osificación aparece más pequeño por haber dejado de crecer, y más denso por la deposición de nuevo hueso sobre el muerto.
5. La parte más apical del núcleo epifisiario, a donde llega más tarde la revascularización, puede persistir avascular.
La llegada de los vasos y la regeneración ósea comienza en la parte basal del núcleo y demora en llegar al ápex aproximadamente seis esemanas.
Este retraso puede causar la muerte definitiva de las células hipertróficas del cartílago, la ausencia de formaciones de huesos y el debilitamiento de las nuevas trabéculas apicales, todo lo cual podría deternminar la aparición de una fractura subcondral en el ápex del núcleo óseo epifisiario, que se hace evidente por una zona clara en la radigrafía.
6. La cabeza que recobra su forma primitiva, se hace posteriormente mas grande que la opuesta.
Para saltar de la fase más temprana de revascularización, el área subcondral de la cabeza se hace vulnerable a la presión pudiéndose causar una fractura subcondral patológica, la cual daria lugar a la verdadera enfermedad de Perthes. Es difícil cuantificar la fuerza necesaria del trauma, pero esta sería compatible con la actividad normal del niño sano.
2. Segunda fase
Por infarto consecutivo. Ocurre en el 50% de los casos de necrosis y en el 100% de los casos de Perthes (verdadera enfermedad de Perthes). La sucesión de dos infartos explica la cronicidad de la enfermedad. Las características anatomopatológicas y el curso evolutivo de esa fase serian las siguientes:
- Los acontecimientos que se presentan tiene lugar en el mismo núcleo epifisiario óseo previamente isquémico, y en esta nueva etapa en vía de regeneración.
- Se inicia nuevamente, por una deprivación de sangre, pero que en esa fase se encuentra cinscunscrito a una zona del bnúcleo epificiario femoral y debido a un accidente rtraumático de la arteria central de la epífisis, rama terminal de la arteria epifisiaria externa. La lesión de este vaso se produciría por la acción de fuerzas mecánicas que obrarían sobre la cabeza femoral y por procesos que seran descritos más adelante. Estas fuerzas serían también determinantes de la fractura subcondral.
- En seguida por una necrosis parcial del núcleo, en un área circunscrita y localizada, usualmente en la parte más cuperior, anterior y externa de la epífisis revitalizada. El área afectada estaría rodeada de hueso no isquémico, situado en el hueso subcondral apical, y en la parte medial y lateral del núcleo óseo.
- Aparece una necrosis del tejido de granulación, que se había formulado en la primera fase.
- Continúa un proceso de revascularización, que es mucho más lento que en la fase 1, debido a la dificultad que encuentran los nuevos vasos para ocupar toda el área necrosada. Los canales vasculares originales se encuentran ocluidos por los fragmnentos de antiguos trabéculas óseas fracturadas, y por la invasión de tejido fibroso.
- Existe irregularidad en la reparación ósea por la desigual dificultad encontrada en la difusión de los nuevos vasos. Este hecho se traduce en la radiografía por zonas de diferente densidad en el núcleo óseo afectado.
- Aumento del área apical no osificada. Ahora ocupada por tejido fibroso y fragmentados del hueso muerto, todo lo cual impide la llegada de nuevos vasos, procedentes, como se dijo de la parte más distal, e inferior del núcleo epifisiario, y que toma aproximadadmente 10 semanas en alcanzar el ápex del núcleo. Esta área, que ya puede estar presente al final de la primera fase constituye en definitiva la fractura subcondral.
Para Salter la segunda fase comenzarpía por la producción de la fractura subcondral, la cual sería seguida de un colapso trabecualar, en la zona que había comenzado a revascularizarse en la primera fase de la enfermedad. El colapso produciría una nueva etapa de isquemia, necrosis y revascularización, fases muy clásicas de la verdadera enfermedad de Perthes.
A las dos fases fisiopatológicas que describen los investigadores es importante sunmar una tercera que sería la Fase residual o de deformidad. Esta ocurriría semanas después de la segunda fase, ya descrita y como comprendería los siguientes pasos:
8. La superficie articular del Apex se fragmenta y deprime debido a la presión soportada por la cabeza femoral y por la debilidad de los tejidos blandos que la sostienen.
9. La formación de nuevo hueso encondral, en el ápex del núcleo vecino a la zona deprimida, tomando la epífisis de la forma de un riñón, en lugar del hemicirculo normal.
10 El centro de la cabeza, isquémico, se colapsa por el peso del cuerpo, comprometiéndose el cartílago de crecimiento y la metáfisi. A su vez el colapso, a manera de cuña, produciría una comprensión excéntrica dentro de la epífisis, deslojando lateral y medialmente las zonas óseas no isquémicas. La extrusión del segmento lateral haría que esta área del hueso, recubierta de su cartílago articular se dispusiera por fuera del reborde cotiloideo poniendo en riesgo la epifisis femoral.
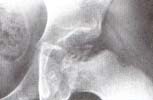
Fig. 1 Colapso del área central de la epífisis
femoral con compromiso del cartílago de
crecimiento. H. C. 22846.
Esta complicación podría eventualmente evitarse o corregirse manteniendo la cabeza femoral en una posición de flexión, abducción y rotación interna, de manera de mejorao la congruencia articular.
En condiciones normales, en niños tratados precoz y convenientemente en los cuales existe una perfecta congruencia cotilo-femoral, con ausencia de lateralización de la epífisis y en caderas con arcos normales de mvimiento, la fractura subcondral no se acompaña de la complicación y deformidad descrita.
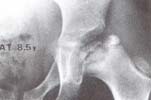
Fig. 2 Extrusión lateral del área externa de la
epífisis femoral. Compromis o de la fisis y de la
metáfisis H.C. 21. 806.
En condiciones diferentes, especialmente en caderas deformadas en aducción, lateralizadas, con epífisis no protegidas por su acetábulo, el reborde externo del cotilo contribuye biomecánicamente al colapso del núcleo y a su extrusión lateral, origen de deformidades permanentes, no reversibles de la cabeza femoral.
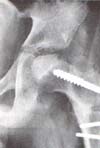 |
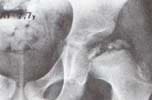 |
| Fig. 3 Perfecta congruencia fémorocotiloidea, lograda por una osteotomía varizante-desrotatoria del fémur impidiendo el colapso de la cabeza y su deformidad ulterior. H. C. 20628. |
Fig. 4 Lateralización del extremo proximal del fémur y extrusión de la parte lateral de la epífisis superior H.C. 21806. |
11. La cabeza y el cuello femoral aumentan su espesor y disminuye en altura; en parte por la persistencia funcional del periostio del cuello y por la lesion del cartílago de crecimiento proximal del fémur.
12. Si el proceso patológico se complica por el desarrollo de una subluxación anterolateral de la cabeza y de la pérdida del movimiento de la cadera (reacción sinovial, contractura de aductores), la cabeza femoral está sujeta a fuerzas excesivas e irregulares que dan lugar a su deformidad. Una vez que la cadera se aplana, aumenta aún más el grado de subluxación.
