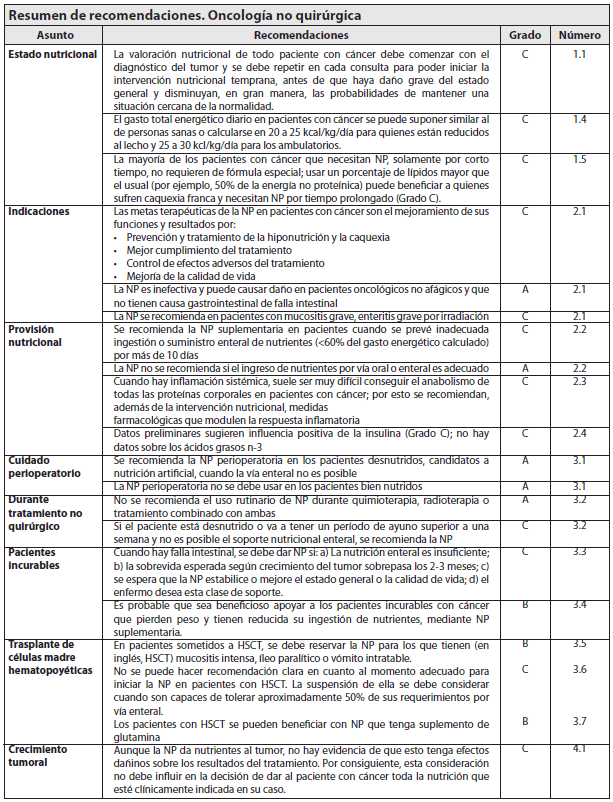
1.1 ¿Qué es la caquexia por cáncer?
Desde el punto de vista clínico, la caquexia por cáncer es un síndrome complejo caracterizado por pérdida de peso crónica, progresiva e involuntaria. Ccon muy escasa o apenas parcial respuesta al soporte nutricional estándar, asociada frecuentemente con anorexia, saciedad temprana y astenia.
Usualmente se puede atribuir a dos componentes principales: disminución en la ingestión de nutrientes (que puede ser debida a lesión gastrointestinal seria por el tumor, o bien a la presencia de citocinas y otros inductores de anorexia similares a ellas). Y alteraciones metabólicas debidas a la activación de procesos sistémicos pro-inflamatorios.
Los desarreglos metabólicos resultantes incluyen resistencia a la insulina, lipolisis aumentada y oxidación de lípidos normal o aumentada, con pérdida de grasa corporal. Aumento en la degradación de proteínas, pérdida de masa muscular y aumento en la producción de proteínas de fase aguda.
La reacción inflamatoria sistémica que se desarrolla ante muchos cánceres es causa importante de pérdida del apetito (anorexia) y de peso.
El síndrome de apetito disminuido, disminución de peso, alteraciones metabólicas y estado inflamatorio. Es conocido como caquexia por cáncer o síndrome canceroso de caquexia y anorexia.
Estas alteraciones metabólicas inducidas por citocinas parecen impedirles a los pacientes caquécticos volver a ganar masa celular corporal cuando reciben soporte nutricional. Lo que se asocia con disminución en la esperanza de vida y no se puede solucionar con solo nutrientes exógenos.
Los intentos de influir en estos cambios metabólicos por otros medios se deben integrar dentro de todo el tratamiento de los pacientes con cáncer.
La valoración nutricional del enfermo con cáncer:
Se debe iniciar tan pronto como se diagnostica el tumor y se debe repetir en cada consulta para poder iniciar la intervención nutricional en forma temprana. Antes de que haya compromiso grave del estado general y las posibilidades de restaurar las condiciones normales sean ya mínimas (Grado C).
Comentarios:
La pérdida de peso y la desnutrición, tanto moderadas como graves, son hechos frecuentes en pacientes con enfermedades malignas. Además, muchos enfermos con tumores muestran elevados marcadores de inflamación(1-4).
La liberación de citocinas, hormonas catabólicas y otros péptidos reguladores que se observa en esos casos. Parecen ser reacciones primarias de los tejidos hospederos del propio paciente con cáncer(1-3).
Además, se ha informado que las sustancias producidas por células tumorales. Como el factor movilizador de lípidos tumorales (LMF, sigla en inglés) y el factor inductor de proteólisis (PIF, en inglés). Agregan señales catabólicas y estimulan aún más la producción de citocinas y la respuesta de fase aguda(5,6).
Se supone que la reacción inflamatoria sistémica está involucrada como causa de pérdida del apetito7 y de peso corporal( 8-11) y puede facilitar la progresión del tumor(12,13).
Las alteraciones metabólicas inducidas por las citocinas también parecen impedirles a los pacientes caquécticos que vuelvan a ganar masa celular corporal. Durante el soporte nutricional(14) y se asocian con disminución en la esperanza de vida(4,6,8,15-17).
Un hallazgo temprano en pacientes con cáncer fue la deficiente tolerancia a la glucosa como consecuencia de resistencia a la insulina(18).
La relación entre insulina y hormonas catabólicas se halla alterada y son frecuentes el aumento en la secreción de cortisol y la disminución en la relación insulina-cortisol(2,19). Como resultado, aumenta la degradación de glucosa y la gluconeogénesis(3).
La pérdida de peso en el cáncer se acompaña con disminución de grasa y aumento de los triglicéridos del plasma.
Oxidación de lípidos
La oxidación de lípidos puede estar normal o aumentada. Aún no está claro qué causa la alteración en el metabolismo de los lípidos(2).
Se observa con frecuencia aumento en la lipolisis(20,21) y también en la oxidación de los lípidos(21-23), aunque esta se puede hallar en los límites superiores de normalidad(24) mientras la oxidación de la glucosa se encuentra interferida.
Estas observaciones pueden servir para apoyar la recomendación de aumentar la relación grasas-hidratos de carbono al alimentar a los pacientes con cáncer.
El medio interno proinflamatorio(5,25) induce proteólisis del músculo esquelético(3,26) que causa pérdida de masa muscular y al mismo tiempo lleva a producción aumentada de proteínas de fase aguda.
El sistema proteolítico proteosómico dependiente de ATP y de ubicuitina se activa en forma muy temprana(27,28).
Como los mecanismos metabólicos y moleculares que llevan al cuadro fenotípico del síndrome anorexiacaquexia parecen estar funcionando tempranamente en la historia natural del crecimiento y desarrollo tumorales. Los oncólogos deberían prestar atención a estos fenómenos como algo que se podría prevenir o al menos demorar mediante intervenciones farmacológicas y nutricionales tempranas (29).
No es fácil diferenciar la caquexia de la desnutrición debida a simple carencia de alimentos: los pacientesdesnutridos. Como los caquécticos, han perdido peso corporal y pueden estar anoréxicos. Sin embargo, los desnutridos tienden a conservar su masa de proteínas, disminuyen el gasto de energía en reposo y responden bastante bien al soporte nutricional siempre que su estado general no esté comprometido de modo irreversible.
(Lea También: Indicaciones y Metas para la NP)
Pacientes caquécticos
Por el contrario, los pacientes caquécticos tienen disminución tanto de la grasa como de la masa muscular (con preservación de la masa proteínica central). No adaptan bien sus requerimientos de energía a la situación de escasez de nutrientes y muestran una respuesta inflamatoria que les impide obtener beneficios sustanciales del soporte nutricional.
A pesar de esto, un tratamiento proactivo puede dar beneficios, como se vio en un estudio de pacientes a las puertas de la caquexia (pérdida de peso entre el 9 y el 10%, pero ingestión de nutrientes superior a 1600 kcal/día). La NP suplementaria administrada en el hogar durante 7 a 8 semanas, cuando la ingestión de nutrientes bajó a 70-80% del nivel esperado, se asoció con aumento significativo de la grasa corporal total, mejoría en el balance de energía y mayor capacidad de ejercicio, todo esto analizado desde el punto de vista del tratamiento administrado(30).
1.2 ¿Influye el cáncer sobre el estado nutricional?
Sí. Con frecuencia la pérdida de peso es el primer síntoma en el paciente con cáncer. Dependiendo del tipo de tumor primario y del período en que se encuentre, la pérdida de peso se ha informado desde 30 hasta más del 80% de los pacientes y es acentuada (en cerca del 15% de ellos la disminución es superior al 10% del peso corporal usual).
Comentarios:
Se ha informado ampliamente que la pérdida de peso, reconocida antes de diagnosticar el tumor, se presenta entre el 31 y el 87% de los pacientes, dependiendo del sitio del tumor primario(31-34).
La disminución acentuada e involuntaria de peso, de más del 10% del peso corporal usual, en los seis meses anteriores al momento del diagnóstico, se ha comprobado en 15% de todos los pacientes(31).
Ochenta y cinco por ciento de los pacientes con cáncer gástrico o pancreático ya han perdido peso cuando se les hace el diagnóstico y en 30% de ellos la pérdida de peso era acentuada(31).
Tanto la frecuencia como la intensidad de la pérdida de peso se correlacionan con el estado evolutivo del tumor(35).
Las terapias anticancerosas se asocian con anorexia, disminución en la ingestión de alimentos o ambas cosas, lo que lleva a nuevas pérdidas de peso si la toxicidad del tratamiento sobrepasa la respuesta del tumor(36,37).
1.3 ¿Interviene el estado nutricional en el curso clínico y el pronóstico?
Sí. Un estado nutricional inadecuado se asocia con disminución en la calidad de vida, menores niveles de actividad, aumento de las reacciones adversas al tratamiento, menor respuesta del tumor al tratamiento y supervivencia disminuida.
Aunque parece probable una relación causa-efecto, esta aún no se ha comprobado firmemente.
Comentarios:
Estudios longitudinales han demostrado que el pronóstico de los pacientes con cáncer que tienen pérdida de peso es peor que en aquellos sin tal pérdida.
Aunque los mayores factores para el pronóstico de supervivencia son el estado en que se halle el tumor y su respuesta a la terapia oncológica, una cantidad importante de publicaciones ha mostrado que la pérdida de peso es una señal importante y a veces independiente de disminución en la sobrevida de pacientes oncológicos no quirúrgicos( 38-46).
La depleción de las proteínas corporales también se asocia con menor supervivencia(47).
Pacientes mal nutridos y con cáncer tienen peor respuesta a la quimioterapia en cuanto a la duración de ella como a la tasa de respuesta(34,48-50).
Además, los pacientes con cáncer y desnutridos tienen mayores tasas de reingresos en el hospital, hospitalizaciones más largas(51), más síntomas molestos(52) y peor calidad de vida(34,53).
En un estudio reciente se encontró que el nitrógeno corporal total es el más fuerte predictor de neutropenia después de quimioterapia en pacientes con cáncer de mama(54).
La nutrición inadecuada, entonces, parece ser un marcador de la gravedad de la enfermedad y de su mal pronóstico.
Entre el 4 y el 23% de los pacientes con cáncer terminal mueren por causa de caquexia(55-58).
1.4 ¿Influye el cáncer en el gasto energético en reposo?
Con frecuencia, sí. De suyo, el cáncer no tiene efectos persistentes en el gasto energético en reposo. Pero el tratamiento oncológico puede influir sobre el gasto de energía.
Para efectos prácticos y a menos que se mida individualmente, se puede suponer que el gasto energético diario en los pacientes con cáncer es similar al de personas sanas, alrededor de 20-25 kcal/día en pacientes reducidos al lecho y 25-30 kcal/día en pacientes ambulatorios (Grado C).
Comentarios:
El gasto energético en reposo (REE, sigla en inglés) puede permanecer sin cambios, aumentar o disminuir en relación con el gasto energético calculado.
Por consiguiente, se debe suponer que los requerimientos energéticos de los pacientes con cáncer son normales, a menos que haya datos específicos que muestren otra cosa.
En cerca del 25% de los pacientes con cáncer activo, el REE medido por el sistema que se considera “estándar de oro”, es decir, la calorimetría indirecta, está más de 10% por encima de lo calculado y en otro 25% se encuentra más de 10% por debajo de dicho cálculo. No es posible predecir, en casos individuales, ni la dirección ni el tamaño de tal error(59,60).
La ya larga experiencia de la Universidad de Gothenburg, Suecia, cerca del 50% de todos los pacientes con cáncer y pérdida de peso se encontraban hipermetabólicos al compararlos con personas de similar actividad física, composición corporal y edad(61). En ellos, la pérdida de peso y el hipermetabolismo no se compensaban con incremento en la ingestión espontánea de alimentos.
Esto hay cierta variabilidad, dependiente de los diversos tipos de tumor: algunos autores han informado REE normales en pacientes con cáncer gástrico o colo-rectal(62,63) y REE superiores a lo esperado en casos de cáncer pancreático o pulmonar( 63-65).
En el caso del cáncer pulmonar, el aumento de REE se relaciona con la presencia de respuesta inflamatoria sistémica(66).
Cuando se considera el gasto energético total (TEE en inglés) que incluye el gasto energético en reposo y también el gasto causado por la actividad física, la cifra está usualmente disminuida en pacientes con cáncer avanzado, en comparación con individuos sanos(64,65), principalmente por la disminución en la actividad física.
Brazalete Sense-Wear
Datos recientes obtenidos mediante un sensor de uso continuo, el brazalete Sense-Wear, indican que la TEE de pacientes leucémicos con peso estable y de enfermos con tumores gastrointestinales que pierden peso, está alrededor de las 24 y 28 kcal/día respectivamente.
En cuanto a los efectos del tratamiento anticanceroso sobre el gasto energético, los datos son escasos y poco consistentes.
Hansell y colaboradores(62) estudiaron 15 pacientes con cáncer colorrectal y no encontraron efectos de la cirugía curativa ni de las metástasis hepáticas sobre la REE. Fredrix y colaboradores(63) compararon la REE de personas sanas con la de 104 pacientes con cáncer gástrico o colorrectal y otros 40 pacientes con cáncer pulmonar no de células pequeñas, antes y hasta un año después de la cirugía. Los pacientes con cáncer gastrointestinal tuvieron REE normal, la cual subió ligeramente después de la cirugía, mientras que los pacientes con cáncer del pulmón tuvieron REE elevada que descendió tras la cirugía curativa, aunque esto no ocurrió en quienes tuvieron recurrencia del tumor.
El tratamiento de quimioterapia en 12 pacientes con cáncer pulmonar de células pequeñas recientemente diagnosticado, redujo tanto los mediadores inflamatorios circulantes como la REE (66).
1.5 ¿Necesitan los pacientes con cáncer un perfil específico de nutrientes?
Probablemente sí. La mayoría de los pacientes con cáncer, ambulatorios u hospitalizados, que necesitan NP durante períodos cortos de tiempo (pacientes quirúrgicos, pacientes que requieren de reposo intestinal por efectos adversos graves de quimioterapia o radioterapia, entre otros) no suelen necesitar fórmula nutricional específica.
Sin embargo, se les debe dar atención especial a los pacientes con caquexia por cáncer franca que necesiten NP por varias semanas. Porque en ellos suele haber anormalidades del metabolismo de los sustratos energéticos.
Las consideraciones fisiopatológicas y clínicas sugieren que es benéfico utilizar una mezcla con porcentaje de lípidos mayor que lo usual (por ejemplo, 50% de la energía no proteínica) (Grado C).
Comentarios:
Desde 1971 se sabe(69) que la grasa se moviliza y se utiliza eficientemente como fuente de energía en los pacientes con cáncer.
Las razones para el uso de emulsiones de grasas en enfermos con cáncer se sustentan en varios estudios muy complejos que han aparecido en las publicaciones internacionales(70,71,73-75) y se apoyan en las premisas siguientes:
Varios autores(70,71,73-75) han informado que hay movilización y oxidación muy eficientes de la grasa endógena en el estado post-absorción. Con cifras entre 0,7 y 1,9 g/ kg/día, lo que corresponde a entre 6,3 y 17 kcal/kg/día (entre 60 y 78% del gasto metabólico en reposo) tanto en pacientes con cáncer y con peso estable como en aquellos que pierden peso.
Después de la administración de emulsiones con triglicéridos de cadena larga (LCT en inglés) o con mezcla de LCT y MCT (triglicéridos de cadena media). El aclaramiento de lípidos estuvo entre 1,4 y 1,2 para controles sanos, 2,3 y 1,6 en pacientes con peso estable y 3,5 o 2,1 en pacientes con pérdida de peso, respectivamente.
La tasa de oxidación (en g/kg) después de infusiones del mismo tipo en pacientes desnutridos y con cáncer se encontró entre 1,3 y 1,6 para LCT y 0,62 para la mezcla LCT/MCT(74).
Es así como algunos investigadores están preocupados por la posible toxicidad de la administración de lípidos por largo tiempo y sugieren limitar esa administración al máximo de 1 g/kg/día.
Es importante señalar que estas recomendaciones se refieren sobre todo a la experiencia con emulsiones de aceite de soya. Pues los datos con mezcla LCT/MCT parecen mejores.
Carpentier y colaboradores(77):
Informaron que 20 pacientes con NP en el hogar recibieron emulsiones con la mezcla durante 3 a 6 meses y mostraron buena tolerancia hepática.
Simoens y colaboradores(78) compararon el aclaramiento de triacilglicerol plasmático al administrar una emulsión de lípidos (5:4:1) elaborada con 50% de MCT, 40% de LCT y 10% de aceite de pescado. Ttomando como control (5:5) una preparación de 50% MCT y 50% LCT. La inclusión del 10% de aceite de pescado en las partículas de la emulsión incrementó el aclaramiento de los triacilgliceroles infundidos (18%, p<0.0001).
La eliminación más rápida de la emulsión 5:4:1 parece estar relacionada con aumento en la absorción de las partículas remanentes y no con mayor rapidez de la lipolisis intravascular.
Además, cada infusión de la emulsión 5:4:1 elevó la concentración de EPA en los fosfolípidos de las células sanguíneas hasta lograr un enriquecimiento siete veces mayor en las plaquetas y más de dos veces mayor en los leucocitos. Tras la cuarta infusión.
En cuanto a los efectos de la infusión de grasas en pacientes con cáncer, los datos de la literatura son escasos.
Shaw y Holdaway79 informaron que la infusión de “Intralipid” (unas 29 kcal/kg/día) era capaz de disminuir significativamente el catabolismo neto de las proteínas en pacientes con tumores de la parte baja del tracto gastrointestinal. Pero no en tumores de la parte alta del mismo.
Una NP con base en glucosa puede causar balance positivo de agua y sodio en pacientes con cáncer(80-82). La insulina, que es una hormona con gran poder antinaturético y antidiurético(83) parece ser el mediador más probable de dicho efecto.
Pacientes con cáncer que necesitan NP
La mayoría de los pacientes con cáncer que necesitan NP por largo tiempo son caquécticos e hipofágicos por causa de obstrucciones intestinales subagudas causadas por la carcinomatosis peritoneal.
Esta condición se asocia frecuentemente con expansión del volumen de agua extracelular. De modo que una administración excesiva de glucosa puede precipitar fácilmente una efusión peritoneal que lleve a suspensión forzosa de la nutrición intravenosa.
Además, la presencia de náuseas o la administración de morfina se asocian con producción excesiva de hormona antidiurética.
Un estudio clínico de pacientes sometidos a trasplante alogénico de médula ósea para tratar procesos malignos hematológicos. Mostró tasas reducidas de enfermedades agudas causadas por incompatibilidad injerto-receptor. Cuando se les administraron regímenes nutricionales parenterales ricos en LCT(84).
En conclusión, el estándar adecuado para pacientes con cáncer parece ser una relación energética de uno a uno entre grasas y glucosa. Pero se deben intentar relaciones más altas cuando efusiones peritoneales o pleurales limiten tal estándar.
Los efectos adversos informados con las emulsiones de LCT se presentan generalmente cuando la tasa de infusión de lípidos es superior a 2,5 g/día (es decir, cerca de 20 a 24 kcal/kg/día)(85). Lo cual es considerablemente superior a lo que aquí se recomienda.
En este momento el suministro óptimo de nitrógeno en pacientes con cáncer no se puede establecer(86). Las recomendaciones oscilan entre un mínimo de aminoácidos de 1 g/kg/día y un promedio de 1,2 a 2 g/kg/día(87,88).