Diagnóstico diferencial de nódulos pulmonares
Fue atendida en el servicio de urgencias de la Clínica del Country una mujer de 69 años, natural de Gachetá (Cundinamarca), residente y procedente de Bogotá, dedicada al hogar, presentando síntomas agudos de fiebre hasta 39ºC, tos, expectoración purulenta, disnea progresiva, dolor retroesternal de leve intensidad y constante, malestar general, astenia, adinamia.
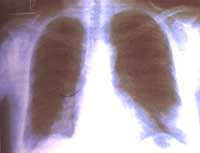
Había consultado doce días antes a otra institución donde le habían tomado radiografía de tórax (Figura 1) y le formularon tratamiento ambulatorio con Amoxicilina 500mg c/8h sin presentar mejoría de los síntomas. Refería además, debilidad y disestesias de miembros inferiores de unos cinco años de evolución, así como diaforesis profusa nocturna.
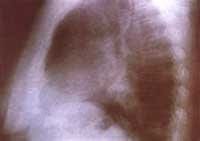
Figura No 1. Rx tórax proyección P-A inicial, Imágenes nodulares bibasales,
la del lado izquierdo, subpleural, con broncograma aéreo.
Antecedentes caso paciente con nódulos pulmonares
Diabetes Mellitus Tipo 2 controlada con Metformin 850mg/d. Púrpura Trombocitopénica Idiopática dianosticada ocho años atrás por Hematología, en tratamiento crónico con Danazol 300mg c/8h y Prednisona 5mg/d desde su diagnóstico.
Hipercolesterolemia importante, manejada de manera irregular con atorvastatina 20mg/d. Gastrectomía subtotal cinco años antes cuya causa no logró especificar la paciente. Laboró durante unos 12 años en fábrica de pinturas.
Al examen físico de ingreso en urgencias se encontró paciente en regulares condiciones, febril, taquicárdica, taquipnéica con signos de dificultad respiratoria, signos clínicos de consolidación localizada en base derecha región paravertebral y equimosis en piernas y brazos, sin fragilidad capilar ni esplenomegalia. (Ver: Neumonitis de Hipersensibilidad NH)
Cuadro hemático
Leucocitos: 15.900, N:76%, L:23%, Promielocitos:1%. Recuento eritrocitario 3 millones/mm3;l, Hto: 30.1%, Hb: 15.9 g/dl, VCM: 100.5 Fl, RDW: 14.2%, MCHC: 52.7 g/dl. Recuento manual de plaquetas: 138.000/mm3. Pruebas de coagulación normales. Glicemia: 310 mg/dl.
BK, KOH de esputo negativos. Gram de esputo no representativo. Cultivo de esputo con escaso crecimiento de Cándida albicans.
La radiografía de tórax (Figura 2) tomada en urgencias fue muy similar a la anterior.
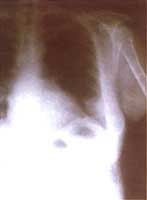
Figura No 2. Rx tórax proyección lateral inicial.
Bajo el diagnóstico clínico de Neumonía Adquirida en la Comunidad multilobar en paciente inmuno-comprometida se inició tratamiento intrahospitalario con Clindamicina, Ciprofloxacina, obteniéndose una respuesta clínica favorable por lo que se dio de alta a los ocho días de tratamiento. Debido a la persistencia de la imagen radiológica (Figura 3) aún finalizado el tratamiento, se tomó TAC de tórax (Figuras 4A y B).

Figura No 3. Rx tórax posterior al tratamiento antibiótico.
 |
 |
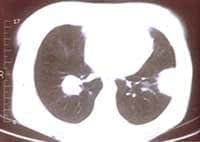
Figuras 4A y B: TAC tórax: a nivel del segmento lateral basal del LII una opacidad redondeada de 4mm de diámetro mayor, de base pleural, con broncograma aéreo y cuatro imágenes nodulares en LID no calcificadas, sin broncograma aéreo.
Para el momento, una vez resuelto el cuadro infeccioso agudo:
Se consideraron como alternativas diagnósticas una enfermedad metastásica pulmonar o la coexistencia de germen oportunista en paciente con estado inmunitario comprometido, razón por la cual se decidió llevar a fibrobroncoscopia óptica encontrándose dos masas localizadas en los bronquios basal posterior y lateral del LID redondas, de aspecto hipervascularizado, que obstruían el 80% de la luz bronquial. Se practicó lavado bronquial que reportó células inflamatorias sin cambios de malignidad.
La biopsia de las masas reportó mucosa respiratoria con fibrosis, inflamación crónica, grupos de células con abundantes plasmocitos de características normales, sugiriéndose el diagnóstico de plasmocitoma. Las coloraciones especiales en búsqueda de germen oportunista fueron negativas.
Se realizó además endoscopia de vías digestivas altas con biopsia de la mucosa gástrica y colon por enema descartándose patología del tracto gastrointestinal.
Proteinemia total: 7.3, Albúmina: 3.7, Globulina: 3.6, inmunoelectroforesis de proteínas con pico monoclonal en la región alfa 2, Proteína de Bence Jones negativa, radiografías de cráneo, columna lumbosacra y caderas dentro de lo normal.
La paciente fue valorada por Hematología considerándose necesario practicar estudio inmuno-histoquímico en las biopsias de las masas endobronquiales (Figura 5), además, practican aspirado y biopsia de médula ósea que informa infiltrado linfoplasmocítico que resalta con el CD79a, con células IgM positivas, predominio de cadenas ligeras lambda e índice de proliferación bajo (5% con el marcador Ki-67) con lo que se concluye el diagnóstico de linfoma linfoplasmocítico B (Macroglobulinemia de Waldenström) (Figuras 6A y B).
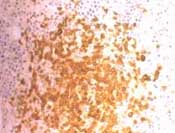
Figura No 5. Biopsia transbronquial con infiltrado linfoplas-mocítico. HE 10X y 40X.
 |
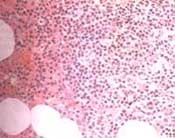 |
Figuras No. 6A y 6B: Biopsia de médula ósea con infiltrado linfoplasmocítico
monoclonal que resalta con el CD79A. HE 20X y CD79A 20X.
Recientemente The New England Journal of Medicine1 publicó un caso interesante de diagnóstico diferencial de nódulos pulmonares en una mujer con historia de artritis reumatoidea.
Seis años antes se le había resecado un nódulo reumatoideo del tendón de Aquiles.
Tres y medio años antes recibía broncodilatador y corticosteroide en aerosol. Presentaba tos, expectoración mucoide y dolor torácico, sin hallazgos anormales al examen físico. Como antecedentes de importancia, tabaquismo de 20 paq/año y aparición de moho en las paredes de su casa.
En la radiografía de tórax se evidenciaron dos nódulos en LSD que no estaban presentes en estudios previos, en el TAC de tórax se encontró que los nódulos eran de localización subpleural y que había otro más en LSI, con zonas de atrapamiento aéreo en las bases.
En el diagnóstico diferencial realizado por los participantes en este caso, teniendo en cuenta el antecedente conocido de Artritis reumatoidea, fueron consideradas las siguientes posibilidades:
1. Infecciones (excluyendo micobacterias): Nocardia, Criptococo, Aspergillus, Histoplasma, Coccidioides.
2. Infección por micobacterias: Complejo Myco-bacterium avium.
3. Neoplasias: Cáncer pulmonar en especial del tipo de carcinoma bronquioloalveolar, pero la localización subpleural es infrecuente. Mieloma múltiple y linfoma probablemente por estimulación crónica de células B en la A.R., al igual que en el presente caso. Enfermedad metastásica pulmonar. Plasmocitoma extra óseo.
4. Enfermedades inmunológicas: Nódulos reuma-toideos.
5. Enfermedades metabólicas: amiloidosis que puede coexistir con A.R.Nuestro caso, aunque bastante similar, puede ser enfocado dentro del contexto de masas pulmonares con broncograma aéreo, en cuyo caso podríamos considerar dentro de las posibilidades diagnósticas:
- Carcinoma bronquioloalveolar
- Linfoma
- Tumor pseudoinflamatorio
- Neumonía redonda
El compromiso pulmonar durante la evolución del mieloma múltiple no es infrecuente, pero la presencia de plasmocitoma primario de pulmón, en la mayoría de los casos, como antecesor del mieloma múltiple, sí lo es.
El plasmocitoma pulmonar puede presentarse como nódulo o masa lobulada intraparenquimatosa, endobronquial o endotraqueal, compuesta por una población única de células plasmáticas con diferentes grados de atipia.
Puede haber tejido amiloide o depósito de inmuno-globulinas alrededor de los vasos o dentro del tumor. La utilidad del estudio con inmunohistoquímica es la diferenciación del granuloma de células plasmáticas o pseudotumor inflamatorio de procesos malignos al determinar la monoclonalidad en la muestra.
La Macroglobulinemia de Waldeström (MW) es un linfoma linfoplasmocítico de bajo grado:
Tiene una incidencia de 2.5/millones/año4. La edad media de diagnóstico es a los 63 años. Las manifestaciones clínicas son: hepatomegalia (20%), esplenomegalia (15%), y linfadenopatía (15%). El síntoma más común es la fatiga relacionado con la anemia normocrómica, normocítica, el valor medio de la hemoglobina al momento del diagnóstico es 10 g/dl.
Todos los pacientes tienen niveles circulantes de un marcador tumoral, la proteína monoclonal IgM. Ocasionalmente niveles elevados de proteína IgM monoclonal pueden producir un síndrome de hiperviscosidad manifestado con sangrado oronasal y en menor frecuencia hemorragia retiniana.
También complicaciones neurológicas como somnolencia y coma. Los factores pronóstico más importantes son la hemoglobina, edad, pérdida de peso y presencia de crioglobulinas. La sobrevida media en pacientes sintomáticos es de 65 meses. Pacientes asintomáticos no deben ser tratados5.
La definición de MW se hace con los siguientes criterios: gamapatía monoclonal IgM, infiltración de la médula ósea por linfocitos pequeños, células plasmocitoides y plasmáticas en patrones difuso, intersticial o nodular; inmunoglobulina de superficie positiva, e inmunofenotipo CD19+, CD20+, CD5-, CD10-, CD23-. El compromiso pulmonar en la MW ocurre en 3-5% de los casos6.
|
CARACTERÍSTICAS DE MW DIFERENCIALES DEL MIELOMA |
CARACTERÍSTICAS DE MW PARECIDAS AL MIELOMA |
| Presencia de compromiso de médula ósea y riñón | Presencia de linfadenopatías, esplenomegalia, síndrome de Hiperviscosidad |
| Presencia de componente M sérico mayor a 3gr% | Ausencia de lesiones osteoliticas e hipercalcemia |
| Síntomas: Debilidad, fatiga, infecciones recidivantes | Síntomas: Epistaxis, trastornos visuales, neuropatía periférica, vértigo, cefalea, paresia transitoria |
| Anemia normocitica, normocrómica | Fenómeno de Rouleaux, prueba de Coombs positiva |
| Igual esquema de tratamiento | Mayor respuesta a quimioterapia con mayor sobrevida |
Bibliografia
White D.A, Mark E.J. Case records of the Massachusetts General Hospital. A 53-YearOld Woman with Arthritis and Pulmonary Nodules. Scully RE, Mark EJ, McNeely WF, et al. N Engl J Med 2001; 344, 997 – 1004.
Fishman A.P. Fishman’s Pulmonary Diseases and Disorders. Trird edition 1998. 1939, 1875.
Giraldo H. Decaimiento e infiltrado pulmonar. Rev Colom Neumol 2001; 13: 139-141.
Gertz MA, Fonseca R, Rajkumar SV. Waldenström’s macroglobulinemia. Oncologist 2000;5(1):63-7.
Kyrtsonis MC, Angelopoulou MK, Kontopidou FN, Siakantaris MP, Dimopoulou MN, Mitropoulos F, Kalovidouris A, Vaiopoulos GA, Pangalis GA. Primary lung involvement in Waldenström’s macroglobulinaemia: report of two cases and review of the literature. Acta Haematol 2001;105(2):92-6.
Owen RG, Barrans SL, Richards SJ, O’Connor SJ, Child JA, Parapia LA, Morgan GJ, Jack AS. Waldenström macroglobulinemia. Development of diagnostic criteria and identification of prognostic factors. Am J Clin Pathol 2001 Sep;116(3):420-8
Autor
* Natalia Londoño M.D. Internista Neumóloga Clínica del Country.
**Mario Gómez M.D. Internista Hematólogo Clínica del Country.
*** Santiago López M.D. Internista Infectólogo Clínica del Country.
**** Carlos Saavedra M.D. , Diana Palacios M.D. Patólogos Fundación Santa Fe de Bogotá. Profesora – Asistente Universidad Nacional de Colombia.