Adenomatous hyperplasia atypical of the lung
Resumen
Paciente hombre de 74 años con un cuadro de dos meses de tos seca. Antecedentes de tabaquismo de 18 paquetes año. Radiografía de tórax con confirmación de tomografía revelan imagen nodular de contornos irregulares en segmento basal del lóbulo interior izquierdo, resultado histopatológico hiperplasia adenomatosa atípica del pulmón. (Lea también: Biopsia quirúrgica en enfermedad infiltrativa difusa del pulmón. Experiencia institucional)
Abstract
Patient, man of 74 years old with two months-dry cough. Smoking antecedents of 18 packages per year. Thorax radiography with a tomography confirmation reveals nodular image with irregular contours in the basal segment of the left bottom lobule. Hystopathologic result Adenomatous Hyperplasia Atypical of the lung.
Aura Lucía Rivera B., MD*; Jorge Alberto Carrillo B., MD**; Paulina Ojeda L. , MD***
*Médica Radióloga. Hospital Santa Clara. Universidad El Bosque.
**Médico Radiólogo. Hospital Santa Clara. Universidad Nacional de Colombia.
***Médica Patóloga. Hospital Santa Clara. Universidad El Bosque.
Introducción
Al igual que la progresión que se ha determinado en la génesis del carcinoma escamocelular del pulmón, donde el continuo metaplasia, displasia de bajo grado, displasia de alto grado, carcinoma in situ y finalmente carcinoma infiltrante está bien delineado.
Se han considerado algunas aproximaciones para establecer la sucesión de eventos en el adenocarcinoma, las cuales han dado como resultado la categorización de algunas lesiones precursoras de dicha neoplasia (1).
Es así como los diversos cambios que se suceden genotípicamente a nivel molecular se ven representados fenotípicamente en la sucesión de lesiones pulmonares tales como hiperplasia adenomatosa, hiperplasia adenomatosa atípica y adenocarcinoma.
Sin embargo, para el patólogo la diferenciación histológica de estas lesiones es difícil, por lo cual el uso de marcadores de inmunohistoquímica ha cobrado valor (4).
El siguiente artículo revisa la aplicación de tal herramienta en un caso de Hiperplasia Adenomatosa Atípica (HAA) diagnosticada en el Hospital Universitario de San Ignacio de Bogotá.
Presentación del caso
Se trata de un hombre de 74 años que consultó por cuadro de dos meses de evolución de tos seca, no asociada a disnea ni otra sintomatología. Dentro de los antecedentes personales de importancia refería tabaquismo de 18 paquetes/año. Al examen físico no se encontraron hallazgos positivos y se solicitó radiografía simple de tórax.
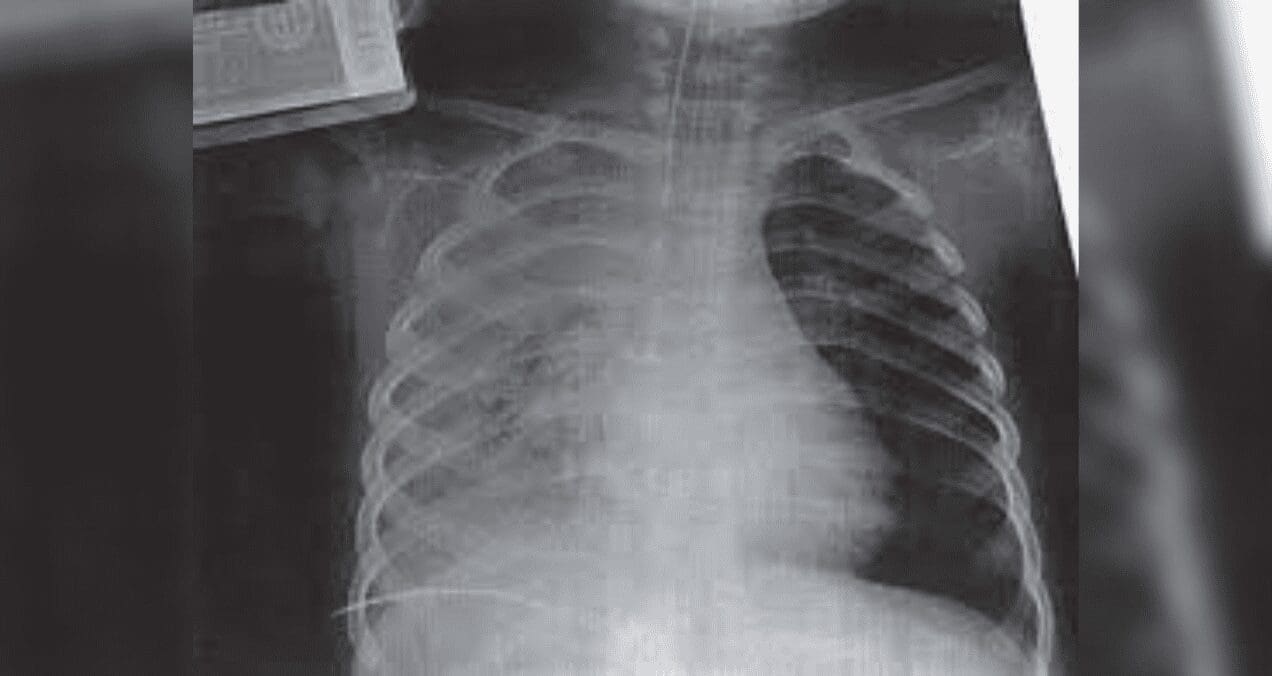
La radiografía de tórax muestran una silueta cardiomediastínica de tamaño y configuración normal, ateromatosis calcificacada del cayado aórtico, discretos trazos lineales fibrosos en ápice pulmonar izquierdo y granuloma calcificado de un centímetro de diámetro en el segmento basal posterior del lóbulo inferior izquierdo. Con estos hallazgos se realizó escanografía de tórax.
La TAC de tórax mostró en el segmento apical posterior del lóbulo superior izquierdo un nódulo de 20 mm de diámetro mayor, de contornos irregulares, marcadamente espiculado y con halo de opacidad en vidrio esmerilado periférico y sin calcificaciones internas.
En el segmento inferior de la língula se encontró nódulo densamente calcificado de cinco mm de diámetro mayor. Además adenopatías calcificadas en las estaciones paratraqueal derecha, subcarinal y en la ventana aorto-pulmonar.
Debido a la naturaleza probablemente neoplásica de la lesión, el paciente se llevó a toracotomía para resección de la lesión.
Durante el acto quirúrgico se realizó consulta intraoperatoria a patología. Para estudio por congelación se recibió una cuña de tejido pulmonar (6.5 x 5.5 x 1cm) la cual macroscópicamente presentaba una zona (2 x 2 x 1.1cm) indurada, mal definida, gris pálida con múltiples áreas puntifomes más oscuras en la porción central. El resto del parénquima pulmonar era de aspecto y consistencia usuales.
Biopsia por congelación
En la biopsia por congelación se encontró la presencia de un denso infiltrado inflamatorio de predominio intersticial con evidentes cambios citopáticos de los neumocitos que no podían definirse con total certeza como de naturaleza reactiva o neoplásica. Estos hallazgos obligaron a diferir el diagnóstico definitivo. Ante esta situación los cirujanos de tórax decidieron realizar una lobectomía.
En los controles de congelación y en las muestras complementarias procesadas en forma convencional, los hallazgos histológicos mostraron parénquima pulmonar con ensanchamiento del espacio intersticial dado por fibrosis e infiltrado inflamatorio mononuclear con distribución en parches y diferentes grados de severidad, además con un franco patrón de heterogeneidad temporal, estos hallazgos correspondían morfológicamente con una Neumonía Intersticial de Tipo Usual (NIU).
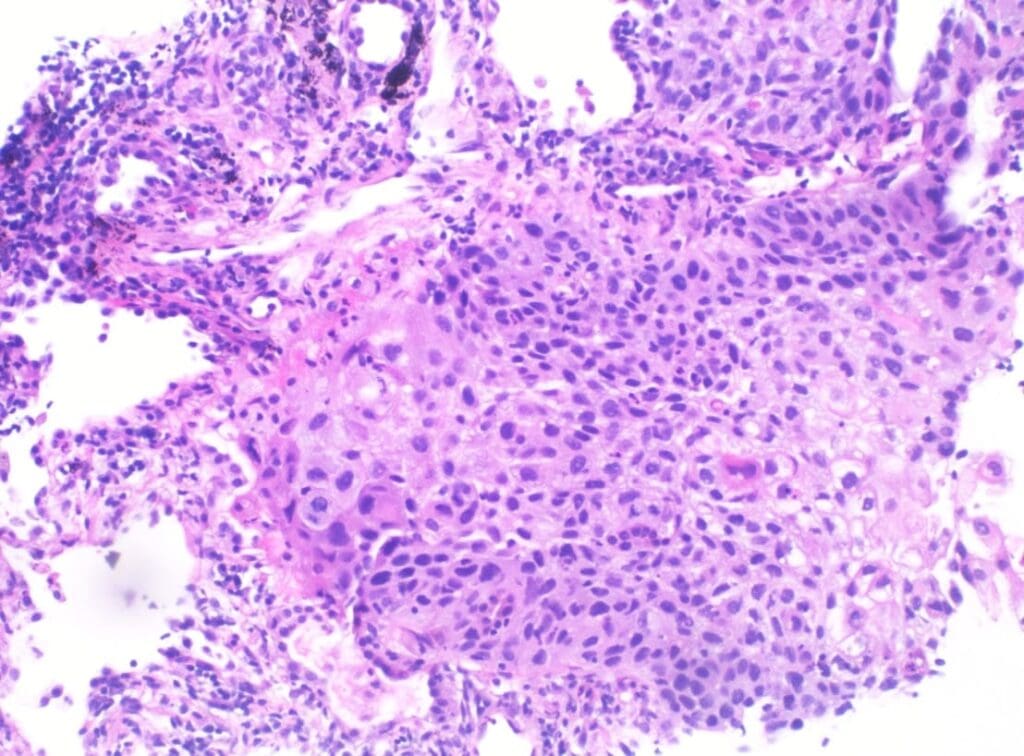
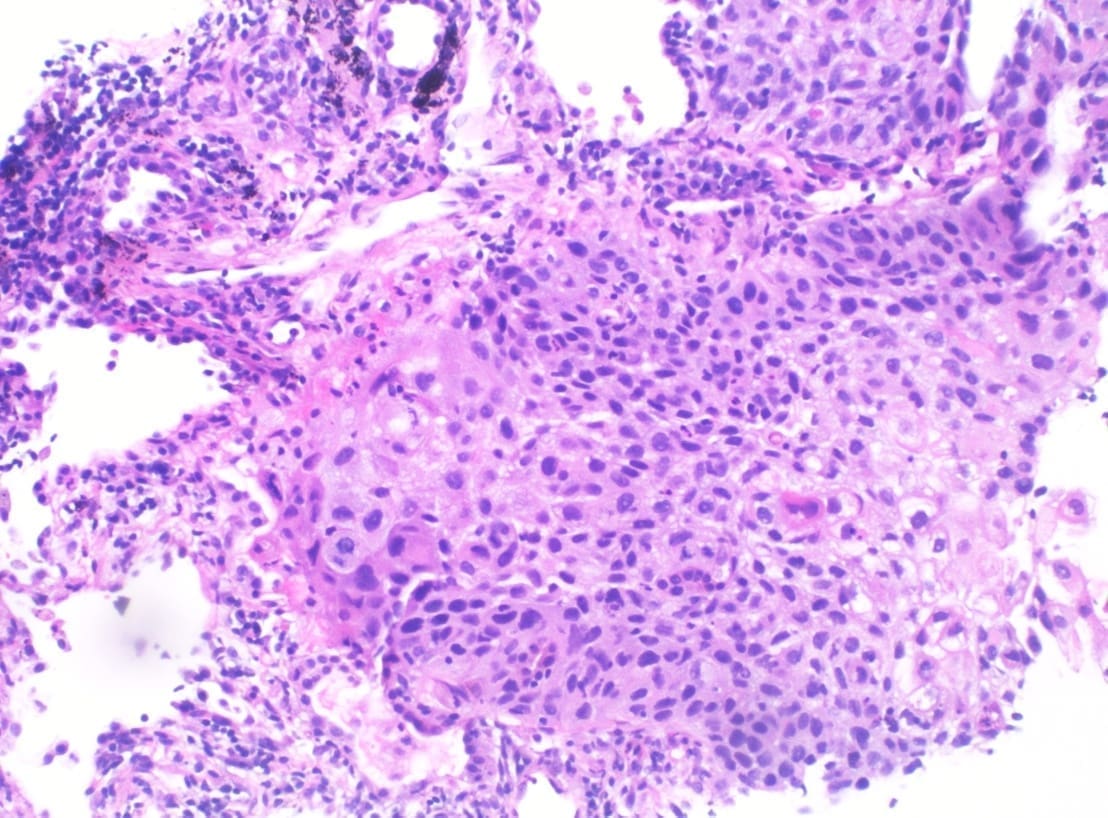
De manera focal, y en relación con el área macroscópicamente sospechosa, el epitelio de revestimiento alveolar mostró cambios citológicos dados por una pérdida de la relación núcleo-citoplasma, pleomorfismo nuclear, hipercromasia, núcleos grandes que protruían al espacio alveolar con cromatina homogénea basofílica y citoplasma eosinofílico y bordes celulares mal definidos, además mitosis ocasionales. No se identificaron áreas de infiltración neoplásica ni distorsión de la arquitectura pulmonar normal (Figuras 1 y 2).


Figuras 1 y 2. En 1 (H&E – 100x), se identifican espacios alveolares con intersticio ensanchado y escaso infiltrado mononuclear linfocitario.
En 2 (H&E – 400x), se identifican estos mismos espacios revestidos por células atípicas, grandes con núcleos hipercromáticos ovoides proyectados a la luz.
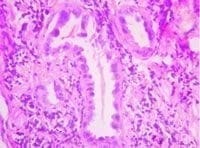
Estos hallazgos se interpretaron como hiperplasia adenomatosa atípica. Para corroborar el diagnóstico, se realizó estudio de inmunohistoquímica con Antígeno Carcino-Embrionario (CEA) el cual mostró reactividad citoplasmática y nuclear en los neumocitos en forma focal y discontinua, siendo de mayor intensidad en aquella células con mayor atipicidad. La marcación fue negativa en los neumocitos de otras zonas alveolares donde no había el cambio adenomatoso atípico (Figuras 3 y 4).


Figuras 3 y 4. En 4 (100x – ACE), la marcación con antígeno carcinoembrionario presenta una positividad en mosaico en las células epiteliales del alvéolo. En 3 (400x – ACE), una aproximación nos muestra una positividad más intensa en las células con mayor atipicidad citológica.
El paciente se recuperó satisfactoriamente y fue dado de alta. Se valoró ambulatoriamente con evolución favorable.
Lea También: Hiperinsuflación Lobar Congénita
Discusión
La hiperplasia adenomatosa atípica es actualmente catalogada como la lesión precursora en la secuencia adenoma – adenocarcinoma del pulmón. Los primeros estudios en encontrar dicha relación correponden a Shimosato y colaboradores en Japón en 1982 y Roberta Miller en Vancouver en 1988 (1).
Años atrás, Friedrich había planteado el concepto de “tumor cicatrizal” según el cual, de una cicatriz fibrosa pulmonar derivaba usualmente un adenocarcinoma pulmonar (2). Hoy en día, éste concepto está reevaluado y se cree que la “cicatriz fibrosa” es realmente un proceso desmoplásico generado posterior a la aparición del adenocarcinoma.
Por tanto, se plantea que algunos eventos que tienen su base en alteraciones moleculares dan origen al adenocarcinoma (3). Debido a la naturaleza secuencial de estos eventos, herramientas tales como los marcadores de inmunohistoquímica son valiosos en la aproximación diagnóstica de estas lesiones (4).
La hiperplasia adenomatosa atípica es reconocida como la lesión precursora del adenocarcinoma y muchas veces acompaña a la neoplasia plenamente desarrollada. Corresponde a lesiones mal definidas, algunas veces microscópicas, otras -cuando adquieren gran tamaño- evidentes a simple vista. Usualmente no mayores de 19 milímetros (1-2).
Histológicamente, es una proliferación de los neumocitos que revisten los espacios alveolares, sin inflamación del estroma acompañante, hallazgo que le diferencia de los cambios reactivos inflamatorios (1-2-12). Tales células se tornan hiperplásicas (con pérdida de la relación núcleo-citoplasma), cuboides, de núcleo grande basófilo proyectado hacia la luz, adquiriendo grados variables de atipia citológica sin alcanzar la severidad de los encontrados en el adenocarcinoma.
Es particularmente importante precisar que esta lesión no altera la arquitectura pulmonar, por tanto no es infiltrante, este hallazgo es fundamental en el diagnóstico diferencial con el adenocarcinoma bronquioloalveolar, el cual suele ser difícil de establecer (7-8).
Molecularmente
Se considera que hay pérdida inicial de la inhibición del oncogén k-RAS, prácticamente en todas las lesiones (5); pérdida de la heterocigocidad de los cromosomas 3p, 9p y 17p en aquellas lesiones con atipia de moderada a severa (6) y acumulación de la proteína p53, la cual se ve hasta en la mitad de las lesiones severas (5).
Otros factores que se cree son indispensables para la progresión hacia grados severos de atipia y adenocarcinoma son la inhibición de genes claves tales como el gen supresor de tumores p16 y el FHIT.
La inactivación del gen p53 y la activación de la telomerasa producen el cambio de la lesión premaligna a la maligna (2). Mucho del avance en el delineamiento de este tipo de lesiones se da a nivel molecular, pues histológicamente diferenciarlas puede llegar a ser muy difícil (2).
El empleo de la inmunohistoquímica es entonces una herramienta valiosa, pues algunos marcadores traducen morfológicamente lo que sucede molecularmente. Varios estudios han planteado el uso de antígeno carcinoembrionario en este tipo de lesión, algo similar a lo que se hace en adenocarcionomas colo-rectales o pancreáticos (2-4).
La marcación para Antígeno Carcino Embrionario (ACE) se modifica según estemos frente a un caso de hiperplasia adenomatosa, uno de hiperplasia adenomatosa atípica o incluso uno de adenocarcinoma.
Es negativa en presencia de hiperplasia adenomatosa, células claras y neumocitos tipo dos normales, y positiva en la hiperplasia adenomatosa atípica y adenocarcinoma, su marcación es de intensidad variable de acuerdo al grado de atipia celular.
Su expresión evidencia la pérdida de la polaridad del epitelio glandular, la alteración del transporte celular y de la secreción. La marcación con ACE se presenta hasta en el 80% de los adenocarcinomas y el 60% de las hiperplasias adenomatosas atípicas (4).
Se han empleado también:
Las citoqueratinas y la laminina para identificar la invasión del adenocarcinoma bronquioloalveolar, al existir disrupción de la membrana basal resaltada con laminina por las células tumorales positivas para citoqueratinas (11).
Hay pérdida de los grupos sanguíneos A, B y H en las membranas de las células tumorales malignas (10). El Leu-M1 y B72.3 son positivos en adenocarcinoma, mientras en la hiperplasia adenomatosa atípica son de expresión limitada (9).
En el presente caso, la marcación con ACE fue útil, pues ayudó a corroborar la presencia de una lesión tipo hiperplasia adenomatosa atípica del pulmón gracias a su marcación positiva en un patrón de mosaico, diferenciándola con claridad de un proceso reactivo o de una hiperplasia adenomatosa convencional.
Bibliografía
1. Kerr, K., Pulmonary preinvasive neoplasia. J. Clin. Pathol. 2001; 54: 257-271.
2. Westra, W., Early glandular neoplasia of the lung. Respir Res 2000, 1: 163–169.
3. Mori, M. et al, Atypical Adenomatous Hyperplasia of the Lung: A Probable Forerunner in the Development of Adenocarcinoma of the Lung. Mod Pathol 2001;14: 72–84.
4. Mori M., et al. Atypical adenomatous hyperplasia and adenocarcinoma of the human lung. Their heterology in form and analogy in immunohistochemical characteristics. Cancer 1996; 77: 665–74.
5. Slebos R. et al. p53 alterations in atypical alveolar hyperplasia of the human lung. Hum Pathol 1998, 29:801–808.
6. Kitaguchi S. et al. Proliferative activity, p53 expression and loss of heterozygosity on 3p, 9p and 17p in atypical adenomatous hyperplasia of the lung. Hiroshima J Med Sci 1998, 47: 17–25.
7. Kitamura H. et al. Atypical adenomatous hyperplasia and bronchoalveolar lung carcinoma. Analysis by morphometry and the expressions of p53 and carcinoembryonic antigen. Am J Surg Pathol 1996, 20: 553–562.
8. Shimosato Y. et al. Adenocarcinoma of the lung: its development and malignant progression. Lung Cancer 1993; 9: 99 –108.
9. Rao S, fraire A. Alveolar cell hyperplasia in association with adenocarcinoma of lung. Mod Pathol 1995; 8: 165–9.
10. Nakanishi K. Alveolar epithelial hyperplasia and adenocarcinoma of the lung. Arch Pathol Lab Med 1990; 114: 363–8.
11. Gollowitsch F. et al. Atypical pneumocyte hyperplasia a probable precursor lesion of bronchioloalveolar adenocarcinoma of the lung. Eur Respir J 1994; 7: 135S.
12. Nicholson A., Classification of idiopathic interstitial pneumonias: making sense of the alphabet soup. Histopathology 2002; 41: 381–391.