Aging of the respiratory system
Resumen
El envejecimiento fisiológico de los pulmones está asociado con dilatación de los alvéolos, aumento en el tamaño de los espacios aéreos, disminución de la superficie del intercambio gaseoso y pérdida del tejido de sostén de las vías aéreas.
Estos cambios producen una disminución en el retroceso elástico del pulmón, con incremento en el volumen y capacidad residual funcional. La distensibilidad de la caja torácica disminuye lo que incrementa el trabajo respiratorio cuando se compara con personas jóvenes.
Con la edad la fuerza de los músculos respiratorios también se disminuye, lo cual se ha asociado con el estado nutricional y la función cardíaca. Los flujos respiratorios disminuyen alterando de forma característica las curvas de flujo-volumen sugiriendo enfermedad de pequeñas vías.
DLCO
La DLCO se disminuye con la edad lo que es debido a alteraciones en los componentes de la membrana alveolo-capilar y de la superficie del área alveolar. A pesar de estos cambios el sistema respiratorio, conserva su capacidad de mantener un adecuado intercambio gaseoso en reposo y ejercicio durante el transcurso de la vida, sólo con una leve disminución de la PaO2 y sin un cambio significativo de la PaCO2.
El envejecimiento disminuye la reserva respiratoria durante estados de enfermedad aguda. La disminución en la sensibilidad de los centros respiratorios a la hipoxia o hipercapnia altera la respuesta ventilatoria en casos de falla cardíaca descompensada, infección o exacerbación de EPOC. (Ver también: Hiperinsuflación lobar congénita)
Palabras clave: envejecimiento, sistema respiratorio.
José Mauricio Ocampo, MD*, Carlos Darío Aguilar, MD**, José Fernando Gómez, MD***
*Médico Especialista en Medicina Familiar. Residente de Geriatría Clínica.
Programa de Investigaciones en Gerontología y Geriatría. Universidad de Caldas. Manizales.
**Médico Neumólogo. Docente. Universidad de Caldas. Manizales.
*** Médico Internista y Geriatra. Coordinador. Programa de Investigaciones en Gerontología y Geriatría. Universidad de Caldas. Manizales.
Corrección de texto: Claudia Liliana Agudelo. Lingüista. Universidad de Caldas.
Correspondencia: Dr. José Mauricio Ocampo. Especialista en Medicina Familiar,
Residente Geriatría Clínica. Programa de Investigaciones en Gerontología y Geriatría.
Facultad de Ciencias para la Salud. Universidad de Caldas. Manizales (Colombia). E-mail: jmocampo2000@yahoo.com.ar
Abstract
Physiologic aging of lungs is associated with alveoli dilatation, increasing size of aerial spaces, reduction of surface for gaseous exchange and loss of airways supportive connective tissue. These changes entail a decrease of the lung elastic backward with increasing of volume and functional residual capacity.
Diminished distensibility of chest increases respiratory work when compared with youngers. With age, respiratory muscle force also decreases and it has been linked to nutritional status and cardiac function. Respiratory flows shrink, altering characteristically the flow-volume curves charts, suggesting small airways disease.
DLCO decreases with age due to alteration of the alveolus-capillary membrane and alveolar surface area. In spite of these changes, respiratory system keeps its capacity to sustain a proper gaseous exchange during rest or exercise through a lifetime with just a slight decrease of the PaO2 and without a significant change in the PaCO2.
Aging diminish respiratory reserve during acute disease. Lowering of sensitivity of respiratory centers to hypoxia or hypercapnia alters the ventilatory response in cases of decompensate cardiac failure, infection, or chronic obstructive pulmonary disease exacerbation.
Key words: aging, respiratory system.
Introducción
La mayoría del personal de salud está familiarizado con las enfermedades más comunes y prevalentes que se presentan en la población geriátrica, pero pocos son conocedores de los cambios fisiológicos normales asociados con el envejecimiento, los cuales pueden determinar la presencia o ausencia de síntomas, el nivel de funcionamiento y el resultado de exámenes diagnósticos aparentemente anormales (1).
El aparato respiratorio se encuentra expuesto de forma constante a contaminantes y agresores del medio ambiente; a pesar de la función de barrera que ejerce la vía aérea superior, hay una alta predisposición a presentar patologías transmisibles y ocupacionales.
Debido a lo anterior, un sistema que está expuesto por seis o más décadas a un gran número de contaminantes y tóxicos ambientales, puede presentar grandes cambios a nivel estructural y funcional que hacen difícil la diferenciación entre envejecimiento pulmonar normal y patológico (2).
Igual en ausencia de enfermedad, el grupo de ancianos es una población más heterogénea que la del grupo de jóvenes, como lo describió Bernard Isaacs: “Lo único que se incrementa con el envejecimiento es la variabilidad” (3), lo que contribuye a que sea difícil establecer un límite entre lo normal y lo patológico en la edad avanzada.
Estudios anatómicos para entender el envejecimiento pulmonar
La mayoría del conocimiento que existe a nivel del envejecimiento pulmonar proviene de estudios anatómicos realizados entre los años 1950 a 1960. Sin embargo, una mejor comprensión de este proceso reviste gran importancia en la medida que permitirá una mayor interpretación y comprensión del impacto de enfermedades que se presentan con mayor frecuencia en este grupo de población como son las infecciones del tracto respiratorio y la enfermedad pulmonar obstructiva crónica (EPOC) (4).
La razón principal para definir los cambios normales del sistema respiratorio asociados con el envejecimiento, aquellos que se presentan después del desarrollo normal en ausencia de una enfermedad establecida o exposición a tóxicos, es la interpretación adecuada de síntomas, signos y estudios diagnósticos en ancianos para evitar intentos inapropiados de medicalizar fenómenos normales (5,6).
Las principales características del envejecimiento del sistema respiratorio reflejan cambios anatómicos y estructurales a nivel de: el retroceso elástico pulmonar, la distensibilidad de la pared torácica y la fuerza de los músculos respiratorios (7).
Muchos de los cambios funcionales asociados con la edad están relacionados con estos tres fenómenos. La presente revisión describe los cambios relacionados con el envejecimiento a nivel estructural y funcional del sistema respiratorio, sus posibles factores etiológicos, efectos a nivel de la mecánica respiratoria y del intercambio de gases y sus consecuencias a nivel clínico.
Cambios a nivel estructural
Celular
A nivel celular no se ha encontrado evidencia que demuestre cambios en el número o función de los neumocitos tipo II, como tampoco en la cantidad o calidad del surfactante que producen (8).
Aunque sí se han documentado cambios en la población de células y componentes del líquido del lavado broncoalveolar (LBA).
En el estudio observacional realizado por Thompson et al. llevado a cabo en personas con espirometría normal, se encontraron diferencias relacionadas con la edad en las células del LBA, que reflejan cambios en el revestimiento epitelial de los pulmones.
El grupo de ancianos (promedio edad: 74 años y rango 70-80 años) tuvo un porcentaje mayor de neutrófilos (40% vs. 10%, p<0.005) y bajo porcentaje de macrófagos (32% vs. 67%, p<0.0001) al comparar con el grupo de personas jóvenes (promedio edad: 27 años y rango 19-34 años) (9).
La significancia a nivel clínico de estas diferencias en la población celular a nivel pulmonar podría explicar el alto riesgo que tienen los ancianos de presentar infecciones del tracto respiratorio inferior.
Anatómicos
Durante las dos primeras décadas de la vida los pulmones están en fase de crecimiento y maduración. El máximo número de alvéolos se obtiene entre los 10 a 12 años de edad; posteriormente, empieza la maduración del sistema respiratorio la cual se acelera hasta alcanzar su función máxima, que se obtiene alrededor de los 20 años en las mujeres y a los 25 años en los hombres.
El pulmón humano tiene cerca de 300 millones de alvéolos, cuyo número no se disminuye con el envejecimiento; sin embargo, la geometría pulmonar en esta zona se distorsiona en parte por los cambios en la forma de los alvéolos, los que tienden a dilatarse y aplanarse (10).
El aplanamiento de la superficie interna del alvéolo está asociado con una disminución en la superficie alveolar (75 m2 a los 30 años de edad y 60 m2 a los 70 años de edad, una reducción de 0.27 m2 por año) (11).
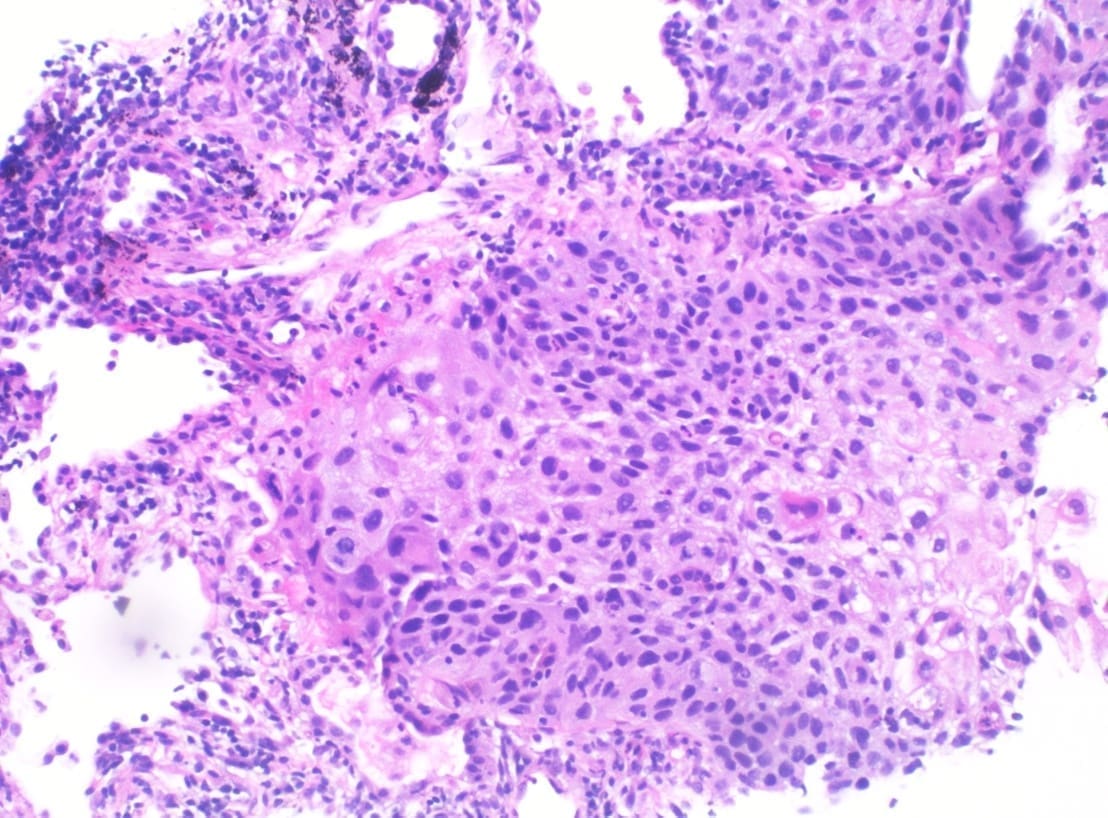
De forma consistente, estudios morfológicos han encontrado un aumento en el promedio de la distancia entre las paredes y una disminución en el área de superficie de la vía aérea por unidad de volumen pulmonar, la cual se inicia alrededor de la tercera década de vida (8). En la Figura 1 se comparan los cambios histológicos entre el pulmón de un paciente joven y un anciano.
Enfisema senil
El término “Enfisema Senil”, acuñado en la literatura médica desde el siglo XX (12,13), fue usado para describir los cambios en la forma y distensibilidad del tórax (14), y el aumento del tamaño del espacio aéreo con el edad (15).
Las influencias del tabaquismo, enfermedad ocupacional y la contaminación ambiental sobre la histología del pulmón no fueron consideradas cuando se atribuyeron estos cambios al envejecimiento normal. El término enfisema senil fue abandonado debido a que el diámetro normal del espacio aéreo de acuerdo con la edad no ha sido definido, como tampoco la falta de relación entre la histología enfisematosa presente en los pulmones envejecidos con la enfermedad pulmonar obstructiva crónica (16).
Un hallazgo que se encuentra con frecuencia en la mayoría de los ancianos es el cambio en la forma del tórax, el cual es producido por fracturas vertebrales parciales o completas asociadas con osteoporosis, calcificación de los cartílagos costales y cambios degenerativos a nivel de las articulaciones costo-vertebrales, que aumentan la cifosis dorsal y el diámetro antero-posterior del tórax originando el conocido tórax en tonel (11).
Estos cambios de la pared torácica no sólo alteran su distensibilidad sino también la curvatura del diafragma, lo que tiene un efecto negativo en su capacidad para generar fuerza (17).
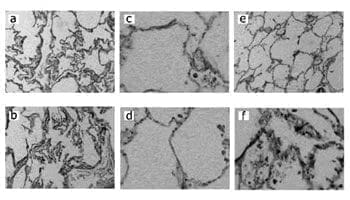
Cortesía Dr. Guillermo López Guarnizo, Patólogo, Universidad de Caldas.
Figura 1. Pulmón de adulto joven, panel superior (a, c, e) teñido con hematoxilina-eosina (10X), tejido elástico (Verhoeff) (40X) y colágeno (tricrómico) (40X) respectivamente; mostrando dilatación normal de los duelos alveolares y distribución normal de tejido elástico y colágeno.
Pulmón de anciano, panel inferior (b, d, f) con iguales coloraciones donde se aprecia dilatación de los ductos alveolares, tejido elástico
disminuido e incremento del colágeno a nivel intersticial.
Cambios a nivel funcional
Hay una compleja interrelación de cambios que se presentan a nivel pulmonar y en la mecánica de la pared torácica, los cuales contribuyen a que se altere la función muscular, los volúmenes pulmonares, las tasas de flujo ventilatorio y el control de la respiración.
Función muscular
Para vencer las resistencias ofrecidas por el pulmón, las paredes del tórax y del abdomen, los músculos respiratorios deben realizar un trabajo mecánico, durante el cual consumen una gran cantidad de oxígeno (O2) proporcional a la magnitud del trabajo realizado.
Al analizar la reserva ventilatoria es importante mencionar que el trabajo ventilatorio es ineficiente debido al gran consumo de energía que hace. En condiciones de reposo, el 90% de la energía se utiliza para que los músculos de la respiración puedan realizar su metabolismo y sólo el 10% restante es utilizado para transportar O2 y bióxido de carbono (CO2) a través del espacio aéreo (18).
En situaciones de estrés en las que se requiere un aumento en la ventilación, el O2 adicional que se obtiene termina siendo utilizado por los músculos de la respiración, lo cual hace que ancianos con una baja reserva funcional pulmonar o una enfermedad pulmonar crónica de base estén en un alto riesgo de desarrollar falla respiratoria aguda cuando se les superpone un evento estresante que incrementa las demandas metabólicas y ventilatorias, como son los procesos infecciosos a nivel tracto respiratorio (11) y la insuficiencia ventricular izquierda (19).
Cambios a nivel musculo-esquelético
Con el envejecimiento se presentan cambios a nivel de los músculos esqueléticos, en parte producidos por algún grado de sarcopenia que probablemente afecta también la función de los músculos esqueléticos respiratorios.
La sarcopenia hace referencia a la pérdida de la masa muscular por debajo de un umbral crítico que puede llevar al anciano a discapacidad física (20); está dada por el menor número de células en los órganos y la falta de uso en el tejido muscular estriado.
A los 70 años el músculo esquelético ha perdido el 40% de su peso máximo obtenido en la edad adulta, comparado con el 18% para el hígado, 11% para el pulmón y 9% para el riñón (21). Esta situación es más dramática después de los 80 años y parece ser la razón por la cual se aumenta la vulnerabilidad en este grupo poblacional puesto que la sarcopenia influencia, en forma notable, la disminución de fuerza y movilidad y contribuye a la fragilidad (22).
Principales determinantese en la disminución de la fuerza muscular por la edad
Los principales determinantes en la disminución de la fuerza muscular asociados con la edad son: la disminución en la masa muscular, disminución en el número de fibras musculares especialmente las tipo II (contracción rápida) y las unidades motoras, alteraciones en las uniones neuro-musculares y pérdida de las neuronas motoras periféricas con denervación selectiva de las fibras tipo II (23).
Otros factores a tener en cuenta que se han relacionado con la capacidad para generar fuerza por los músculos respiratorios son el estado nutricional (24) y la presencia de diferentes patologías, entre las cuales se tienen: insuficiencia cardíaca (25), enfermedad de Parkinson (26) y secuelas de enfermedad cerebrovascular (27).
La mayoría de las investigaciones que se han realizado para determinar los cambios que trae el envejecimiento humano sobre los músculos de la respiración han medido la presión inspiratoria máxima (PIM) y la presión espiratoria máxima (PEM), lo que ha hecho difícil precisar los cambios asociados con el envejecimiento de músculos respiratorios específicos, debido a que los cambios producidos, se dan de forma simultánea en las propiedades del pulmón, en la pared torácica, como también en la interdependencia que tienen los diferentes grupos musculares (28).
La PIM disminuye en forma linear, mientras que la PEM lo hace en forma curvilínea entre las edades de 20 a 65 años en un valor cercano al 15% (29). Al estudiar de forma especifica al diafragma, que es el principal músculo de la respiración, se encontró que su función contráctil disminuyó en forma significativa aproximadamente en un 25%. Los cambios presentados durante el envejecimiento en los músculos respiratorios son descritos en la Tabla 1.
Tabla 1. Cambios en los músculos respiratorios con el envejecimiento
|
Mecánica pulmonar y de la pared torácica
La mecánica de la respiración se hace por dos movimientos: la inspiración y la espiración. La fase de la inspiración es un proceso activo, producido por acción de la contracción del diafragma que origina un aplanamiento de la base del tórax y de los músculos intercostales externos que causan una elevación de las costillas, produciendo así un aumento en el volumen pulmonar, disminución en la presión intrapleural y generando el flujo necesario para la inspiración.
La fase de la espiración es un proceso pasivo, resultado de la retracción del pulmón y de los músculos por su elasticidad propia proveniente de las fibras elásticas del parénquima pulmonar y de la tensión superficial producida por el líquido que cubre el epitelio alveolar (30).
La elasticidad se define como la propiedad que tiene la materia de retornar a su forma original luego de ser deformada por una fuerza externa. Al inicio de la espiración se establece un gradiente entre el alvéolo y el exterior donde la presión intra-alveolar es mayor, lo cual genera un flujo de aire de adentro hacia fuera hasta llegar al punto donde las presiones se igualan y posteriormente se aumentan las presiones alrededor de la vía aérea originando su cierre (presión de cierre) (31).
En condiciones normales de reposo, hay un equilibrio entre las fuerzas que traccionan el pulmón hacia adentro compensado por las fuerzas que traccionan la pared del tórax hacia fuera, lo cual permite que los volúmenes pulmonares se mantengan.
Distensibilidad
La distensibilidad se define como el cambio de volumen por unidad de presión sobre el pulmón, la cual es medida con la presión de retroceso elástico por manometría esofágica. Con el envejecimiento se produce una disminución de la distensibilidad de la pared del tórax, mientras que la distensibilidad del pulmón se aumenta (32).
Al cambiar las propiedades elásticas del pulmón con el proceso del envejecimiento, el cierre de la vía aérea se establece de forma más temprana, lo que produce retención de aire (33). Lo anterior se puede entender al realizar una analogía entre el pulmón y un globo de aire: cuando éste está nuevo es elástico, poco distensible y expulsa por completo el aire que hay en su interior, mientras que cuando está desgastado (envejecido), es menos elástico y no expulsa completamente el aire que hay en su interior (retención de aire) (34).
Las propiedades elásticas del pulmón dependen en parte de la elastina y del colágeno, que son proteínas extracelulares insolubles, cuyas características son su longevidad, fuerza y resistencia a la degradación. Estas proteínas forman una red fibrosa la cual está en continuidad desde el hilio a los ductos alveolares.
En el bronquio y grandes bronquiolos las fibras están organizadas de forma longitudinal, más distal, a nivel de los bronquíolos respiratorios y ductos alveolares se organizan de forma helicoidal (4).
Los cambios relacionados con el envejecimiento de estas proteínas han sido sujeto de investigaciones y de forma llamativa a pesar de la disminución en el retroceso elástico, varios estudios han demostrado un incremento de la concentración de la elastina con la edad (35).
Estudio de Pierce
Pierce realizó un estudio donde se tomaron 45 muestras de lóbulo medio pulmonar en autopsias de pacientes que no murieron por causa de enfermedad pulmonar y halló un incremento relacionado con la edad en la relación elastina-colágeno (r = 0.73) medidos en gramos por peso seco (36).
A nivel de la elastina se ha encontrado que ésta compromete el retroceso elástico debido a modificaciones en la disposición espacial y el entrecruzamiento de la red de fibras, y a la presencia de seudo-elastina (11).
El colágeno representa entre el 15 al 20% del peso seco pulmonar, el cual es aproximadamente el doble del de la elastina y su concentración promedio parece cambiar poco con la edad (37). Con el envejecimiento se produce un incremento en los entrecruzamientos del colágeno pulmonar que producen cambios a este nivel, entre los cuales se encuentran: aumento en el tamaño de los ductos alveolares, reducción en el área de superficie y disminución en la capacidad de difusión (4).
Volúmenes y flujos pulmonares
Los cambios en las propiedades elásticas del pulmón determinan alteraciones en los flujos y volúmenes pulmonares. Se debe tener en cuenta que todos los volúmenes pulmonares son dependientes del tamaño corporal, en especial de la estatura y de la circunferencia del tórax, los que se aumentan durante la infancia hasta un punto de máximo desarrollo.
Por ejemplo el volumen de cierre, que es el volumen en el cual las pequeñas vías aéreas empiezan a cerrarse durante la espiración, se incrementa con la edad. Este cierre prematuro es debido a pérdida del tejido de soporte de las vías aéreas terminales.
El cierre temprano de la vía aérea terminal origina retención de aire con el consiguiente incremento del volumen residual terminal, el cual se incrementa aproximadamente en un 50% entre los 20 a 70 años de edad (8).
De la misma forma, el cierre de las vías aéreas periféricas se comporta como una obstrucción distal al flujo originando un patrón obstructivo de pequeñas vías, que en las pruebas espirométricas se traduce en una reducción del flujo espiratorio forzado entre 25% y 75% de la capacidad vital (FEF25-75), cifra que se afecta de forma más rápida en fumadores.
En los ancianos también se encuentra una reducción de la capacidad vital (CV: máxima cantidad de aire que se puede exhalar partiendo de una inspiración máxima) a casi un 75% de sus mejores valores entre los 20 a 70 años de edad (8), lo cual es debido a la rigidez de la caja torácica y a la pérdida de fuerza en los músculos inspiratorios.
Capacidad pulmonar total CPT en ancianos
La capacidad pulmonar total (CPT) no cambia en los individuos ancianos, ya que a pesar de la disminución en el retroceso elástico pulmonar asociado con la edad, éste se compensa con el aumento en la carga elástica de la caja torácica (38).
La capacidad residual funcional (CRF) en los ancianos está aumentada, debido al incremento en el retroceso elástico de la caja torácica y a la disminución del retroceso elástico del parénquima pulmonar.
Ello ocasiona que los ancianos respiren a mayores volúmenes pulmonares al compararlos con las personas jóvenes; este cambio se asocia con una mayor carga elástica en la caja torácica, ocasionando un mayor trabajo a los músculos respiratorios (33).
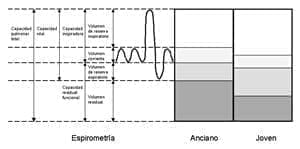
Figura 2. Cambios en los volúmenes pulmonares con el envejecimiento.
Se han descrito otros indicadores de flujo aéreo que disminuyen con la edad, como son la capacidad vital forzada (CVF) y el volumen espiratorio forzado en el primer segundo (VEF1), los cuales indican flujos a altos volúmenes pulmonares, por lo cual dependen principalmente de la fuerza de los músculos respiratorios, a diferencia del FEF25-75 que indica flujo a bajos volúmenes pulmonares y por tanto depende más del retroceso elástico del pulmón.
Se estima que el VEF1 se incrementa de forma aproximada hasta los 20 años en las mujeres y 27 años en los hombres (39). Después de los 30 años el VEF1 disminuye 30 ml por año en los hombres y 25 ml por año en las mujeres (40); es más acentuado en los fumadores, aunque también está condicionado por otros factores como son las infecciones respiratorias durante la infancia, la hiperrreactivad bronquial y el bajo peso al nacer (41).
El bajo peso al nacer ha mostrado estar asociado con una peor función a nivel pulmonar durante la infancia y, por ende, en la obtenida durante la vejez (42). En soporte de lo anterior Barker et al, demostraron que el bajo peso al nacer estaba asociado con un incremento en la mortalidad en pacientes ancianos que padecían EPOC y además que la presencia de una función pulmonar disminuida era una característica de personas que habían tenido infecciones respiratorias durante la infancia (43).
Tabla 2. Factores asociados en la disminución del VEF1 en ancianos
La Tabla 2 muestra los factores asociados en la disminución del VEF1 en ancianos. El VEF1 aporta gran información clínica. En condiciones normales equivale al 80% de la CVF. Un valor por debajo de 75% del predicho sugiere una patología obstructiva, como suele presentarse en la EPOC. La ecuación que se utiliza para determinar el valor del VEF1 en ancianos es (34):
1. Factores asociados con la obstrucción de la vía aérea
|
– Hombres: VEF1 (litros) = 0,0378 x altura (cm) – 0,0271 x edad – 1,73.
– Mujeres: VEF1 (litros) = 0,0281 x altura (cm) – 0,0325 x edad – 0,09.
De los diferentes volúmenes y flujos que se pueden medir durante la espirometría sólo la CVF es de ayuda para detectar patologías restrictivas como la sarcoidosis y la fibrosis pulmonar. La CVF disminuye alrededor de 21 ml por año después de los 30 años de edad (44,45).
La ecuación que se utiliza para determinar el valor de la CVF en ancianos es (34):
– Hombres: CVF (litros) = 0,0567 x altura (cm) – 0,0206 x edad – 4,37.
– Mujeres: CVF (litros) = 0,0365 x altura (cm) – 0,0330 x edad – 0,70.
La relación entre VEF1/CVF es de utilidad en la práctica clínica, en especial cuando se sospecha una patología obstructiva. Este valor en condiciones normales debe ser mayor del 75%. Un resultado inferior a 75% orientará hacia un proceso obstructivo.
Sin embargo, se ha encontrado un menor valor para esta relación en personas ancianas saludables (46,47); debido a lo anterior el uso del 75% como límite inferior normal podría sobre diagnosticar patologías obstructivas de la vía aérea en la población geriátrica (48).
Resultados obtenidos en el Estudio de Salud Cardiovascular han sugerido que el límite inferior normal para la relación entre VEF1/CVF debería estar entre 56 a 64% para personas de 65 a 85 años (5).
La resistencia en la vía aérea no se incrementa de forma significativa durante el envejecimiento normal, probablemente debido a que la mayor parte de ésta se encuentra a nivel de las grandes vías aéreas, las que no alteran su estructura ya que tienden a tener un diámetro fijo como resultado de su calcificación (49).
En la práctica clínica, las pruebas de función pulmonar pueden ser ordenadas a ancianos que se presentan con disnea persistente, a pesar de tener un tratamiento máximo para su enfermedad cardíaca, para clarificar síntomas observados en pacientes con demencia (50) o para valorar el riesgo de generar broncoconstricción con el uso de agentes b-adrenérgicos en pacientes con antecedente de broncoespasmo (51).
Estas pruebas pueden ser ordenadas para diagnosticar asma en pacientes que presentan tos como único síntoma (52), o monitorizar los efectos adversos de medicamentos que tienen toxicidad pulmonar (53).
Disnea y control de la respiración
La disnea y el control de la respiración implican un proceso de generación rítmica central que ajusta la frecuencia y la profundidad de la respiración según una combinación de estímulos mecánicos y químicos con impulsos superiores del sistema nervioso central (18).
En este complejo proceso intervienen los centros respiratorios, las conexiones nerviosas y los quimiorreceptores centrales y periféricos. Los centros respiratorios están localizados en el bulbo y la protuberancia; en el centro bulbar se han encontrado células inspiratorias y espiratorias que coordinan la ritmicidad de la respiración al hacer conexión con las motoneuronas que dirigen los músculos inspiratorios y espiratorios (54).
Los quimiorreceptores son órganos que responden a cambios en la composición química de la sangre o del líquido cefalorraquídeo que los rodea. Se ha encontrado que la respuesta de estos disminuye de manera importante con el envejecimiento, alcanzando niveles de 51% para la hipoxemia y de 41% para la hipercapnia (55).
Esto demuestra que el anciano desarrolla mecanismos de defensa tardíos, con una menor respuesta ventilatoria cuando se enfrenta a situaciones donde hay una caída de la PaO2 y un aumento de la PaCO2 con sus consiguientes efectos deletéreos, como se presenta en casos de falla cardíaca descompensada, infección o exacerbación de EPOC (56). Ancianos sanos presentan en reposo una ventilación minuto igual que la de sujetos jóvenes aunque con menores volúmenes corrientes y con altas frecuencias respiratorias (7).
Intercambio gaseoso
La principal función del pulmón es el intercambio gaseoso, es decir, eliminar el CO2 producto final del metabolismo celular e incorporar el O2 del medio ambiente a la sangre, para ser transportado a las mitocondrias de las células, sitio en donde se llevan a cabo las reacciones de óxido-reducción.
Para la realización de esta función se requiere de tres actividades que a pesar de ser diferentes, funcionan de forma integrada y son (54):
• La ventilación: encargada de llevar el O2 del medio ambiente a los alvéolos, a través de las vías aéreas y eliminar el CO2 de los alvéolos al medio ambiente.
• La difusión: es el proceso físico por el cual las moléculas de un gas se mueven de una parte de mayor presión a otra de presión inferior.
La difusión del O2 y el CO2 a través de la membrana alvéolo-capilar está regulada por la Ley de Fick, la cual establece que el volumen de gas que se mueve por unidad de tiempo a través de una membrana de tejido, es directamente proporcional a la superficie de esta membrana, a la diferencia de presión entre un lado y otro, a la difusibilidad del gas e inversamente proporcional al espesor de la membrana.
A nivel pulmonar, la situación es ideal, ya que la superficie es cercana a los 150 m2, la diferencia de presiones para el O2 es de 60 mm Hg y de 5 mm Hg para el CO2 y el espesor de la membrana es de 0.5 m.
• La circulación: encargada del transporte del O2 de los capilares alveolares a la célula y del CO2 en sentido contrario.
Alteración en la relación ventilación perfusión
Se requiere que haya una relación proporcional entre la ventilación y la perfusión, lo que se ha denominado la relación V/Q. A pesar de que hay diferencias regionales en los distintos segmentos pulmonares por fenómenos gravitatorios que hacen que la relación V/Q sea mayor a 1 en los ápices y menor a 1 en las bases en posición de bipedestación, de forma global en condiciones normales la relación V/Q tiende a ser igual a 1.
En el anciano hay una alteración en el retroceso elástico del pulmón, que origina un cierre más temprano de la vía aérea, lo que se hace más notorio en las bases pulmonares. Esto produce un cambio ventilatorio sin que se presente una disminución proporcional en la perfusión en esta misma zona, haciendo que se produzca una alteración de la V/Q lo cual tiene su expresión clínica en una disminución de la presión arterial de oxígeno (PaO2).
La membrana alvéolo-capilar
La capacidad de difusión (DL) también llamada “Factor de Transferencia” mide la capacidad de transferencia de gases desde los espacios alveolares hacia la sangre de los vasos capilares.
Este proceso tiene lugar por difusión pasiva y está en función de: la diferencia de presiones que conducen el gas, del área de superficie a través de la cual tiene lugar el intercambio y de la resistencia al movimiento de gas a través de la membrana y a su combinación química con la sangre.
Se emplea el monóxido de carbono como gas de prueba (DLCO), porque su avidez extrema por la hemoglobina hace que la presión posterior a la difusión pueda considerarse despreciable (18). La DLCO es dependiente de la ventilación alveolar y del volumen pulmonar. Es medida de acuerdo con la CPT y normalizada según la ventilación alveolar (DLCO/VA).
Evidencia del envejecimiento sobra la DLCO
La mejor evidencia que se tiene del efecto del envejecimiento sobre la DLCO ha sido obtenida de un estudio analítico de tipo transversal, en el cual se excluyeron de forma rigurosa pacientes con enfermedad oculta y se incluyeron seis sujetos con edades entre 69 a 85 años (57). En este estudio se encontró una baja DLCO/VA en los participantes ancianos.
Debido a que la DL fue normalizada según la VA, el bajo valor encontrado sugiere alteraciones en los componentes de la membrana alvéolo-capilar más que por la pérdida de la superficie del área alveolar. La reducción anual de la DLCO es de 0.2-0.32 ml/min/mm Hg en hombres y de 0.06-0.18 ml/min/mm Hg en mujeres (58).
Esta disminución es más pronunciada a partir de los 40 años de edad. Entre los factores asociados con la reducción en la DLCO se tienen: alteración en la relación V/Q, disminución en la superficie del área alveolar (12), disminución en la densidad de los capilares pulmonares (59) y disminución en el volumen sanguíneo capilar pulmonar (60).
Valores de gases sanguíneos
Con lo descrito previamente hay una base fisiológica que explica una baja PaO2 y un aumento en la diferencia alvéolo-arterial de oxígeno (AaDO2).
Diferentes investigaciones han demostrado una disminución de la PaO2 con la edad y se ha estimado que después de los 30 años la PaO2 disminuye aproximadamente 0.22 mm Hg por año.
Entre los factores que se tienen para esta disminución están: la alteración en la relación V/Q debido a un incremento en el volumen y la ventilación del espacio muerto que se presenta con el envejecimiento (13), los grandes cortocircuitos fisiológicos de perfusión (61) y los componentes de la membrana alvéolo-capilar que tienden a producir una baja PaO2 y una amplia AaDO2.
Fórmulas para determinar la PaO2 por edad
Se han propuesto diferentes fórmulas para determinar la PaO2 de acuerdo con la edad. La revisión de los datos originales que generaron estas fórmulas revelan varias limitaciones. Los siguientes resultados de la PaO2 ajustados según la edad fueron obtenidos en personas de 85 años de edad:
1. PaO2 mm Hg = 104.2 – 0,27 x edad (años) = 81 mm Hg (62).
2. PaO2 mm Hg = 100.1 – 0,325 x edad (años) = 72 mm Hg (63).
3. PaO2 mm Hg = 109 – 0,43 x edad (años) = 73 mm Hg (64).
La primera ecuación proviene de un estudio realizado en pacientes hospitalizados con enfermedad cardiovascular con edades entre los 15 a 75 años. La segunda ecuación es citada en un artículo de revisión, en el cual se indica que el valor del límite inferior normal puede ser el 90% del valor calculado, en el ejemplo presentado sería una PaO2 de 64 mm Hg.
La tercera ecuación proviene de un estudio realizado en Italia con 152 pacientes del área rural, con rangos de edades entre 14 a 84 años, no fumadores y sin evidencia clínica, de laboratorio ni radiológica de enfermedad cardíaca, pulmonar, tiroidea, hematológica ni hepática, lo que lo convierte en uno de los estudios más representativos en este tópico.
PAO2 y la edad
La presión alveolar de oxígeno (PAO2) no cambia e incluso tiende aumentar con el envejecimiento, esto hace que la AaDO2 que en condiciones normales es de 5 mm Hg, se incremente, lo cual es producido por cambios en la relación V/Q.
Aunque la PaO2 disminuye con la edad, la presión arterial de CO2 (PaCO2) no presenta cambios, lo cual es debido a que la PaCO2 está determinada por el balance entre el CO2 producido por el metabolismo del organismo y la ventilación alveolar; en el anciano tanto la ventilación alveolar como la actividad metabólica disminuyen, lo cual determina que la PaCO2 no se incremente de manera notable.
Es importante mencionar que no se producen cambios a nivel del valor del pH arterial en los ancianos y que cualquier alteración en estas cifras debe obligar al clínico a investigar las posibles etiologías en forma similar como se presentan en pacientes adultos jóvenes.
Mecanismos de defensa
El aparato respiratorio es uno de los sistemas que tiene mayor contacto con el medio ambiente. En reposo, más de 10.000 litros de aire entran al día por la vía aérea para llegar a la extensa superficie alveolar y efectuar el intercambio gaseoso.
En el aire inhalado se pueden aislar gran cantidad de elementos como antígenos orgánicos, tóxicos químicos o físicos y microorganismos. A pesar del contacto continuo con estos elementos, las vías aéreas son estériles a partir de la primera división bronquial gracias al eficiente mecanismo defensivo que poseen.
Los mecanismos de defensa han sido divididos en dos grandes grupos: los mecanismos de defensa inespecíficos o constitutivos y los mecanismos de defensa específicos, adquiridos o inmunológicos. Estos mecanismos de defensa interactúan de forma estrecha entre sí con el objetivo de conservar la integridad del sistema respiratorio (65). En la Tabla 3, se nombran los mecanismos de defensa del aparato respiratorio.
Tabla 3. Mecanismos de defensa del aparato respiratorio
1. Mecanismos constitutivos
2. Mecanismos adquiridos
|
Dentro de los mecanismos de defensa constitutivos está el sistema anatómico de purificación del aire, el cual está conformado por las estructuras respiratorias de las vías aéreas superiores.
Las fosas nasales además de humedecer y calentar el aire inspirado remueven y filtran las partículas mayores de 10 m; las partículas de menor tamaño que pueden llegar hasta el alvéolo son fagocitadas por el macrófago alveolar, los cuales son removidos por el drenaje linfático o por el sistema mucociliar.
El moco bronquial es una sustancia necesaria para el adecuado funcionamiento del sistema respiratorio, está constituido por agua, glicoproteínas, trasudado sérico, enzimas proteinolíticas, inmunoglobulinas y lípidos. Con el envejecimiento normal se produce una disminución en la producción de moco bronquial lo cual expone al epitelio a una mayor probabilidad de daño y a la adherencia de microorganismos (66).
Diferentes factores afectan el sistema de aclaración mucociliar en los ancianos entre los cuales se tienen: la exposición al humo del cigarrillo, bajas temperaturas, contaminación ambiental, entre otros. Se ha encontrado que el transporte mucociliar disminuye con la edad.
La velocidad para aclarar el moco traqueal es más lenta en ancianos no fumadores que en personas de menor edad (67). Cuando el sistema de transporte mucociliar no puede expulsar las partículas irritantes, se desencadena el mecanismo reflejo de la tos.
La tos en una persona sana no es el principal mecanismo de aclaración mucociliar. Por el contrario, en personas con patología bronquial crónica, la tos contribuye con cerca del 50% de la efectividad del mecanismo del aclaramiento mucociliar al lograr la expulsión del moco y de las secreciones bronquiales acumuladas (68).
Reflejo de la tos en el anciano
En el anciano el reflejo de la tos está disminuido debido a diferentes factores entre los cuales se tienen: la necesidad de un mayor estímulo en las vías aferentes mediadas por el vago a nivel laríngeo y bronquial para desencadenar el reflejo, alteración a nivel central de la percepción para la broncoconstricción e integración del mecanismo de la tos (69).
A nivel de los mecanismos celulares fagocíticos, la primera línea de defensa la constituye el macrófago alveolar residente, encargado de proteger a bronquíolos pequeños y alvéolos.
Los mecanismos adquiridos mediados por células están a cargo de una población de linfocitos, que cooperan con el macrófago alveolar para reforzar su actividad fagocítica y bactericida. Esta cooperación se lleva a cabo mediante dos procesos: la citotoxicidad mediada por células y las reacciones mediadas por linfoquinas.
El número de linfocitos T periféricos no cambia de forma importante con la edad, aunque ha sido demostrado que su capacidad para generar una respuesta inmune disminuye, lo que produce una disminución en las defensas a nivel pulmonar (4).
En el sistema respiratorio las respuestas inmunes específicas son las que con mayor frecuencia se afectan con la edad. Aunque la presentación de antígeno permanece casi sin cambios, la producción de citoquinas se altera, esto hace que la población geriátrica sea más susceptible a las infecciones y neoplasias.
Sistema autonómico
Los cambios relacionados con el envejecimiento en la respuesta del sistema autonómico por medio de la musculatura lisa bronquial al estímulo farmacológico, pueden cambiar la presentación de los síntomas de las enfermedades pulmonares, modificar el valor predictivo de las pruebas diagnósticas y alterar la respuesta al tratamiento.
La metacolina inhalada es una sustancia parasimpaticomimética que produce broncoconstricción por el estímulo de los receptores de acetilcolina localizados en el músculo liso bronquial, que se utiliza en las pruebas de broncoprovocación con el objetivo de demostrar hiperactividad bronquial y de excluir o documentar la presencia de asma (70).
Los efectos que tiene la edad sobre la respuesta broncoconstrictiva de la metacolina fueron reportados en el Estudio de Envejecimiento Normativo, donde se encontró que 161 de los participantes que nunca habían fumado (promedio edad: 62 años y rango 41-84 años) tuvieron una respuesta significativa a la prueba de la metacolina sin síntomas de tos o presencia de broncoconstricción y concluyeron que la prueba del reto a la metacolina en personas asintomáticas carece de significancia clínica conocida (71).
No hay datos que sugieran diferencias relacionadas con la edad en cuanto al uso de agentes anticolinérgicos inhalados.
Capacidad de ejercicio
No existe evidencia que los cambios normales del envejecimiento que se presentan a nivel de los volúmenes pulmonares o del VEF1 estén asociados con una alteración en el desempeño de las actividades de la vida diaria, aunque se debe tener en cuenta que al igual que los demás músculos esqueléticos del cuerpo humano, los músculos de la respiración son más proclives a padecer fatiga, debido a la menor fuerza de contracción y capacidad para generar presión en situaciones de estrés donde están incrementados los requerimientos ventilatorios, como en una neumonía o en exacerbaciones de la EPOC (28).
Además de la dificultad para ajustar la respuesta ventilatoria al ejercicio, los ancianos tienen un inicio más rápido de cambio de metabolismo aerobio que requiere O2 a uno anaerobio, independiente de O2 (2).
El consumo máximo de O2 (VO2 máx) es el índice utilizado para medir el trabajo físico en el organismo. Alcanza su máximo valor entre los 20 a 30 años de edad y después de los 30 años disminuye en un 9% por década en hombres sin entrenamiento y solo 5% en atletas o personas sometidas a programas de ejercicio (58).
Esta declinación es más pronunciada en personas sedentarias que en quienes realizan ejercicio de forma regular (38), esto es debido a que el ejercicio altera el curso más no previene de la declinación en la función pulmonar asociada con la edad.
El VO2 máx está determinado por la función cardíaca, el trabajo respiratorio y la utilización del O2 por los músculos del cuerpo. Es la disminución de la masa muscular magra en mayor proporción y en menor medida el gasto cardíaco los principales determinantes para la disminución de este indicador durante el envejecimiento.
Tabla 4. Principales cambios en la fisiología pulmonar que se presentan durante el envejecimiento
1. Disminución
|
Conclusiones
Como en otros órganos, el proceso del envejecimiento lleva a una disminución en la reserva fisiológica a nivel respiratorio. Las principales características del envejecimiento del sistema respiratorio reflejan cambios anatómicos y estructurales a nivel de: el retroceso elástico pulmonar, la distensibilidad de la pared torácica y la fuerza de los músculos respiratorios.
La disminución en el retroceso elástico estático del pulmón produce un incremento en el volumen y la capacidad residual funcional. Estos cambios ocasionan dilatación de la vía aérea, colapso de las pequeñas vías aéreas y disminución de los volúmenes espiratorios, los cuales son similares a los presentados en el enfisema y en la enfermedad de pequeñas vías aéreas.
La distensibilidad de la caja torácica disminuye y la del pulmón se incrementa, esto produce un mayor trabajo respiratorio y coloca al grupo de ancianos en mayor riesgo de desarrollar insuficiencia respiratoria cuando se sobrepone un evento estresante que incrementa las demandas metabólicas y ventilatorias.
Bibliografía
1. Cassel CK. In defense of a department of geriatrics. Ann Intern Med 2000:4:297-301.
2. De Martinis M, Timiras PS. The Pulmonary Respiration, Hematopoiesis and Erythrocytes. In: Timiras P, ed. Physiological Basis of Aging Geriatrics. 3rd. Florida: CRC Press LLC; 2003: 319-336.
3. Isaacs B. The challenge of geriatric medicine. Oxford: Oxford University press;1992.
4. Dyer CAE, Stockiey RA. The aging lung. Rev Clin Gerontol 1999; 9:103-115.
5. Enright PL, Kronmal RA, Higgins M. Spirometry reference valúes for women and men 65 to 85 years of age. Cardiovascular Health Study. Am Rev Respir Dis 1993;147:125-133.
6. Sobol BJ, Weinheimer B. Assessment of ventilatory abnormaity in the asymptomatic subject: an exercise in futility. Thorax 1966; 21:445-449.
7. Krumpe PE, Knudson RJ, Parsons G, Reiser K. The aging respiratory system. Clin Geríat Med 1985; 1:143-175.
8. Janssens JP, Pache JC, Nicod LP. Physiological changes in respiratory function associated with Ageing. Eur Respir J 1999;13:197-205.
9. Thompson AB, Scholer SG, Daughton DM. Altered epithelial lining fluid parameters in oíd normal individuáis. J Gerontol 1992; 47: M171-176.
10. Enright PL. Aging ofthe Respiratory System. In: Hazzard W, Blass JP, Halter JB, Ouslander JG, Tinetti ME, eds. Principies ofGeriatric Medicine and Gerontology. 5th. NewYork: McGraw- Hill; 2003: 511-515.
11. Crapo RO. The aging lung. In: Mahier DA, ed. Pulmonary Disease in the EIderly Patient. Vol. 63. NewYork: Marcel Dekker; 1993: 1-21.
12. Verbeken E, Cauberghs M, Mertens I. The senile lung. Comparison with normal and emphysematous lungs. I: Structural aspects. Chest 1992;101:793-799.
13. Tenney SM, Miller RM. Dead space ventilation in oíd age. J Appl Physiol 1956; 9:321-327.
14. Frank NR, Mead J, Ferris BG. The mechanical behavior ofthe lungs in healthy eideriy persons. J Clin Invest 1957; 36:1680- 1687.
15. Wright RR. Elastic tissue of normal and emphysematous lungs. A tridimensional histologic study. Am J Pathol 1961; 39:355- 363.
16. Fletcher C, Gilson JG, Hugh-Jones P. Terminology, definitions, and classification of chronic pulmonary emphysema and related conditions. A report of the conclusions of a CIBA guest symposium. Thorax 1959; 14: 286-299.
17. EdgeJ, Millard F, Reid L. Theradiographicappearance ofthe chest in persons of advanced age. Br J Radiol 1984:37:769- 774.
18. Culver BH. Fisiología. En: Albert RK, Spiro SG, Jett JR, eds. Tratado de Neumología. 1ed. Madrid: Harcourt; 2001: 4.1- 4.42.
19. NishimuraY, Maeda H.TanakaK, NakamuraH, Hashimoto Y, Yokoyama M. Respiratory muscle strength and hemodynamics ¡n chronic heart failure. Chest 1994;105: 355-359.
20. MorleyJE, BaumgartnerRN, RoubenoffR. Sarcopenia.J Lab Clin Med 2001; 137: 231-243.
21. Baumgartner RN, Stauber PM, McHugh D, Garry PJ. Crosssectional age differences in body composition in persons 60+ years of age. J GerontolA Biol Sci Med Sci 1995; 50: M307- 316.
22. Roubenoff R. Origins and clinical relevance of sarcopenia. Can J Appl Physiol 2001; 26: 78-89.
23. Brown M, Hasser E. Complexity of age-related change in skeletal muscle. J Gerontol A Biol Sci Med Sci 1996; 51:117- 123.
24. Arora NS, Rochester DF. Respiratory muscle strength and maximal voluntaryventilation in undernourished patients. Am Rev Respir Dis 1982; 126: 5-8.
25. Evans S, Watson L, Hawkins M, CowleyA, Johnston I, Kinnear W. Respiratory muscle strength in chronic heart failure. Thorax 1995; 50:625-628.
26. Brown L. Respiratory dysfunction in Parkinson’s disease. Clin Chest Med 1994; 15: 715-727.
27. Vingerhoets F, Bogoussiavsky J. Respiratory dysfunction in stroke. Clin Chest Med 1994; 15: 729-737.
28. Tolep K, Kelsen SG. Effects of aging on respiratory skeletal muscles. Clin Chest Med 1993; 14: 363-378.
29. Enright PL, Kronmal RA, Manolio TA, Schenker MB, Hyatt RE. Respiratory muscle strength in the eiderly: correlates and reference valúes. Am J Respir Crit Care Med 1994; 149: 430-438.
30. Patino JF. Gases Sanguíneos. Fisiología de la respiración e insuficiencia respiratoria aguda. 6ed. Santa Fe de Bogotá: Editorial Médica Internacional Ltda.; 1998: 35-88.
31. Smith JC, Loring SH. Passive mechanical properties ofthe chest wall. In: Fishman AP, ed. Handbook of physiology. Vol. 3. Bethesda, MD: American Physiology Society 1986: 429-442.
32. Turner JM, Mead J, Wohl ME. Elasticity of human lungs in relation to age. J Appl Physiol 1968; 25: 664-671.
33. Mittman C, Edelman NH, Norris AH. Relationship between chest wall and pulmonary compliance with age. JAppl Physiol 1965; 20: 1211-1216.
34. López JH. Fisiología del envejecimiento. 1ed. Bogotá: ImpreAndes Presencia S.A.; 1998: 28-41.
35. Pierce JA, Hocott JB. Studies on the collagen and elastin content ofthe human lung. J Clin Invest 1960: 39: 8.
36. Pierce JA. Age related changes in the fíbrous proteins of the lungs. Arch Environ Health 1963; 6: 50-54.
37. Pierce JA, Ebert RV. Fibrous network ofthe lung and its change with age. Thorax 1965; 20: 469-476.
38. McCIaran SR, Babcock MA, Pegelow DF. Longitudinal effects ofaging on lung function at rest and exercise in healthy active fit eiderly adults. J Appl Physiol 1995; 78: 1957-1968.
39. Knudson RJ, Slatin RC, Lebowitz MD, Burrows B. The maximal expiratory flow-volume curve: normal standards, variability, effects of age. Am Rev Respir Dis 1976; 113: 587-599.
40. Burrows B, Lebowitz MD, Camilli AE. Longitudinal changes in torced expiratory volume in one second in adults. Am Rev Respir Dis 1986; 133: 974-980.
41. Tager IB, Segal MR, Speizer FE. The natural history of torced expiratory volumes. Effect of cigarette smoking and respiratory symptoms. Am Rev Respir Dis 1988; 138: 837-849.
42. Lercher P, Schmitzberger R. Birth weight, education, environment, and lung function at school age: a community study in an alpine área. Eur Respir J 1997; 10: 2502-2507.
43. Barker DJP, Godfrey KM, Fall C, Osmond C, Winter PD, Shaheen SO. Relation of birth weight and childhood respiratory infection to adult lung function and death from chronic obstructivo pulmonary disease. BMJ 1991; 303: 671-675.
44. Dockery DW, Ware JH, Ferhs BG. Distribution offorced expiratory volume in one second and torced vital capacity in healthy, white, adult, never smokers in six U.S. cities. Am Rev Respir D/S1985; 131:511-520.
45. Van Peit W, Borsboom GJJM, Rijcken B. Discrepantíss between longitudinal and crosssectional change in ventilatory function in 12 years of tollow-up. Am J Respir Crit Care Med 1994; 149: 1218-1226.
46. Knudson RJ, Lebowitz MD, Holberg CJ. Changes in the normal maximal expiratory flow volume curve with growth and aging. Am Rev Respir Dis 1983; 127: 725-734.
47. Gibson GJ, Pride NB, 0’Cain C. Sex and age differences in pulmonary mechanics in normal nonsmoking subjects. J Appl Physiol 1976; 41: 20-25.
48. The American Thoracic Society. Lung function testing: selection of reference valúes and interpretive strategies. Am Rev Respir Dis 1991; 144: 1202-1218.
49. Berry RB, Pai UP, Fairshter RD. Effect of age on changes in flow rates and airway conductance after a deep breath. J Appl Physiol 1990; 68: 635-643.
50. Connolly MJ, Jarvis EH, Hendrick DJ. Late-onset asthma in a demented eiderly patient. The valué of methacholine challenge in diagnosis. J Am Geriatr Soc 1990; 38: 539-541.
51. Connolly MJ. Obstructive airways disease: a hidden disability in the aged. Age Aging 1996; 25: 265-267.
52. Pratter MR, Bartter T, Akers S. An algorithmic approach to chronic cough. Ann Intern Med 1993; 119: 977-983.
53. Crapo RO. Pulmonary-function testing. N Engí J Med 1994; 331:25-30.
54. Páez S, Reyes PV, Serrano FO, Solarte I, Restrepo J, Maídonado D, Torres CA. Fisiología pulmonar. En: Chaparro C. Awad CE, Torres CA, eds. Fundamentos de Medicina. Neumología. Sed. Medellín: Quebecor impreandes; 1998: 20-54.
55. Kronenberg RS, Drage CW. Attenuation of the ventilatory and heart rate responsos to hypoxia and hypercapnea with aging in normal men. J Clin Invest 1973; 52: 1812-1819.
56. Peterson DD, Pack Al, Silage DA. Effects of aging on ventilatory and occiusion pressure responsos to hypoxia and hypercapnia. Am Rev Respir Dis 1981; 124: 387-391.
57. Stam H, Hrachovina V, StijnenT. Diffusing capacity dependent on lung volume and age in normal subjects. J Appl Physiol 1994; 76: 2356-2363.
58. Murray JF. Aging. In: Murray JF, ed. The Normal Lung. Philadelphia: PAWB Saunders; 1986: 339-360.
59. Butler C, Kleinerman J. Capillary density: alveolar diameter, a morphometric approach to ventilation and perfusión. Am Rev RespirDis 1970; 102: 886-894.
60. Guénard H, Marthan R. Pulmonar/ gas exchange in eiderly subjects. Eur Respir J 1996; 9: 2573-2577.
61. Begin R, Renzetti AD, Bigler AH. Flow and age dependence of airway closure and dynamic compliance. J Appl Physiol 1975; 38: 199-206.
62. Mellemgaard K. The alveolar-arterial oxygen difference: its size and components in normal men. Acta Physiol Scand 1966; 67: 10-20.
63. Knudson RJ. How aging affects the normal lung. J Respir Dis 1981; 2: 74-84.
64. Sorbini CA, Grassi V, Solinas E. Arterial oxygen tensión in relation to age in health subjects. Respiration 1968; 25: 3-13.
65. Sánchez CE, Reyes PV, Awad CE. Mecanismos de defensa del aparato respiratorio. En: Chaparro C. Awad CE, Torres CA,eds. Fundamentos de Medicina. Neumología. 5ed. Medellín: Quebecor impreandes; 1998: 55-64.
66. Gyetko MR, Toews GB. Immunology of the aging lung. Clin Chest Med 1993; 14: 379-391.
67. Camner P, Mossberg M, Phillipson K. Elimination of test partióles from the human tracheobronchial tract by voluntary coughing. Scand J Respir 1979; 60: 562.
68. Bennett WD, Chapman WF, Gerrity TR. Ineffectiveness of cough for enhancing mucus clearance in asymptomatic smokers. Chest 1992; 102: 412-416.
69. Newnham DM, Hamilton SJC. Sensitivity ofthe cough reflex ¡n young and eiderly subjects. Age Aging 1997; 26: 185-188.
70. McFadden ER. Asthma. In: Kasper DL, Braunwaid E, Fauci AS, Hauser SL, Longo DL, Jameson JL, eds. Harrison’s. Principies of Internal Medicine. 16th. New York: McGraw-Hill; 2005; 1508-1516.
71. Sparrow D, 0’Connor G, Colton T. The relationship of norspecific bronchial responsiveness to the occurrence of respiratory symptoms and decreased levels of pulmonary function. The normative aging study. Am Rev Respir Dis 1987; 135: 1255- 1260.



¡Buen artículo! Es impresionante cómo el envejecimiento afecta al sistema respiratorio en tantos niveles. Una duda: ¿hay alguna manera efectiva de minimizar estos cambios con estrategias nutricionales o ejercicios específicos? Me parece fascinante que a pesar de todo, nuestro sistema respira tan eficazmente incluso en la vejez. Gracias por compartir esta información.
La dexametasona cada cuánto se le puede aplicar a un paciente con epoc edad 90 años