Si bien, los tumores de origen broncogénico son los más frecuentes, los tumores neuroendocrinos, originados en el tejido linfohematopoyético son también de gran interés e importancia dentro de la patología neoplásica asociada al pulmón. Son de una gran variedad de presentación, así como también es variado su pronóstico, su incidencia y sus presentaciones clínicas. (Lea también: Variabilidad de pruebas de función pulmonar en niños sanos, asmáticos y con enfermedad pulmonar crónica)
Francisco Cuervo Millán, M.D*
* Medicina Interna – Neumología – UCI, Hospital Santa Clara E.S.E. –
Clínica de Marly – Clínica Palermo.
Introducción
Dentro del grupo de tumores de origen neuroendocrino podemos agrupar a una gran variedad, lo que ha llevado a que tanto la clasificación como la terminología aplicada a ellos sea bastante confusa, permitiendo de esta manera la aparición de diferentes clasificaciones, dentro de las cuales se incluían incluso los tumores de célula pequeña, los que actualmente hacen parte del grupo de tumores broncogénicos, a pesar de tener algunas características similares a los de origen neuroendocrino.
Dentro de las clasificaciones más aceptadas en la actualidad tenemos la que aparece en la Tabla 1, la cual compara la clasificación antigua con la propuesta en 1999 por la OMS.
Tabla 1. Clasificación de los tumores neuroendocrinos (2).
| Clasificación Nueva | Clasificación Vieja |
| Carcinoide típico | Carcinoide bronquial |
| Carcinoide atípico | Carcinoma neuroendocrino bien diferenciado |
| Carcinoma neuroendocrino de célula grande |
|
| Carcino de pulmón de célula pequeña |
Carcinoma neuroendocrino de tipo célula intermedia Carcinoma neuroendocrino de tipo célula pequeña |
| Tanto el carcinoma de célula grande como el de célula pequeña son descritos como los tumores brocogénicos. | |
Los tumores neuroendocrinos pulmonares representan cerca del 20% de los carcinomas pulmonares, constituyendo un grupo con comportamiento y pronóstico variado (3).
Para establecer una mejor diferenciación de los diferentes tipos histológicos, la OMS se baso en los datos morfológicos convencionales y de inmunohistoquímica, los cuales llevan tanto a una aproximación pronóstica como terapéutica. Teniendo en cuenta estos parámetros la clasificación que rige desde 1999 es la que sigue (4):
Tabla 2. Terminología de los tumores neuroendocrinos (OMS, 1999)
| Tumores de células endocrinas y tumorletsHiperplasia de células neuroendocrinas. – Asociados a fibrosis – Adyacente a tumor carcinoide – Hiperplasia de células neuroendocrina difusa idiopática. |
| Neoplasias con morfología endocrina. – Carcinoide típico – Carcinoide atípico – Carcinoma neuroendocrino de célula grande. Variante: Carcinoma neuroendocrino de célula grande combinado. Carcinoma pulmonar de célula pequeña Variante: Carcinoma pulmonar de célula pequeña combinado. Carcinoma no célula pequeña con diferenciación neuroendocrina. |
| Otros tumores con aspectos neuroendocrinos Blastoma pulmonar. Tumor neuroendocrino primitivo Tumor de célula redonda desmoplásmico Carcinomas de fenotipo rabdoide. Praganglioma. |
Si bien son varios, el tumor carcinoide ha sido considerado como el eje fundamental de este grupo de tumores y es por esto que, a pesar de su baja frecuencia, lo consideramos como un tema de gran importancia e interés.
Descritos inicialmente por Lubarsch en en 1888, encontrando un grupo de pacientes a los que en la necropsia se les encontraron tumores en el ileon distal (5,6), posteriormente fue Oberdorfer en 1907, quien introdujo el término de Karzinoide, agrupando en este a un grupo de tumores de características similares (5,6).
Hacia 1914 Gosset y Masson descubrieron las propiedades del argentafin de las células del carcinoide y su origen en las criptas de Lieberkühn introduciendo el nombre de “argentafinomas” (6).
En 1944 Engelbrech-Holm describió los hallazgos diferenciales entre tumores carcinoides típicos y atípicos, sin embargo, no fue si no hasta 1972 en que Arrigoni propone los criterios histológicos para diferenciar estos dos tipos de tumores (3). Ya en 1969, Pearse describió las características histoquímicas y ultraestructurales comunes con las células del sistema neuroendocrina (6).
Modlin y Sandor, encontraron en una revisión de 8305 casos de tumor carcinoide encontraron que el 74% se encontraban en el tracto gastrointestinal y un 24% se encontraban en el pulmonar (6), como se puede ver en la Tabla 3.
Tabla 3. Localización y frecuencia de los tumores carcinoides
| Localización | Frecuencia (%) |
| Yeyuno-ileon | 26 |
| Traquebroncopulmonar | 25 |
| Apéndice | 19 |
| Recto | 13 |
| Colon | 8 |
| Estómago | 3 |
| Islotes Pancreáticos | 3 |
| Duodeno | 2 |
| Otros* | 1 |
Anteriormente llamados adenomas, los tumores carcinoides, descritos inicialmente hacia 1937 (7), son neoplasias malignas de bajo grado, derivadas del epitelio superficial o glandular de las vías aéreas de conducción y de transición (1). Ya hacia 1960 fue comparado con los tumores carcinoides derivados de otros tejidos (7).
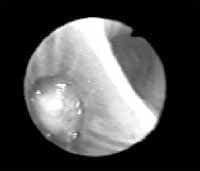
Figura 1. Tumor carcinoide endobronquial de localización central.
Los carcinoides pueden ser centrales o periféricos (2), y su localización no se relaciona con el tipo histológico del tumor. Entre un 16 – 40% de los tumores carcinoides son periféricos (8), y se localizan a nivel subpleural sin relación anatómica con el bronquio (8). De igual forma pueden aparecer asociados a la fibrosis pulmonar idiopática, así como a los adenocarcinomas (2).
Epidemiología
La incidencia de los tumores carcinoides en los Estados Unidos ha sido estimada entre 1 – 2 casos por cada 100000 habitantes, sin embargo, dado que una gran mayoría de los tumores pueden pasar asintomáticos se considera que esta debe ser mayor (5), llegando hasta 8.4 casos por 100000 habitantes, como fue descrita por Berge y cols en 1976, en un estudio relizado en Suecia, en los que se estudiaron especímines tanto quirúrgicos como de necropsias (9).
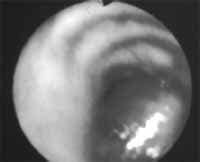
Cortesia del Dr. Carlos Garavito, Cirujano de Tórax, Hospital Santa Clare E.S.E.
Figura 2. Tumor carcinoide bronquial típico, de localización central.
Es poco frecuente y solo representa del 0.5 al 2.5% de las neoplasias pulmonares (1,3,5,8), con un total de 2000 casos nuevos por año en los Estados Unidos (7).
Si bien en algunas series se demuestra un predominio en algunas series por el sexo femenino (1.2:1.0), y en otras , como la de Torres y cols han demostrado predominancia en el sexo masculino (10) estos últimos más relacionados a los carcinoides atípicos (1), se acepta que tiene una incidencia igual en hombre que en mujeres (3,8).
Se ha descrito como edad promedio de presentación a los 50 años y un rango de edades entre los 12 – 82 años (2), variando la edad de presentación un poco dependiendo del tipo de tumor, siendo el carcinoide típico en la quinta década de la vida, y el atípico con un pico en la sexta década de la vida (5).
De otro lado se ha considerado como la neoplasia pulmonar primaria más frecuente en niños y adolescentes (1,3,8,11). Algunos grupos han observado una mayor incidencia en la raza blanca que en los afroamericanos (12,13), entre los que predomina en los hombres (7).
Etiología de tumor carcinoide bronquial
Si bien las células neuroendocrinas o de Kultschitzky (5,11) son sus precursores, el origen de su malignización no es claro, ya que a pesar de haber una gran incidencia de fumadores entre los pacientes que padecen esta patología, no se ha encontrado ninguna relación entre este hábito y la presentación de este tumor (1,7).
De igual forma se ha observado mutaciones a nivel del gen p53 en algunos carcinoides típicos y atípicos, sin embargo, su relación ha sido valorada como infrecuente (1). Otros investigadores han encontrado mutaciones puntuales del gen Ki-ras tanto en carcinoides típicos como atípicos (1).
Características anatomopatológicas del tumor carcinoide bronquial
Los tumores carcinoides se caracterizan histológicamente por las reacciones positivas a las coloraciones de plata y a los marcadores de tejido neuroendocrino. Incluyendo las enolasas neuroespecíficas, la sinaptofisina y cromogranina (5).
A pesar de haber sido considerados durante mucho tiempo como un solo grupo de tumores, en la actualidad se dividen en tres grandes grupos, dependiendo de su origen embriológico:
1- Foregut: comúnmente originados en pulmón, bronquios y estómago correspondiendo al 20% de todos los tumores carcinoides (14).
2- Midgut: originados en intestino delgado y apéndice y colon proximal.
3- Hindgut: originados en colon distal y recto.
Figura 3. Patología macroscópica de tumor carcinoide endobronquial típico de localización central.
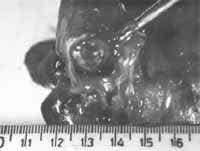
Variando de manera importante las características de cada uno (5).
Si bien el término “Carcinoide” ha sido institucionalizado para todos los tumores de origen neuroendocrino, algunos autores consideran que este término sólo debe ser acuñado para aquellos cuyo origen embriológico se encuentra en el Midgut, los otros deberían ser llamados tumores neuroendocrinos seguidos por su lugar de origen (14).
Dentro de estos tumores se incluyen el carcinoma de célula pequeña, el carcinoma neuroendocrino de célula grande, tumor carcinoide atípico, el tumor carcinoide típico, los tumorlets y la hiperplasia de células neuroendocrina difusa idiopática (15).
Los tumores centrales usualmente se localizan en los bronquios fuente o lobares, tienen características pedunculada y friables que puede ocluir totalmente o no la luz bronquial, al corte se encuentra una masa de color nácar con focos hemorrágicos (2,16). Si se encuentran focos de osificación el tumor se torna duro y áspero en las zonas donde se localizan dichos tejidos (2).
Tanto los tumores carcinoides típicos como los atípicos se caracterizan por una arquitectura organoide y morfología uniforme, estando constituidos por células moderadamente eosinófilas con núcleos de cromatina finamente granular, los nucléolos son poco prominentes, asociados a múltiples patrones histológicos, que además pueden coexistir (3). Además puede observarse en los dos invasión vascular (3).
Tumor carcinoide típico
Representan entre el 80 al 90% de todos los casos de tumor carcinoide (1). Se encuentran en un 80 – 85% en bronquios proximales, y de manera extremadamente rara a nivel traqueal (1).
Los tumores centrales tienen un tamaño medio de 3 cms y presentan componente endobronquial en forma de masa polipoide que protruye la luz (3), por lo contrario los tumores periféricos tienden a ser más pequeños, con 2.5 cms como media, están ubicados en el parénquima subpleural y a menudo no presentan relación anatómica con el bronquio (3).
Su ubicación es habitualmente intraluminal, sin embargo, un porcentaje muy bajo pueden comprometer la pared del bronquio incluso comprometiendo el cartílago extendiéndose hasta el parénquima pulmonar subyacente, con bordes muy bien definidos (1, 3)
A la observación macroscópica se encuentra una superficie que es de color amarillo tostado y con frecuencia algo carnosa, con algunos focos de hemorragia y raramente necrosis (1). En el parénquima distal se encuentran zonas de neumonía lipoide endógena (1, 3).
Figura 4. Patología microscópica de tumor carcinoide endobronquial
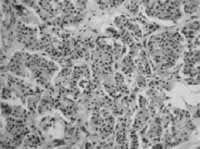
Cortesía Dra. Paulina Ojeda, Patóloga Hospital Santa Clara E.S.E.
b. Patrón trabecular (trabéculas o nidos pequeños de células separadas por un estroma fibrovascular delgado).
c. Patrón papilar.
d. Patrón folicular.
e. Patrón intersticial.
f. Patrón mixto.
La diferenciación glandular focal no es rara teniendo en las zonas intercelulares sustancias que son tanto PAS como mucicarmin positivas (1, 3). En algunas ocasiones la diferenciación glandular es extensa lo que ha llevado a utilizar el término de adenocarcinoide (1, 3).
Las células tumorales individuales tienen moderada cantidad de citoplasma ligeramente eosinófilo o claro (1). Excepcionalmente, los tumores son pigmentados y muestran pruebas ultraestructurales de producción de melanina, ya sea en las propias células tumorales o en las del estroma adyacente (1).
Los núcleos en todas las variantes histológicas son ovalados o redondeados y muestran un pleomorfismo leve, cromatina finamente punteada y nucléolos pequeños, las mitosis son escasas o están ausentes, menos de 2 mitosis por 10 campos de poder (1,16). Se ha descrito aneuploidía hasta en el 32% de los casos, la cual no se asocia necesariamente a mal comportamiento celular (3).
No son infrecuentes los focos de formación de hueso, ya sea en el estroma engrosado o en las láminas cartilaginosas adyacentes, incluso pueden ser muy extensos (1). El origen de esta metaplasia es desconocido, sin embargo, se ha sugerido que puede ser debida a la liberación de calcitonina por parte del tumor (1).
Como hallazgos excepcionales se han descrito casos asociados a hematopoyesis extramedular (17).
Los estudios inmunohistoquímicos son untilizados en la actualidad con más frecuencia para identificar diferenciación neuroendocrina (1). Entre los anticuerpos más útiles se encuentran aquellos dirigidos a cromogranina, sinaptofisina y Leu-7 (1, 3, 5).
También es posible identificar
Muchas sustancias neuroendocrinas específicas mediante inmunohistoquímica en los tumores carcinoides. Las más comunes son la serotonina, bombesina, polipéptido pancreático, VIP y leucoencefalina (1). Sin embargo, la mayor parte de los tumores muestran reactividad para más de una sustancia, incluso con diferentes aspectos histológicos para cada una de los diferentes péptidos intracitoplásmaticos (1).
Figura 5. Tumor carcinoide endobronquial de localización central.
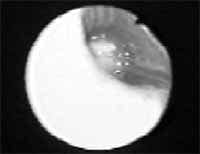
Cortesía Dr. Pedro Antonio Chaparro Mutis, Médico Internista – Neumólogo, Hospital Santa Clara E.S.E.
En la microscopía electrónica, los tumores carcinoides están compuestos por células uniformes rodeadas de láminas basales y conectadas por uniones intercelulares bien desarrolladas, siendo frecuentes las prolongaciones celulares alargadas que pueden mostrar una interdigitación compleja (1). Los gránulos neurosecretorios son abundantes (1).
Tumor carcinoide atípico
Si bien estos tumores pueden representar un extremo de una continuidad de neoplasias neuroendocrinas y no una entidad separada. Para destacar su pronóstico más ominoso han sido denominados tumor carcinoide atípico (1), representan entre el 10 y el 25% de los tumores carcinoides pulmonares (1, 2, 4, 14, 16).
Como lo definieron Arrigoni y cols, debe aplicarse el término atípico a un tumor carcinoide reconocible histológicamente cuando se presenta una o más de estas características (3,18):
a. Aumento de la actividad mitótica.
b. Pleomorfismo e hipercromasia nucleares asociados con nucléolos prominentes y aumento del cociente núcleo/citoplasma.
c. Zonas de hipercelularidad asociadas con pérdida de la arquitectura típica.
d. Necrosis.
e. La aneuploidía se describe en el 16 – 79% no relacionándose con el comportamiento biológico.
Figura 6. Patología macroscópica tumor carcinoide bronquial atípico de localización periférica
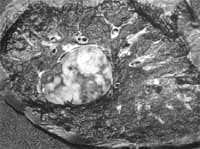
Cortesía Dra. Paulina Ojeda, Patóloga, Hospital Santa Clara E.S.E.
Algunos autores han sugerido que los carcinoides atípicos son en su gran mayoría de localización periférica, sin embargo, esta observación no ha sido conclusiva en todos los estudios; lo que si se ha observado es que el tamaño del tumor es mayor, teniendo un diámetro mayor (3.6 cms) que el de los carcinoides típicos (3), de igual forma aunque pueden ser bien delimitados puede desarrollarse infiltración tumoral al parénquima pulmonar subyacente (1).
Los gránulos neurosecretorios demostrados por análisis inmunohistoquímico o ultraestructural se presentan en cantidades menores y son de menor tamaño (1, 3).
Debido a las características neuroendocrinas del tumor, se han utilizado diferentes coloraciones histológicas en el diagnóstico del mismo, sin embargo, es el Grimelius el más usado (6,19). Sin embargo, mejores resultados se han conseguido con una combinación de prealbúmina y grimelius alcanzando una positividad hasta del 90% de los casos (20).
Manifestaciones radiológicas
Dado que entre el 80 – 85% son de localización central el hallazgo radiológico más frecuente es la evidencia de obstrucción bronquial (1). El patrón radiológico característico es aumento homogéneo de la densidad limitado a un lóbulo o segmento, asociado en la gran mayoría de los casos a una importante pérdida de volumen (1).
Figura 7. Patología microscópica tumor carcinoide bronquial atípico.
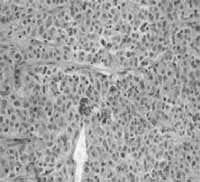
Cortesía Dra. Paulina Ojeda, Patóloga, Hospital Santa Clara E.S.E.
Los tumores carcinoides periféricos pueden presentarse como nódulos solitarios de densidad homogénea, bien delimitados, redondeados u ovalados y ligeramente lobulados con un tamaño que oscila entre 1 – 3 cms de diámetro pero pudiendo llegar incluso hasta los 10 cms, y observando calcificaciones hasta en un 10% de los casos (1,7).
En 39% de los tumores centrales y en un 8% de los periféricos se puede identificar calcificación intratumoral en la radiología (3).
En la valoración de los tumores metastásicos la radiografía convencional a pesar de ser el primer paso, cuando se correlaciona con los estudios con necropsia sólo permitió diferenciar entre tumor primario o secundario en la tercera parte de los casos (21).
La Tomografía Axial Computarizada (TAC)
Es útil en la evaluación de lo tumores de localización central que probablemente producen deformidad de la columna de aire bronquial adyacente, y para la evaluación de la presencia de la extensión de la invasión local (1).
Los estudios tomográficos han mostrado que aproximadamente un tercio de los tumores carcinoides están localizados de manera central, un tercio en la periféria y un tercio en la porción media del pulmón (16).
Puede ser difícil distinguir los tumores pequeños de los vasos pulmonares en la TAC debido al gran componente vascular de estas lesiones, usualmente bien delimitadas, y en algunas ocasiones pueden tener un componente calcificado detectable (1,7).
RNM
En la Resonancia Nuclear Magnética (RNM) son fácilmente identificables ya que los tumores tiene una intesidad de señal similar a la del músculo en las imágenes de Eco-Spin ponderadas en T2 y señal muy brillante en las imágenes de inversión-recuperación con corto tiempo de inversión (1,14).
De igual forma la Tomografía es de gran utilidad en la valoración del mediastino. Tanto para definir compromiso ganglionar metastásico, como en la determinación de la extensión de la enfermedad. Además de proveer una guía ideal para seleccionar el mejor sitio para la toma de la biopsia (14, 21).
| Producto | Enzima |
| Peptidos | Amilasa |
|
|
Bombesina Calcitonina Corticotropina Hormona liberadora de corticotropina Gastrina Glucagón Factor liberador de hormona de crecimiento Gonadotropina crónica humana Insulina Hormona estimuladora de melanocitos Motilina Neurotensina Polipéptido Pancreático Secretina Somatostatina Sustancia K Sustancia P Polipéptido intestinal Vasoactivo Vasopresina |
| Aminas Vasoactivas | Catecolaminas Histamina |
| Kininas | Bradiquininas Trequiquininas (Neuroquinina A) |
| Endorfinas y Encefalinas | β-Endorfinas Leucoencefalina Metaencefalina Pan-opiode. |
| Otras | Kalicreina Prostaglandinas |
| Dávila DG, Dunn WF, Tazelaar HD, Pairolero PC, Mayo Clinic Proc 68: 795-803,1993 | |
La gamagrafía con somatostatina marcada es un medio de investigación importante. Tanto en la enfermedad primaria como en la metastásica (14).
Los tumores carcinoides no muestran aumento de la actividad metabólica en la Tomografía con Emisión de Positrones (PET SCAN) con F-fluorodeoxiglucosa (FDG). Por tanto, con esta técnica, no pueden ser distinguidos de las lesiones benignas (1).
Asimismo, los tumores carcinoides atípicos tienden a ser más grandes y a veces alcanzan enorme tamaño, asociándose en mayor frecuencia adenopatías hiliares y mediastinales (1).
Manifestaciones clínicas del tumor carcinoide bronquial
Si bien hasta un 51% de tumores carcinoides son asintomáticos al momento del diagnóstico (8), siendo la gran mayoría de ellos, tumores carcinoides periféricos, cuando se habla de los de localización central se acompañan de una gran cantidad de signos y síntomas como resultado de la obstrucción bronquial (1).
La alta prevalencia de pacientes asintomáticos ha llevado a que hasta en 9% de los pacientes con este tumor el diagnóstico sea hecho de manera incidental durante procedimientos diagnósticos, quirúrgicos e incluso durante necropsias (7,11,14).
La rubicundez facial puede ser severa y prolongada, se puede asociar a desorientación, ansiedad, tremor, edema periorbitario, lagrimeo, salivación, hipotensión, taquicardia, disnea, asma, edema y oliguria (6). La neumonía postobstructiva es un hallazgo relativamente frecuente que puede llegar a encontrarse hasta en el 17% de los casos (3,8).
La tos, la expectoración, la fiebre y el dolor torácico se encuentran de manera frecuente. Se puede presentar hemoptísis hasta en un 50% de los pacientes. Además se describen algunos casos de edema pulmonar el cual puede llegar a ser fatal (3,6). De otro lado algunos pacientes pueden consultar por síntomas similares a los de las crisis asmáticas (1,6,7).
El dolor torácico, la disnea, se pueden encontrar hasta en el 2% de los casos (8), la tos, los derrames pleurales y las sibilancias pueden estar presentes (6,7), sin embargo, hasta en un 20% de los casos son asintomáticos (2).
Los signos físicos van a depender del grado de compromiso, así como del grado obstrucción que tenga el paciente pudiendo variar desde disminución de los ruidos respiratorios hasta la matidez, asociándose en algunas ocasiones a crepitaciones y frotes pleurales cuando se encuentra una infección asociada (1), la pérdida de peso, la astenia y la dinamia son síntomas que se presentan con relativa frecuencia en estos pacientes (7).
Figura 8. Patología microscópica de tumor carcinoide bronquial.
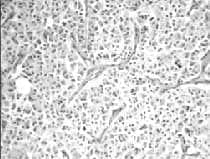
Cortesía Dr. Carlos Garavito, Cirujano de Tórax; Hospital Santa Clara E.S.E.
A pesar de las características neuroendocrinas del tumor los signos y síntomas relacionados con la presencia del tumor son característicamente infrecuentes y su presencia puede hacer pensar en una enfermedad con mayor grado de invasión (1).
El Síndrome de Cushing es la manifestación paraneoplásica más frecuente y de hecho se considera al tumor carcinoide como la causa más frecuente de Síndrome de Cushing paraneoplásico (1,3,5,6,11,22,23).
El Síndrome Carcinoide es poco frecuente con una incidencia que varía entre un 0 – 3% en unas series y hasta del 5% en otras (3,5), siendo los síntomas y signos más frecuentes: rubor, fiebre, náuseas y vómito, diarrea, hipotensión, sibilancias y disnea (18,11).
La presencia de este síndrome hace pensar en la presencia de enfermedad metastásica (2). Sin embargo, todos lo mediadores bioquímicos que se liberaron por el tumor se inactivan rápidamente, tanto por el pulmón como por el hígado (2).
La acromegalia es una manifestación frecuente de los tumores carcinoides pulmonares (3,5,11,23,24), al parecer relacionada con aumento de la secreción ectópica de hormona de crecimiento; pueden presentarse síndrome de Zollinger–Ellison y la hiperinsulinemia. O asociarse a neoplasia endocrina múltiple tipo 1 (1,3,5,11,14). Es por esto que los síndromes como la acromegalia, síndrome de Cushing y la hiperinsulinemia con hipoglicemia se documentaron en este tumor (2).
La hipercalcemia se describió en el subtipo atípico de los tumores carcinoides bronquiales pudiendo ser por la lesiones osteolíticas o por otras causas asociadas al tumor (2).
Hallazgos de laboratorio y diagnóstico
Si bien la primera aproximación diagnóstica invasiva a este tumor es a través de la fibrobroncoscopia, sólo un 60 – 77% de los tumores se ven a través de ésta (2,11,21). Corresponden a los tumores de localización central, tiene predominancia por el árbol bronquial derecho (2).
Dadas las características altamente vascularizadas de los tumores carcinoides, la decisión de tomar o no biopsias durante la broncoscopia es un dilema clínico dada la alta tasa de hemorragia derivadas de ésta. Así lo demostraron algunos estudios, como el realizado por Todd y cols, en el que se observaron 69 pacientes durante un período de 20 años, encontrando 6 casos de hemorragia grave posterior a la biopsia transbronquial, lo que hace que ésta no sea siempre posible e incluso contraindicada para ciertos grupos (7,25).
De otro lado, siendo el aspecto de características típicas; tumor hipervascularizado de superficie lisa, de localización central que puede obstruir total o parcialmente la luz bronquial; ha llevado a que el uso de la biopsia sea cada vez menor, y con las precauciones suficientes para evitar y/o controlar la complicación hemorrágica (1).
Figura 9. Tumor carcinoide endobronquial de localización central.
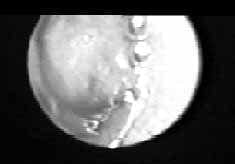
Cortesía Dr. Pedro Antonio Chaparro Mutis, Médico Internista –Neumólogo, Hospital Santa Clara E.S.E.
Otros métodos diagnósticos como la citología de esputo, así como el cepillado bronquial no tienen un buen rendimiento diagnóstico, dadas las características “encapsuladas” del tumor, ya que como debemos recordar la gran mayoría están recubiertos por epitelio bronquial normal (1,3,7,11).
La aspiración transtraqueal con aguja fina se considera en la actualidad como un método con una alta tasa de positividad y una baja tasa de complicaciones. Y, además, se debe considerar como uno de los métodos de elección (7,11,26).
Métodos diagnósticos no broncoscópicos
De otro lado, los métodos diagnósticos no broncoscópicos, como la aspiración transtraqueal con aguja fina puede brindar resultados positivos y es de utilidad sobre en todo en aquellos pacientes con lesiones periféricas (1), pero de pobres resultados en los pacientes con lesiones centrales.
La citología de esputo, al igual que la del lavado bronquial, es de pobre rendimiento diagnóstico, además dadas las características histológicas del tumor difícil de interpretar (1).
De lo anterior podemos concluir que tanto la toracotomía y resección se utilizan frecuentemente en el diagnóstico. Ya que como sabemos unos de los diagnósticos diferenciales de este tipo de tumor son los carcinomas de célula pequeña con un pronóstico más ominoso si no se diagnostican a tiempo (7).
Hallazgos de laboratorio clínico
Como hallazgos de laboratorio clínico pueden encontrarse niveles elevados de Ácido 5-Hidroxiindolacético (5-HIAA) y 5- Hidroxitriptamina (Serotonina) en la orina (1,6,7) encontrándose elevados hasta en un 25% de los pacientes.
En adición a la Serotonina, los tumores carcinoides se han encontrado como secretores de otras sustancias como la corticotropina, la histamina, la dopamina, la sustancia P, la neurotensina, la prostaglandina y la kalicreína (5). Así como otras sustancias como las enumeradas en la Tabla 5.
Asimismo, en algunos estudios se realizó el diagnóstico mediante la gamagrafía por los receptores de Somatostatina. Permitiendo tanto el diagnóstico de los tumores primarios como de los metastásicos (14,27).
En cuanto a la evaluación de la enfermedad metastásica esta se debe dirigir a órganos como el sistema nervioso central, glándulas suprarrenales, hígado y hueso como blanco de la diseminación hematógena (7). Las metástasis a ganglios hiliares y mediastinales pueden ocurrir (7).
Otro evento, es el estudio de los carcinomas neuroendocrinos que matastatizan a pulmón, en donde el estudio del primario es variado y difícil. En esta oportunidad nos enfocaremos a los de bajo grado, usualmente envuelven el hígado y se acompañan de síntomas asociados a secreción de péptidos vasoactivos (21).
A pesar de lo anterior, la evaluación de la enfermedad metastásica no es necesaria en los casos de tumores carcinoides típicos de pequeño tamaño. Dado que la resección quirúrgica conlleva un buen pronóstico por las altas tasas de curación que la acompañan (7).
La elevación persistente de 5-HIAA en orina después de la resección quirúrgica debe hacer pensar en la posibilidad de enfermedad metastásica. Y, por lo pronto debe iniciarse una rápida evaluación en búsqueda de ella (7).
Evolución, tratamiento y pronóstico del tumor carcinoide bronquial
Se sabe que la vía de diseminación de los carcinoides es a través de los linfáticos o a través de la vía hematógena, por lo mismo, tanto el tamaño, como el grado de diferenciación del primario pueden llegar a servir como factor pronóstico del desarrollo de metástasis posteriores (7).
El tratamiento de elección es la cirugía, mediante lobectomía con disección ganglionar, siempre que sea posible (3,14). El trasplante hepático es una opción cuando la enfermedad tiene componente metastásico en dicho órgano (14).
Debido al componente invasivo y metastásico que diferencia cada uno de los tipos de carcinoide, su evolución, tratamiento y pronóstico son diferentes, por lo que serán revisados de manera independiente (1).
Tumores carcinoides típicos
El pronóstico es excelente dado su escaso comportamiento invasivo lo que hace que la escisión quirúrgica sea un tratamiento curativo en la mayor parte de los casos (1, 3, 14). En un estudio realizado por Okike N y cols de 203 pacientes solo 11 tenían metástasis a ganglios regionales (14,13,28).
Asimismo, se habla de una sobrevida cercana a el 71% a los cinco años (13,28) en unas series y de hasta el 90% en otras series (3,5).
De igual forma se ha visto que aún con metástasis a distancia, las cuales pueden estar entre el 10 a 28% de los casos (3), los tumores carcinoides típicos pueden tener muchos años de supervivencia debido al crecimiento lento de la lesión, es por esta misma razón que las recidivas metastásicas pueden aparecer varios años después por lo que su seguimiento debe ser a largo plazo (incluso 20 años) (1,3).
MJ Goddard y cols describieron el primer caso de metástasis a miocardio de un tumor carcinoide típico a los 8 años de la resección del tumor primario (29), las cuales son descritas en la literatura como inusuales, teniendo una incidencia entre el 1 – 7%, y son descritas a nivel de endocardio y enfermedad valvular, con un mayor compromiso de las cavidades derechas (14,29).
Los pacientes con este tipo de tumor tienen una baja incidencia de enfermedad metastásica, menor a un 15%, siendo las más frecuentes cuando estas se encuentran en los ganglios linfáticos mediastinales, el hígado, el hueso y la piel (5).
Tratamientos conservadores
Dada las características benignas en el comportamiento de este tumor, los tratamientos conservadores pueden tener un adecuado control de la enfermedad, dentro de éstos se describen la segmentectomía, resección en manga y tratamiento locales como los realizados con láser del tipo Neodinium-YtriumAluminiumGranate (Nad-YAG) (1,26) o electrofulguración (7, 29, 30).
Estos dos últimos procedimientos se pueden realizar de manera más segura con ultrasonido endobronquial, una nueva técnica, que ayuda a delimitar más el compromiso extraluminal de las lesiones (29,30) como se puede observar en la Figuras 1 y 2.
Sin embargo, a pesar de que las resecciones a través de fibrobroncoscopia pueden llegar a lograrse, la recurrencia posterior a estos procedimientos es alta, es por esto que se siguen considerando como un procedimiento paliativo, más que curativo, por lo que no se recomienda como terapia definitiva (5).
De igual forma debemos recordar que el tratamiento quirúrgico es el tratamiento de elección y la aproximación primaria a la terapéutica de estos tumores (7, 8).
Figura 10. Fibrobroncoscopia con catéter para ultrasonido endobronquial (29).
De otro lado, no podemos olvidar que se trata de un tumor maligno, y que a pesar de ser los de menor incidencia, algunos carcinoides típicos pueden comportarse de manera agresiva, estando clasificados dentro de estos los que comprometen carina, debido a la inoperabilidad que esto conlleva (1).
Se han identificado algunos factores que se han asociado con una mayor probabilidad de tener un comportamiento agresivo como son la historia familiar de cáncer, el tamaño del tumor y la presencia de Síndrome de Cushing, relacionándose estos con peor pronóstico y una mayor tasa de enfermedad metastásica (1).
Así mismo, la presencia de anticuerpos en las células tumorales para Antigeno Carcinoembrionario (CEA), el cual se puede encontrar hasta en el 50% de los casos (31), se ha relacionado con una pobre respuesta al tratamiento (1,31).
Figura 11. Catéter de endoscopia intrabronquial, con balón inflado con agua como medio de contraste (29).
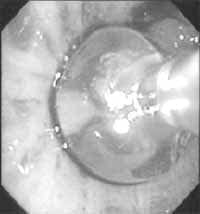
La radioterapia postquirúrgica puede estar indicada en pacientes con metástasis a ganglios linfáticos
(11), sin embargo, debe ser tenida en cuenta como un evento paliativo (7,14). En una serie de pacientes realizada por Schupak y cols sugirieron que cerca del 80% de los pacientes tratados con radioterapia tenían respuesta parcial o completa a la terapia, pero la curación en enfermedades avanzadas no era lograda (7, 14).
Figura 12. Visión ultrasonográfica endobronquial del tumor carcinoide endobronquial señalado por la flechas (29).
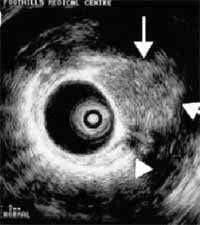
Tumores carcinoides atípicos
Al contrario de los anteriores, debido a su atipicidad histológica, su comportamiento es más agresivo y con una alta tasa de enfermedad metastásica (25 – 100%) al momento de la evaluación inicial, correspondiendo en su mayoría a compromiso de los ganglios linfáticos mediastinales, variando entre un 30 – 50% de los casos (3,5) llevando a una pobre tasa de supervivencia a los 5 años (40 – 70%) y del 35% a los 10 años (16), dependiendo del estadio al momento del diagnóstico, con una media de mortalidad relacionada en 30% y unos rangos entre el (27 – 47%) (3,5,8).
La radioterapia es recomendada en el postoperatorio de este tipo de tumores y de manera especial en aquellos con metástasis en los ganglios linfáticos regionales (11).
Casos de metástasis sistémicas
En los casos con metástasis sistémicas puede realizarse tratamiento adyuvante con estreptotozina, 5-fluorouracilo, doxorrubicina, cisplatino o etopósido (3,14). De igual forma la quimioterapia combinada, similar a la usada en los carcinomas de célula pequeña, puede producir resultados positivos hasta en el 50% de los pacientes (11).
Si bien su pronóstico es diferente, los tratamientos no difieren, pero con una menor tasa de curación (1,11).
De otro lado, cuando se trata de tumores metastásicos, el estudio difiere un poco al de los primarios, es así como la aspiración con aguja fina usualmente no provee una cantidad adecuada de material para estudio, particularmente en pacientes en los que el tumor es pobremente diferenciado (21).
La microscopía de luz ayuda a caracterizar la morfología celular y a la diferenciación del tumor, ayudado por el uso tanto de las coloraciones usuales así como de aquellas, como el mucicarmín, Alcian Blue o el PAS, que ayudan en la diferenciación de otros tipos de tumores. Sin embargo, con el advenimiento de otras técnicas, como la inmunohistoquímica han venido perdiendo su utilidad (21).
La microscopía electrónica a pesar de su alto costo puede recomendarse en la evaluación de ciertas neoplasias mal diferenciadas (21).
La quimioterapia con un solo agente ha presentado baja tasas de respuesta, las cuales se encuentran por debajo del 10% (14), por lo que no sido considerada como el tratamiento de primera línea.
Bibliografía
1. Fraser R.S., Müller N.L., Colman N, Paré P.D. Neoplasias neuroendocrinas; 4° Edición; Diagnóstico de las Enfermedades del Tórax; Editorial Panamericana; 2002: 1214 – 1234.
2. Hasleton P.F.; Bening lung tumors and their malignant counterparts; Hasleton P.F.; Spencer’s Pathology of the Lung; 5° Edition; Mc Graw-Hill; 1996: 875 – 986.
3. Aranda FI, Alenda C, Peiró FM, Peiró G. Tumores neuroendocrinos pulmonares; Rev Esp Patol; 2003; 36(4):389-404.
4. Travis WD, Colby T, Corrin B, Shimosato Y, Brambilla E. Histological typing of lung and pleural tumours; world Health Organization International Histological Classification of Tumours; 3rd ed.; Berlin: Spriger-Verlag; 1999.
5. Kulke MH, Mayer RJ. Carcinoid tumors. N Engl J Med; 1999; 340(11): 858 – 868.
6. Lips C JM, Lentjes E GWM, Höppener J WM. The spectrum of carcinoid tumours and carcinoid síndromes; Ann Clin Biochem 2003; 40: 612-627.
7. Luce JA. Lymphoma, lymphoproliferative diseases, and other primary malignant tumors; Murray JF, Nadel JA, Mason RJ, Boushey HA Jr; Text Book of Respiratory Medicine; 3° Edition; W.B. Saunders Company; 2000: 1453 – 1468.
8. Travis WD, Linder J, Mackay B. Classification, histology, citology and electron microcopy; Lung Cancer: Principles and Practice; Mitchell JB, Johnson DH, Turrisi AT; Lippincortt-Raven Publishers, 1995: 361 – 395.
9. Öberg K. Carcinoid tumors: current concept in diagnosis and treatment; The Oncologist; 1998; 3: 339 –345.
10. Torres M, Barberis M, Barbieri B, et al. Typycal and atypical bronchial carcinoids; Respir Med; 1989; 83: 305–308.
11. Johnson BE, Chute JP. Extrapulmonary syndromes associated with lung tumors; Fishman AP, Elias JA, Fishman JA, Grippi MA, Kaiser LR, Senior RM; Fishman’s Pulmonary Diseases and Disorders; 3° Edition; Mc Grauw-Hill; 1997; 1833 –1840.
12. Godwin JD II. Carcinoid tumors. an analysis of 2837 cases; Cancer; 1975;36: 560.
13. Giustra PE, Stassa G. The multiple presentation of bronchial adenomas; Radiology; 1969; 93: 1013.
14. Megyesi M, Berta M, Khoor A. Endobronchial large cell neuroendocrine carcinoma; Path Onc Research; 2003; 9(3):198-200.
15. Franklin WA. Diagnosis of lung cancer, pathology of invasive and preinvasive neoplasia; chest 2000; 117: 80S-89S.
16. Pavlidis N, Briasoulis E, Hainswort J, Greco FA. Diagnostic and therapeutic management of cancer of an unknown primary; Eur J Of Cancer; 2003; 39: 1990-2005.
17. Lara JF, Rosen PP. Extramedullary hematopoiesis in a bronchial carcinoid tumor . an unusual complication of angiogenic myeloid metaplasia; Arch Pathol Lab Med; 1990; 114: 1283.
18. Arrigoni MG, Woolner LB, Bernatz PE. Atypical carcinoid tumors of the lung; J Cardiovasc Thorac Surg;1972; 64:413.
19. Okike N, Bernatz PE, Woolner LB. Carcinoid tumors of the lung; Ann Thorac Surg; 1976; 22: 270.
20. Suresh UR, Wilkes S, Hasleton PS, et al. Prealbumin in the diagnosis of bronchopulmonary carcinoid tumours; J Clin Pathol; 1991; 44: 573.
21. Goddard MJ, Atkinson C. Cardiac metastasis from a bronchial carcinoid: report of a case presenting with diffuse thickening of the left ventricular wall; J Clin Pathol; 2004; 57: 778 – 779.
22. Pass HI, Doppman JL, Nieman L, et al. Management of the ectopic acth syndrome due to thoracic carcinoids; Ann Thorac Surg; 1990; 50:52.
23. Scheithauer BW, Carpenter PC, Bloch B, Brazeau P. Ectopic secretion of growth hormone-releasing factor, report of a case of acromegaly with bronchial carcinoid tumor; Ann J Med; 1984; 76: 605.
24. Keller SM, Katariya K. Primary lung tumors other than bronchogenic carcinoma: benign and malignant; Fishman AP, Elias JA, Fishman JA, Grippi MA, Kaiser LR, Senior RM; Fishman’s Pulmonary Diseases and Disorders; 3° Edition; Mc Grauw-Hill; 1997; 1833 –1840.
25. Todd TR, Cooper JDWeissberg D, et al. Bronchial carcinoid tumors: 20 years experience; J Thorac Cardiovasc Surg; 1980; 79: 532.
26. Wang KP; Mehta AC, Turner JF Jr. Flexible bronchoscopy; 2nd Edition; Blackwell Publishing; 2004.
27. Kvols LK, Brown ML, O’Connor MK, et al. Evaluation of radiolabeled somatostatin analog (1 –123 ocreotide) in the detection and localization of carcinoid and islet cell tumors; Radiology 1993; 187: 129.
28. Bishopric GA Jr, Ordonez NG. Cacinoembrionic antigen in primary carcinoid tumor of the lung; Cancer; 1982; 58: 1316.
29. Tremblay A. Endobronchial ultrasonography: extending the reach oo the bronchoscope beyond the airway wall; JAMC; 2003; 6:169.
30. Berge T, Linell F; Carcinoid tumours: frequency in a defined population during a 12-year period. Acta Pathol Microbiol Scand (A); 1976; 84: 322-330.
31. Hasleton PS, al-Saffar N. The histological spectrum of bronchial carcinoid tumours; Appl Pathol; 1989; 7:205.
32. Schupak KD, Wallner KE. The role of radiation therapy in the treatment of locally unresectable or metastasic carcinoid tumors; Int J Radiatr Oncol Biol Phys; 1991; 20: 489 – 485.