Resumen
Introducción
Es importante contar con una definición precisa del síndrome de dificultad respiratorio agudo (SDRA) en pacientes pediátricos, para así determinar su verdadera incidencia, los factores asociados con su desarrollo, plantear estrategias preventivas e iniciar un manejo temprano que mejoren el pronóstico de la enfermedad. (Lea también: Criptococosis Pulmonar. Revisión de 10 años de Experiencia Hospital Santa Clara E.S.E)
Objetivo
El objetivo del presente estudio fue validar la definición de SDRA de la American Thoracic Society y la European Society of Intensive Care Medicine (ATS-ESICM) en pacientes pediátricos.
Diseño
Estudio de pruebas diagnósticas.
Materiales y métodos
Todos los pacientes que fallecieron en la Unidad de Cuidados Intensivos Pediátrica del Hospital Santa Clara entre enero de 1996 y diciembre de 2002, y se les realizó autopsia, se incluyeron en el estudio. Se registró para cada paciente el menor valor de PaO2/FiO2, la presencia de infiltrados en la radiografía de tórax, la presencia de edema pulmonar cardiogénico y el diagnóstico patológico de SDRA como patrón de oro.
Admás, se calculó la sensibilidad, especificidad, valores predictivos y likelihood ratio de la definición de SDRA de la ATS-ESCIM. Se estableció el mejor punto de corte de la PaO2/FiO2, para discriminar a los pacientes con y sin SDRA determinando la mayor área bajo la curva COR.
Resultados
Se incluyeron 34 pacientes en el estudio. La definición de SDRA de la ATS-ESCIM tuvo una sensibilidad del 80.7%. Una especificidad del 71.4%. Un valor predictivo positivo del 91.3%. Un valor predictivo negativo del 50% y un likelihood ratio de 2.82 al compararla con el diagnóstico patológico de SDRA.
El mejor punto de corte del valor de PaO2/FiO2 para discriminar a los pacientes con y sin SDRA que cumplieran los otros 2 criterios de la definición de la ATS-ESCIM fue de 150.
Conclusiones
Aunque la definición de SDRA de la ATS-ESCIM parece discriminar de manera adecuada a los pacientes pediátricos con y sin SDRA, la dirección de los sesgos de nuestro estudio sugiere que la definición tiene solo una aceptable capacidad de detectar a los pacientes con SDRA. Se requieren estudios posteriores sobre el tema en pacientes pediátricos para confirmar nuestros hallazgos.
Palabras clave: Síndrome de dificultad respiratoria aguda. Validación. Pediatría.
Carlos Rodríguez Martínez, MD*; María Claudia Guzmán, MD**;
Juan Manuel Castillo, MD***; Mónica Patricia Sossa;**** Paulina Ojeda, MD.*****
* Neumólogo Pediatra Hospital Santa Clara – Organización Sánitas Internacional.
** Médico Pediatra. Jefe de la Unidad de Cuidados Intensivos Pediátrica Hospital Santa Clara.
*** Neumólogo Pediatra Fundación Valle de Lilly.
**** Residente de primer año de Medicina Interna Universidad El Bosque – Hospital Santa Clara.
***** Médico patólogo. Jefe Departamento Patología – Hospital Santa Clara.
Correspondencia a: Dra. María Claudia Guzmán. Unidad de Cuidados Intensivos Pediátrica. Hospital Santa Clara
Cra. 15 No. 1-59 sur. Fax 3283106. E-mail mcguzmandi@yahoo.com.mx
Abstract
Introduction
It is important to account with a definition of ARDS validated in pediatric patients to allow to assess its true incidence, factors associated with its development, and to indentify patients at early stages of their clinical course to begin supportive treatment.
Objective
The objective of the present study was to validate the ARDS definition of American Thoracic Society and the European Society of Intensive Care Medicine (ATS-ESICM) in pediatric patients.
Design
A study of a diagnostic test.
Material and methods
All the patients that die out in the Pediatric Intensive Care Unit in Santa Clara Hospital among January of 1996 and December of 2002, and was carried out them autopsy, were included in the study.
It was registered for each patient the minor PaO2/FiO2 value, presence of bilateral pulmonary infiltrates, evidence of left heart failure, and autopsy reports of the patients as a “gold standard” for the detection of the presence ARDS.
We compared the clinical diagnosis or ARDS with the autopsy diagnosis or ARDS by three criteria: sensitivity; specificity, with their 95% confidence intervals; and likelihood ratio (LR).
The best cutoff threshold value of PaO2/FiO2 to discriminate patients with and without diagnosis or ARDS, was indentified by the value giving the best combination of sensitivity and specificity and the best area under the ROC curve.
Results
We included 34 patients in the study. The definition of SDRA of the ATS-ESCIM had a sensibility of 80.7%, a specificity of 71.4%, a positive predictive value of 91.3%, a negative predictive value of 50% and a likelihood ratio of 2.82 comparing it with the pathological diagnosis of SDRA. The best cutoff point of PaO2/FiO2 value to discriminate patients with and without ARDS was 150.
Conclusions
The definition of ARDS of the ATS-ESCIM seems to discriminate in an acceptable way pediatric patients with and without SDRA although, the direction bias of our study suggests that the definition has an acceptable capacity to detect patients with SDRA. Subsequent studies are required in pediatric patients to confirm our finds.
Key words: Acute respiratory distress syndrome. Validation. Pediatrics.
Introducción
El Síndrome de Dificultad Respiratoria Aguda (SDRA) es una entidad clínicamente definida que describe la severidad del daño alveolar producido por daño pulmonar directo o indirecto (1).
Los eventos desencadenantes más frecuentes comprenden el shock de cualquier etiología, sepsis, neumonía viral o bacteriana, casi ahogamiento, neumonitis aspirativa, y trauma (2).
En 1967 se describió por primera vez el síndrome como una entidad clínica definida por Ashbaugh y cols (3), quienes reportaron un grupo de 12 pacientes con alteración en la oxigenación, infiltrados bilaterales en la radiografía de tórax, y disminución en la distensibilidad pulmonar.
En una Conferencia Consenso de SDRA en 1992, la American Thoracic Society y la European Society of Intensive Care Medicine (ATS-ESICM) (4) decidieron que el síndrome debería volver a denominarse de dificultad respiratoria “aguda” (en lugar de síndrome de dificultad respiratoria del “adulto”) debido al reconocimiento del hecho de que podía ocurrir en pacientes de cualquier edad (5).
El SDRA se caracteriza clínicamente por un inicio agudo, hipoxemia severa, infiltrados bilaterales en la radiografía de tórax y edema pulmonar no cardiogénico (6).
Definiciones SDRA
En los últimos años se han propuesto nuevas definiciones de SDRA que potencialmente identifican de una manera más temprana a los pacientes con daño pulmonar agudo (6). El consenso de la ATS-ESICM estandarizó la definición de SDRA y definió la diferencia entre el daño pulmonar agudo y el SDRA con base en el grado de alteración de la oxigenación (4).
La definición de SDRA se estandarizó como la presencia de infiltrados bilaterales de comienzo agudo en la radiografía de tórax; hipoxemia severa (PaO2/FiO2<200), independiente del nivel de presión positiva al final de la espiración (PEEP); y una presión pulmonar en cuña menor 18 cm H2O o, en ausencia de un catéter de arteria pulmonar, ausencia de evidencia clínica de hipertensión auricular izquierda (4).
Aunque esta definición ha sido útil en estudios epidemiológicos, han surgido algunos problemas con su implementación. En primer lugar, se ha argumentado que esta definición no refleja la verdadera severidad del daño pulmonar debido a que para la valoración del grado de hipoxemia no se tiene en cuenta el nivel de PEEP aplicado al paciente (7).
Adicionalmente, a pesar de que hay algún grado de evidencia de que el SDRA en los pacientes pediátricos es diferente al de los adultos (8,9), esta definición no ha sido validada para su uso en pacientes pediátricos.
Es importante contar con una definición validada de SDRA en pacientes pediátricos, para de esta manera identificar a los pacientes en los estadios iniciales del curso clínico del síndrome, e iniciar de manera temprana el tratamiento de soporte.
El objetivo del presente estudio fue validar la definición de SDRA de la ATS-ESICM en pacientes pediátricos críticamente enfermos admitidos a una Unidad de Cuidados Intensivos Pediátrica (UCIP) en Bogotá. Un objetivo secundario del estudio fue establecer el mejor punto de corte del valor de PaO2/FiO2 para discriminar a los pacientes con y sin el diagnóstico de SDRA.
Materiales y métodos
Se estudiaron a los pacientes que ingresaron a la UCIP del Hospital Santa Clara, fallecieron. En consecuencia se les realizó autopsia, entre enero de 1996 y diciembre de 2002.
La recolección de la información clínica y radiológica se realizó mediante la revisión de las historias clínicas de los pacientes por uno de los investigadores.
Los datos clínicos recolectados incluyeron la edad, sexo, antecedente de enfermedad pulmonar crónica del recién nacido, días de ventilación mecánica, días de estancia en la UCIP, factores de riesgo conocidos para la presencia de SDRA, la presencia de sepsis y la presencia de desnutrición. Se incluyeron además los criterios especificados en la definición de SDRA de la ATS-ESICM (Valor de PaO2/FiO2
Hallazgos patológicos
Los hallazgos patológicos de daño alveolar difuso, edema intersticial e intraalveolar, y membrana hialina se consideraron como el patrón de oro para la presencia de SDRA.
El médico patólogo que realizó las autopsias y reportó los hallazgos histológicos a nivel pulmonar tiene varios años de experiencia en el análisis histológico de las muestras de tejido pulmonar.
El investigador que recolectó la información clínica y radiológica no conoció al momento de la recolección de los datos los hallazgos de la patología pulmonar. Sin embargo, el médico patólogo si tuvo conocimiento de la sospecha clínica de SDRA en el momento en el que realizó las autopsias y analizó el tejido pulmonar de cada uno de los pacientes.
Análisis estadístico
El análisis estadístico se realizó con el paquete estadístico SPSS versión 10.0 (Chicago, Illinois, USA). Las diferencias entre las variables categóricas de acuerdo a la presencia o no de SDRA se analizaron mediante las pruebas de chi cuadrado o el test exacto de Fisher. Según fuera oportuno.
Las diferencias entre las variables continuas de acuerdo a la presencia o no de SDRA se analizaron mediante las pruebas t de student para muestras independientes o la U de Mann-Whitney, según fuera oportuno.
Se calculó la sensibilidad, especificidad, valores predictivos positivo y negativo, likelihood ratio y sus respectivos intervalos de confianza del 95% (IC 95%) del diagnóstico clínico de SDRA comparado con el diagnóstico patológico.
El mejor punto de corte del valor de PaO2/FiO2 para discriminar a los pacientes con y sin SDRA se determinó mediante la mejor combinación de sensibilidad, especificidad y la mayor área bajo la curva de características operativas para el receptor (COR).
Las curvas COR se obtuvieron al graficar la frecuencia de verdaderos positivos (sensibilidad) y la frecuencia de falsos positivos (1-especificidad) a lo largo de los ejes vertical y horizontal, respectivamente.
Se calcularon las áreas bajo la curva y los errores standard. Todos los test estadísticos fueron de dos colas y llevados a un nivel de significancia de 0.05. El estudio fue aprobado por el Comité de Ética del Hospital Santa Clara.
Resultados
Durante el período de estudio, en la UCIP del Hospital Santa Clara fallecieron y se les realizó autopsia a 34 pacientes. Del total de pacientes, 20 (58.8%) fueron de sexo masculino, y los restantes 14 (41.2%) fueron de sexo femenino.
La mediana (rango intercuartílico) de la edad fue 4 meses (rango, 2.75-10.0), y de los 34 pacientes, el 82.3% fueron menores de un año, el 2.9% tenían entre 12 y 24 meses, y el 14.8% restante fueron pacientes mayores de 24 meses.
Tomando como referencia los hallazgos patológicos, se hizo diagnóstico de SDRA en 26 (76.5%) de los 34 pacientes incluidos en el estudio. En la Tabla 1 se resumen las principales características de los pacientes, estratificados de acuerdo al diagnóstico patológico de SDRA.
Una proporción significativamente mayor de los pacientes con diagnóstico patológico de SDRA fueron de sexo masculino (p=0.04). La PaO2/FiO2 de los pacientes con diagnóstico patológico de SDRA fue menor que la de los pacientes sin este diagnóstico, aunque esta diferencia no fue estadísticamente significativa (Tabla 1).
Tabla 1. Características de los pacientes incluidos en el estudio, estratificados de acuerdo al diagnóstico patológico de SDRA.
| 1. Pacientes con SDRA (n=26) |
2. Pacientes sin SDRA (n=8) |
Valor de p | |
| Edad (meses) | 5.5 (2.7 – 10.2)* | 3.5 (2.2 – 4.7) | 0.22 |
| Sexo | > | ||
| Masculino | 18 (69%) | 2 (25%) | 0.04 |
| Femenino | 8 (31%) | 6 (75%) | |
| Estancia en UCIP | 2.0 (1.0 – 6.0)* | 1.0 (1.0 – 6.5) | 0.59 |
| Días de ventilación mecánica | 1.0 (1.0 – 5.25)* | 1.0 (1.0 – 6.5) | 0.98 |
| Antecedente de EPCRN + | 4 (15%) | 2 (25%) | 0.60 |
| Factores de riesgo para SDRA | 20 (77%) | 5 (62%) | 0.64 |
| Sepsis | 25 (96%) | 6 (75%) | 0.13 |
| Desnutrición | 15 (57%) | 4 (50%) | 0.70 |
| PaO2/FiO2 | 54.5 (45.0 – 78.2)* | 88.0 (50.0 – 191.0) | 0.14 |
* Mediana (Rango intercuartílico)
+ EPCRN: Enfermedad pulmonar crónica del recién nacido.
Se calculó la sensibilidad, especificidad, valores predictivos positivo y negativo, likelihood ratio y sus respectivos intervalos de confianza del 95% (IC 95%) del diagnóstico clínico de SDRA (valor de PaO2/FiO2 <200, presencia de infiltrados bilaterales en la radiografía de tórax, y ausencia de evidencia clínica de hipertensión auricular izquierda) comparado con el diagnóstico patológico.
El 80.7% de los pacientes con diagnóstico patológico de SDRA fueron correctamente identificados como tal con esta definición de SDRA clínico (sensibilidad). Y los pacientes con SDRA clínico según esta definición, tuvieron una probabilidad del 91.3% de tener diagnóstico patológico de SDRA (valor predictivo positivo).
Sin embargo, la especificidad (71.4%) y el valor predictivo negativo (50.0%) de esta definición de SDRA fueron menores que la sensibilidad y que el valor predictivo positivo. (Tabla 2).
Tabla 2. Sensibilidad, especificidad, valores predictivos positivo y negativo y likelihood ratio de dos definiciones de SDRA
| Sensibilidad | Especificidad (IC 95%) |
VPP* (IC 95%) |
VPN+ (IC 95%) |
Likelihood ratio (IC 95%) |
|
| 1. SDRA clínico + | 80.7 (60 – 92) | 71.4 (30 – 95) | 91.3 (70 – 98) | 50.0 (20 – 78) | 2.82 |
| 2. SDRA clínico s | 80.7 (60 – 92) | 85.7 (42 – 99) | 95.4 (75 – 99) | 54.5 (25 – 82) | 5.65 |
* VPP:
+ VPN:
++ SDRA definido como presencia de infiltrados bilaterales, ausencia de evidencia clínica de hipertensión auricular izquierda y un valor de PaO2/FiO2<=200.
ss SDRA definido como presencia de infiltrados bilaterales, ausencia de evidencia clínica de hipertensión auricular izquierda y un valor de PaO2/FiO2<= 150.
Para establecer el mejor punto de corte del valor de PaO2/FiO2 para discriminar a los pacientes con y sin SDRA se determinó la mejor combinación de sensibilidad, especificidad y la mayor área bajo la curva COR del valor de PaO2/FiO2 en los pacientes con infiltrados pulmonares y ausencia de evidencia clínica de hipertensión aurícular izquierda.
El mejor punto de corte fue un valor de PaO2/FiO2 = 150, con una sensibilidad de 95% y especificidad de 66.6%, y un área bajo la curva COR de 0.81 (ES, 0.17) ( Figura 1).
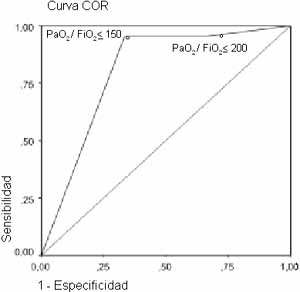
Figura 1. Curva de características operativas para el receptor (COR) del nivel de PaO2/FiO2 en pacientes con infiltrados pulmonares y ausencia de evidencia clínica de hipertensión auricular izquierda. El mejor punto de corte fue un valor de PaO2/FiO2 <= 150, con una sensibilidad de 95% y especificidad de 66.6%, y un área bajo la curva COR de 0.81 (ES, 0.17).
Posteriormente se calculó nuevamente la sensibilidad, especificidad, valores predictivos positivo y negativo, likelihood ratio y sus respectivos intervalos de confianza del 95% (IC 95%) del diagnóstico clínico de SDRA (basado en el mejor punto de corte hallado del valor de PaO2/FiO2.
Es decir, definido como valor de PaO2/FiO2 <150, presencia de infiltrados bilaterales en la radiografía de tórax, y ausencia de evidencia clínica de hipertensión auricular izquierda) comparado con el diagnóstico patológico.
Con esta definición de SDRA aumentaron la especificidad, el valor predictivo positivo, el valor predictivo negativo y el likelihood ratio que se habían calculado con la primera definición (Tabla 2).
Discusión
El SDRA se caracteriza clínicamente por un inicio agudo, hipoxemia severa, infiltrados bilaterales en la radiografía de tórax y edema pulmonar no cardiogénico (6).
Desde su descripción como una entidad clínica definida en la década de los 60 (3), se han propuesto varias definiciones (10-14), en un intento de mejorar la sensibilidad y la especificidad, para detectar tempranamente casos de verdadero SDRA, y excluir a los pacientes que no tienen daño pulmonar agudo (14).
De estas definiciones, una de las más aceptadas y utilizadas tanto en pacientes adultos como en pacientes pediátricos, es la propuesta en 1992 en la Conferencia Consenso Americana-Europea de SDRA (ATS-ESICM) (4), a pesar de los problemas que algunos autores han reportado con su utilización e implementación (2,7,15).
Se ha descrito que el SDRA en respuesta a infecciones virales es mucho más común en pacientes pediátricos que en adultos (8), con hallazgos histológicos diferentes y con un mejor pronóstico que el SDRA desencadenado por otras causas más frecuentes en adultos (9,16,17).
Estos hechos sugieren que, al menos en algunos casos, el SDRA de los pacientes pediátricos es diferente al de los pacientes adultos, e indican la necesidad de disponer de una definición validada en los primeros.
Sensibilidad y especificidad de una prueba
Para calcular la sensibilidad y la especificidad de una prueba, es necesario conocer quien tiene “realmente” la enfermedad mediante una fuente distinta a la prueba que se está usando (18), denominada el patrón de oro.
Aunque otros autores han validado la definición de SDRA de la ATS-ESICM en adultos (14), el patrón de oro que han utilizado han sido otras definiciones más estrictas que la de la ATS-ESCIM (14,15).
Sin embargo, aunque el uso de otra prueba que ya ha sido utilizada es un método válido para validar una prueba (18), estas definiciones más estrictas no carecen de muchos de los problemas reportados con la definición de la ATS-ESCIM.
Por ejemplo, ni el Lung Injury Severity Score (LISS) (13), ni la definición estricta de SDRA propuesta por Moss M y cols (14) incluyen los marcadores bioquímicos de inflamación que otros autores refieren que son tan importantes para reconocer que realmente se trata de un SDRA y no de otra patología con características clínicas y radiológicas similares (15,19).
Además se ha descrito una alta variabilidad interobservador en la interpretación de los criterios radiológicos de SDRA (20), la cual es una limitación que se presenta también al aplicar las definiciones más estrictas.
Hallazgos histológicos
Por estos motivos decidimos considerar los hallazgos histológicos de daño alveolar difuso, edema intersticial e intraalveolar, y membrana hialina como el “patrón de oro” para la presencia de SDRA.
Tomando estos hallazgos histológicos como patrón de oro para la presencia de SDRA, encontramos que la definición de SDRA de la ATS-ESCIM tiene una adecuada sensibilidad (80.7%), pero una especificidad menor (71.4%).
Es decir, esta definición tendría una adecuada utilidad para identificar correctamente a los pacientes pediátricos con diagnóstico de SDRA, y una menor utilidad para identificar correctamente a los pacientes que no tienen la patología.
Esta sensibilidad y especificidad de la definición es menor a la reportada en la literatura en pacientes adultos (14). Sin embargo, hay que tener en cuenta que se puede estar cometiendo un sesgo de espectro (21), debido a que en el estudio estamos incluyendo sólo a pacientes que fallecieron.
Este hecho hace probable que nuestros pacientes sean una subpoblación de pacientes con patologías más severas y posiblemente SDRA de mayor severidad que el promedio de pacientes pediátricos que presentan la entidad.
La dirección de este sesgo podría haber sobreestimado la sensibilidad y subestimado la especificidad de la definición de la ATS-ESCIM (Debido a que en pacientes con patología más severa aumenta la probabilidad de hacer el diagnóstico, aumentando la sensibilidad y disminuyendo la especificidad) (21).
Definición de SDRA de la ATS-ESCIM
La definición de SDRA de la ATS-ESCIM tuvo un valor predictivo positivo alto (91.3%); es decir, los pacientes con SDRA clínico según esta definición, tuvieron una alta probabilidad de tener diagnóstico patológico de SDRA.
Sin embargo, este valor predictivo positivo alto pudo haber sido debido en parte a la alta prevalencia de SDRA en nuestra población (76.5%), y para su aplicación en otro contexto, es necesario tener en cuenta la prevalencia de la entidad en la población que se esté estudiando (18).
Al determinar el mejor punto de corte del valor de PaO2/FiO2 para discriminar a los pacientes con y sin SDRA, encontramos que en nuestros pacientes con infiltrados pulmonares de comienzo agudo y ausencia de evidencia clínica de hipertensión auricular izquierda, este mejor punto de corte fue un valor de PaO2/FiO2 de 150.
Es decir que los pacientes que cumplieron los otros dos requisitos de la definición de SDRA de la ATS-ESCIM, el nivel de hipoxemia que mejor identificó a la presencia de SDRA fue un valor de PaO2/FiO2 aumentó muy levemente la sensibilidad, y disminuyó en forma más significativa la especificidad (22).
Sin embargo son diferentes a los hallazgos de Moss M y cols, quienes crearon el modified Lung Injury Score (14), el cual tiene los mismos criterios que la definición de SDRA de la ATS-ESCIM, excepto un menor nivel de hipoxemia (PaO2/FiO2 entre 100 y 174).
Modified Lung Injury Score vs SDRA de la ATS-ESCIM
Al comparar el modified Lung Injury Score con la definición de SDRA de la ATS-ESCIM, encontraron que las dos definiciones de SDRA tuvieron la misma sensibilidad y especificidad respecto a otra definición de SDRA más estricta (14).
Aunque una definición clínica de SDRA que incluya un valor de PaO2/FiO2 < 150 parece discriminar mejor a los pacientes pediátricos con y sin SDRA que la definición de la ATS-ESCIM, hay que tener en cuenta que este menor valor del grado de hipoxemia del paciente también puede ser debido a la mayor severidad del SDRA que suponemos tuvieron nuestros pacientes.
Las limitaciones de nuestro estudio comprenden la mencionada falta de inclusión de pacientes con SDRA de menor severidad, lo que puede haber sobreestimado la severidad y subestimado la especificidad de la definición de la ATS-ESCIM.
Además esta mayor severidad de los pacientes incluidos en nuestro estudio, podría haber determinado el menor punto de corte del valor de PaO2/FiO2 respecto a la definición de la ATS-ESCIM que hallamos.
Otra limitación de nuestro estudio fue que el investigador que determinó la presencia de SDRA clínico no conoció el diagnóstico patológico, pero quien hizo el diagnóstico patológico de SDRA, si conoció el diagnóstico o por lo menos la sospecha clínica de SDRA.
Este hecho podría haber sobreestimado la incidencia de SDRA, y por tanto el valor predictivo positivo de la definición de la ATS-ESCIM.
En conclusión, aunque la definición de SDRA de la ATS-ESCIM parece discriminar de manera adecuada a los pacientes pediátricos con y sin SDRA, la dirección de los sesgos de nuestro estudio sugiere que la definición tiene solo una aceptable capacidad de detectar a los pacientes con SDRA. Se requieren estudios posteriores sobre el tema en pacientes pediátricos para confirmar nuestros hallazgos.
Bibliografía
1. Paulson TE, Spear RM, Peterson BM. New concepts in the treatment of children with acute respiratory distress syndrome. J Pediatr 1995; 127: 163-75.
2. Abraham E, Matthay MA, Dinarello CA, et al. Consensus conference definitions for sepsis, septic shock, acute lung injury, and acute respiratory distress syndrome: Time for a reevaluation. Crit Care Med 2000; 28:232-35.
3. Ashbaugh DG, Bigelow DB, Petty TL, et al. Acute respiratory distress in adults. Lancet 1967; 2:319-23.
4. Bernard GR, Artigas A, Brigham KL, et al. The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med 1994; 149: 818-24.
5. Goh AY, Chan PW, Lum LC, Roziah M. Incidence of acute respiratory distress syndrome: a comparison of two definitions. Arch Dis Child 1998; 79: 256-59.
6. Knaus WA, Sun X, Hakim RB, Wagner DP. Evaluation of definitions for adult respiratory distress syndrome. Am J Respir Crit Care Med 1994; 150: 311-7.
7. Villar J, Perez-Mendez L, Kacmarek RM. Current definitions of acute lung injury and the acute respiratory distress syndrome do not reflect their true severity and outcome. Intensive Care Med 1999; 5: 930-35.
8. Hammer J. Acute lung injury. Pathophysiology, assessment and current therapy. Paediatric Respiratory Reviews 2001; 2:124-30.
9. Walker TA, Khurana S, Tilden SJ. Viral Respiratory infections. Pediatr Clin North Am 1994; 41: 1365-81.
10. Sloane PJ, Gee MH, Gottlieb JE, et al. A multicenter registry of patients with acute respiratory distress syndrome: Physiology and outcome. Am Rev Respir Dis 1992; 146: 419-26.
11. Fowler AA, Hamman RF, Good JT, et al. Adult respiratory distress syndrome: Risk with common predispositions. Ann Intern Med 1983; 98: 593-97.
12. Pepe PE, Potkin RT, Reus DH, et al. Clinical predictors of the adult respiratory distress syndrome. Am J Surg 1982; 144: 124-30.
13. Murray JF, Matthay MA, Luce JM, et al. An expanded definition of the adult respiratory distress syndrome. Am Rev Respir Dis 1988; 138: 720-23.
14. Moss M, Goodman PL, Heining M, et al. Establishing the relative accuracy of three new definitions of the adult respiratory distress syndrome. Crit Care Med 1995; 23: 1629-37.
15. Abraham E. Toward new definitions of acute respiratory distress syndrome. Crit Care Med 1999; 27: 237-8.
16. Hammer J, Numa A, Newth CJ. Acute respiratory distress syndrome caused by respiratory syncitial virus. Pediatr Pulmonol 1997; 23: 176-83.
17. Tasker RC, Grdon I, Kiff K. Time course of severe respiratory syncitial virus infection in mechanically ventilated infants. Acta Paediatr 2000; 89: 938-41.
18. Gordis L. Epidemiology. Second edition. Philadelphia, W.B. Saunders Company, 2000.
19. Pugin J, Verghese G, Widmer MC, Matthay MA. The alveolar space is the site of intense inflammatory and profibrotic reactions in the early phase of acute respiratory distress syndrome. Crit Care Med 1999; 27: 304-12.
20. Rubenfield GD, Caldwell ME, Granton J, Hudson LD, Matthay M. Interobserver variability in applying a radiographic definition for ARDS. Chest 1999; 116: 1347-53.
21. Knott nerus JA, Van Weel C, Muris JWN. Evaluation of diagnostic procedures. BMJ 2002; 324: 477 – 80.
22. Meade MO, Guyatt GO, Cook RJ, et al. Agreement between alternative classifications of acute respiratory distress syndrome. Am J Crit Care Med 2001; 163: 490 -93.