Sangrado Uterino Anormal
Endocrinología Ginecológica
¿Es la iatrogenia más frecuente de lo que comúnmente conocemos?
LEONARDO JOSÉ GONZÁLEZ GARCÍA*, MD FACOG
Generalidades
El sangrado uterino anormal (SUA) es un espectro muy amplio que incluye sangrado vaginal aumentado cíclico, acíclico e intermensual. Es una patología que afecta directamente los roles físicos, sociales, emocionales y otros de la cotidianidad de las mujeres y tiene usualmente un impacto negativo en la calidad de vida y la productividad1,2.
Es una condición extremadamente frecuente, siendo más prevalente en mujeres adolescentes y en mujeres en su cuarta y quinta década de la vida.
Y es presumible que el no entendimiento de esta patología por parte de los prestadores de salud puede agravar la situación llevando a intervenciones que podrían ser no necesarias, y que podrían acarrear eventos iatrogénicos, que si bien pueden aliviar síntomas de manera temporal, finalmente generan problemas futuros.
Es una patología con un fuerte impacto reproductivo y en la calidad de vida de la paciente, que puede traer repercusiones económicas importantes, no solo para las pacientes, sino también para los sistemas de salud3.
Se calcula que hasta el 30% de las mujeres estarán afectadas en algún momento de su vida por alguna manifestación asociada con alteración del patrón menstrual4; se conoce que menos de la mitad buscan atención médica porque consideran que es una condición normal, siendo la mayoría de las consultas por información entregada en este sentido, por su prestador de salud primario y en algunas ocasiones por el especialista ginecólogo ; esto, sin duda, es una causa de iatrogenia por omisión de SUA2.
Consecuentemente, se genera uno de los efectos mórbidos del sangrado uterino anormal, que es la anemia y que conlleva efectos negativos en la vida reproductiva y aumenta la morbilidad y mortalidad obstétrica5.
El comité de desórdenes menstruales de la Federación Internacional de Ginecología y Obstetricia (FIGO):
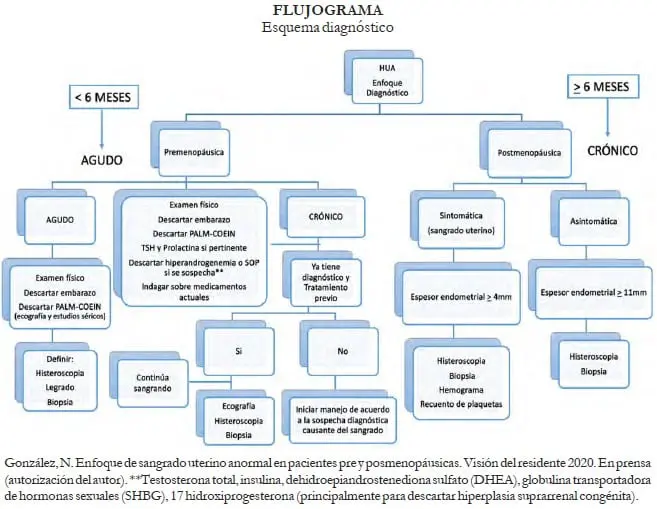
Propuso desde 2011, y revisada en el 2018, una clasificación dual que incluye un sistema de nomenclaturas y uno de causas. Es importante diferenciar el sangrado uterino no obstétrico agudo del crónico.
El sangrado uterino agudo es un episodio único de sangrado anormal que es lo suficientemente severo como para requerir una intervención prioritaria o urgente para que disminuya la pérdida excesiva de sangre.
El sangrado uterino crónico es el que tiene más de 6 meses de evolución y depende del cuerpo uterino. No solo es anormal en duración sino también en volumen, frecuencia o regularidad menstrual4.
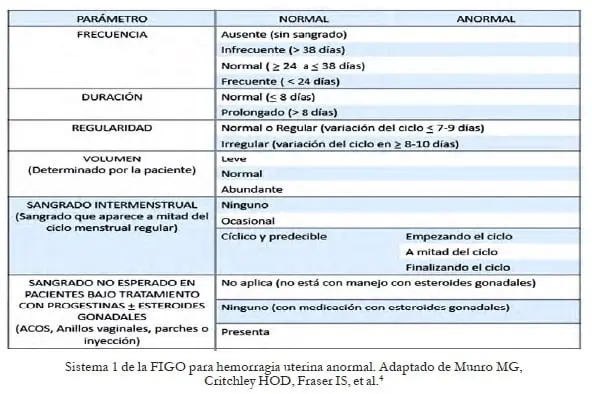
El sistema de clasificación FIGO desde el 2011 recomendó un sistema de nomenclatura (sistema 1), en donde se estableció que términos como hipermenorrea, menorragia, metrorragia, polimenorrea u oligomenorrea, no deben usarse más, porque además de ser confusos, no permiten una aproximación sindromática y etiológica adecuada.
Incluso varias publicaciones indexadas ya no reciben manuscritos de sangrado uterino anormal donde no se use la clasificación de PALM-COEIN.
Esta estrategia, con el propósito de unificar definiciones y clasificaciones, para facilitar la comunicación y dar la posibilidad de comparar estudios.
Sin embargo, aunque este cambio puede considerarse útil, se sigue recomendando no abandonar los conceptos semiológicos que dan una aproximación fisiológica de las causas del SUA.
Se dio claridad, a la no exclusión del término de amenorrea dentro del parámetro de frecuencia.
Se establece que la duración normal es de menos de 8 días y que un sangrado regular es el que tiene una variación no superior de 7 a 9 días, e incluyó el término de sangrado vaginal pesado como un síntoma y no como un diagnóstico, y se caracteriza por la pérdida excesiva durante la menstruación que interfiere con la calidad de vida de la mujer.
Y se definió el sangrado intermenstrual como el sangrado cíclico o aleatorio espontáneo que ocurre entre los periodos menstruales, y que, dentro de las posibles causas, puede estar asociado al uso de estrógenos o progestágenos. Esto último puede considerarse dentro de las causas de sangrado iatrogénico.
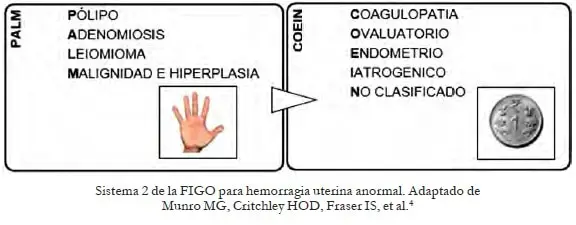
El sistema 2 (causas) PALM-COEIN igualmente fue propuesto en el 2011 y actualizado en el 2018. Es una clasificación básica que tiene dos categorías divididas en las causas estructurales y no estructurales. Los cambios en el 2018 incluyen la nueva clasificación ecográfica para la Adenomiosis, que ha sido referida en publicaciones recientes6.
(Lea También: Salud Cardiovascular, Transición a la Menopausia)
Para los miomas se incluyó el tipo 3 dentro de los miomas submucosos y se definió que los miomas tipo 0 y tipo 7 son los que tienen un pedículo menor al 10% del diámetro medio del mioma.
Desde el punto de vista reproductivo aún sigue sin aclarase la influencia de los miomas intramurales y el tipo 3, tanto como causa de dificultad reproductiva, como también causa de SUA. En la categoría de coagulopatía se dejaron de incluir los medicamentos anticoagulantes (los cuales podrían ser incluidos directamente como causas iatrogénicas).
En la categoría ovulatoria se definió que es necesario determinar el estado ovulatorio en las pacientes durante el diagnóstico.
Ya no se incluyen los medicamentos que interfieren con la ovulación en esta categoría, quedando sugeridas igualmente dentro de las causas iatrogénicas.
Se discute la posibilidad de incluir el istmocele como causa de sangrado uterino anormal de origen iatrogénico. Finalmente se cambió a la categoría aún no clasificada, dándose el nombre de clasificada en otra parte, en la categoría N.
Breve revisión de estas causas y las posibles intervenciones que generan iatrogenia (PALM-COEIN)
Los pólipos son alteraciones multifactoriales de etiología poco clara, que se caracterizan por el desarrollo de áreas focales de crecimiento glandular y estromal dentro de la cavidad uterina.
Dependen, usualmente, del estado menopaúsico de la mujer y se asocian a un menor número de receptores de estrógenos y progesterona, lo cual tiene importancia desde el punto de vista reproductivo, cuando se habla de receptividad endometrial.
La no identificación de estas mujeres en estado perimenopáusico o menopáusico es una situación común en la práctica médica, y el inicio de medicación hormonal para control de SUA sin estudio genera, sin duda alguna, alteraciones iatrogénicas y empeoramiento de síntomas.
Anticipamos la necesidad de un estudio previo de imagen por expertos, para descartar causas estructurales como esta y otras que evaluaremos a continuación7.
La adenomiosis es una alteración estructural mal definida, que podría corresponder a un hallazgo normal dentro de los cambios estructurales del miometrio según el momento del ciclo menstrual. Esto es importante en los casos de imágenes que sugieran esta posibilidad en las pacientes asintomáticas.
Si existe un contexto realmente patológico, el SUA podría estar asociado al aumento del volumen del área de descamación endometrial, por aumento del tamaño uterino, efecto estructural compartido con la miomatosis intramural8.
Se han descrito 8 criterios diagnósticos asociados a los hallazgos ecográficos en la adenomiosis, que pueden ayudar a inferir el diagnóstico6. Sin embargo, el diagnóstico definitivo es anatomopatológico, como lo es para todas las alteraciones estructurales del útero.
Síntomas posiblemente asociados o causados por la adenomiosis6.
|
1. Sangrado uterino anormal (SUA) 2. Síntomas de dolor ginecológico 3. Infertilidad y aborto espontáneo recurrente 4. Síntomas de presión local 5. Síntomas gastrointestinales y de la vejiga |
Los miomas submucosos tipo 1 y 2 en la clasificación FIGO son causa clara de SUA; no así el tipo 3 y otros intramurales.
Los miomas son tumores monoclonales de células miometriales, que responden a estímulos hormonales, y son ricos en receptores para progesterona.
Su tratamiento inadvertido con medicación hormonal hace que persistan o empeoren los síntomas relacionados con estos, dentro de ellos SUA.
Se reitera la importancia de descartar causas estructurales, y corregirlas cuando esto sea necesario, para evitar iatrogenia producida por la mala práctica, como la de iniciar tratamiento sin estudio previo.
Con respecto a la malignidad, hay que recordar que no solamente el cáncer de endometrio produce sangrado uterino anormal, sino que también hay que descartar cáncer del cuello del útero (menos frecuente el leiomiosarcoma) y otras patologías incluidas los cánceres de ovario que pueden estar relacionados con sangrado asociado con producción excesiva de estrógenos.
No es infrecuente, como lo hemos mencionado, la omisión del diagnóstico oportuno de estas patologías, incluso en presencia de sangrado anormal. Cuando se comprueban condiciones malignas o premalignas, el estudio y la clasificación deben basarse en los sistemas específicos ya publicados para cada condición.
El diagnóstico de estas alteraciones causantes de SUA solo requiere de la sospecha clínica, un buen interrogatorio, el uso adecuado de pruebas de tamización y de diagnóstico para una adecuada orientación terapéutica. La no adherencia a esta práctica clínica, con evidencia suficiente generará iatrogenia.
Con respecto a los trastornos sistémicos de la hemostasia y el sangrado uterino anormal, se conoce que hasta una de cada cinco mujeres con sangrado tienen trastornos heredados de la coagulación, y de estos el más frecuente es la enfermedad Von Willebrand, que puede estar presente en hasta el 13% de las pacientes con sangrado uterino anormal.
Además, hay que incluir en esta lista de causas los defectos heredados de función plaquetaria, las mujeres portadoras de la hemofilia, y la deficiencia de los factores de coagulación V, VII, X y XI.
Es importante sospechar tempranamente los trastornos sistémicos de la hemostasia, y se hace a través de una historia clínica estructurada y un cuestionario que, aplicado adecuadamente, tiene una sensibilidad de hasta del 90% para la detección de coagulopatía.
Es un cuestionario simple en el que se pregunta si la paciente ha tenido sangrado menstrual abundante desde la menarquia, si ha tenido uno de los siguientes 3 síntomas: hemorragia posparto, sangrado en cirugía o sangrado relacionado con trabajo dental; o si ha presentado dos de los siguientes: equimosis una o dos veces por mes, epistaxis una o dos veces por mes, sangrado frecuente gingival, o historia familiar de síntomas de sangrado4. La paciente que luego de aplicarle este cuestionario tiene hallazgos positivos necesita realizarse exámenes de laboratorio para descartar los trastornos de coagulación.
Dichos estudios incluyen un cuadro hemático completo con recuento de plaquetas, tiempos de coagulación, niveles de fibrinógeno, y estudios específicos para Von Willebrand como el antígeno de Von Willebrand, cofactor de Rosticetina y el factor VIII4.
Estas pacientes, luego de la aproximación inicial, deberían ser valoradas por un especialista que se dedique a los trastornos de coagulación, incluida medicina interna y/o hematología. La no sospecha de esta posibilidad y la no aplicación de estos pasos y el estudio adecuado se convierten en iatrogenia por omisión.
Es importante aprovechar la consulta médica general, la consulta médica ginecológica, la consulta de adolescente, el control preconcepcional y la asesoría en anticoncepción, para descartar los problemas de coagulación en las mujeres.
La alteración de la menstruación desde la menarquia es el primer signo de coagulopatía hasta en el 35% de adolescentes9. Se han descrito 3 tipos de enfermedad de Von Willebrand: tipo 1: es la deficiencia cuantitativa parcial del factor de von Willebrand, que es la más frecuente y, afortunadamente, la forma más leve de la enfermedad. Tipo 2: son defectos cualitativos, y son menos comunes. Finalmente tipo 3, describiéndose como la deficiencia completa del factor.
Las pacientes con sangrado en la adolescencia y disfunción plaquetaria ocupan entre el 23 y el 50% de las pacientes, y en las adolescentes puede ser hasta el 40%9. En general, se acepta que los médicos no están adecuadamente familiarizados con la prevalencia de estos trastornos y, por lo tanto, el diagnóstico se retrasa, generando alteraciones en la calidad de vida y en algunos casos situaciones de emergencia que ponen en peligro la integridad de la paciente.
Si hay sospecha de coagulopatía en una adolescente, lo primero que hay que hacer es descartar la enfermedad de Von Willebrand. Los niveles de factores de coagulación no son un buen predictor de hemorragia, debido a que las pacientes pueden tener otras condiciones donde los niveles pueden incluso ser normales.
Los trastornos de hiperfibrinólisis como la alteración del factor 13 son raras, y es posible que sea necesario evaluarlas cuando hay alta sospecha.
La consulta ginecológica es un momento fundamental para la aproximación de estas pacientes, porque es un punto de entrada donde los especialistas tienen alto conocimiento de las condiciones de la salud femenina, se brinda asesoría de prevención, se puede encaminar los diferentes motivos de consulta y ofrecer el manejo médico quirúrgico dependiendo de las características propias de cada paciente.
Es importante siempre evaluar la función ovulatoria, pues las pacientes que tienen menstruaciones cíclicas predecibles suelen no tener un trastorno de la ovulación.
El sangrado asociado con los trastornos ovulatorios generalmente lleva a un sangrado que es irregular, no solamente en tiempo, sino también en cantidad. Los trastornos ovulatorios pueden responder a afecciones a nivel de hipotálamo y/o hipófisis, generando, como característica común, la disminución de la frecuencia y el volumen de sangrado.
Las causas ováricas principalmente asociadas con síndrome de ovario poliquístico se asocian con sangrados de patrón mal definido frecuentemente con poca frecuencia, pero con sangrados abundantes, lo que indica niveles de estrógenos altamente persistentes por ausencia de contraparte progestacional. Los sangrados abundantes con frecuencia se asocian a condiciones que generan anovulación crónica.
Recordemos que debe establecerse la causa para realizar un tratamiento etiológico del problema. La indicación común de anticoncepción oral para la solución de esta situación puede ser efectiva mientras se utilice la medicación; sin embargo, deja sin aclarar un diagnóstico que puede traer consecuencias metabólicas y reproductivas graves para quien padece la enfermedad.
Por lo anterior, el enfoque debe estar encaminado a aclarar la causa de oligoanovulación10.
Las pacientes que tienen alteraciones endometriales pueden caracterizarse por sangrado anormal predecible y cíclico, donde no hay otras causas definidas.
Estos son desórdenes mecánicos de la regulación normal del endometrio por deficiencias no solamente de vasoconstrictores, sino alteraciones de la reparación propia del endometrio, siendo una causa común los procesos inflamatorios locales como la endometritis crónica.
Como se ha anotado, es necesario el conocimiento de las causas de SUA, puesto que la omisión o la subestimación del diagnóstico lleva consigo intervenciones inadecuadas que pueden finalmente enmarcarse dentro de la causas iatrogénicas, pudiéndose incluir en estas el uso de medicamentos anticoagulantes o las sustancias hormonales o no hormonales, que afectan la coagulación.
Existen diferentes medicamentos y dispositivos que pueden dar lugar a sangrado uterino anormal:
Dispositivos intrauterinos, anticonceptivos orales, progestágenos, moduladores de receptores progestacionales, agonistas de la hormona liberadora de gonadotropina (GnRH), anticonvulsivantes (el ácido valproico puede incrementar las concentraciones de andrógenos circulantes), antibióticos (rifampicina), antidepresivos tricíclicos, las fenotiazinas, entre otros medicamentos, que pueden alterar el metabolismo de la dopamina y los anticoagulantes que entran en la categoría de iatrogenia.
Es fundamental ser conscientes de las interacciones de los diferentes medicamentos y su uso para evitar iatrogenia11-13.
Las intervenciones sobre la cavidad endometrial, principalmente la cesárea, aumentan el riesgo de alteraciones que pueden relacionarse con presencia de SUA, como lo es el istmocele, el cual es un defecto que predispone a la acumulación de restos hemáticos que se convierten en caldo de cultivo para contaminación e infección, que produce manchado fuera de la ciclicidad normal femenina, y que también predispone a infecciones locales del endometrio que son per se una causa de SUA14.
Se ha de enfatizar en prevenir la realización de intervenciones no necesarias, y dentro de ellas, en la práctica obstétrica, la realización de cesáreas, legrados y otras que dentro de sus consecuencias pueden llevar a SUA.
En caso de ser estrictamente necesarias estas intervenciones, se deben mantener medidas y aplicación adecuada de técnicas quirúrgicas estrictas y ceñidas a protocolos y evidencia, que disminuyan la aparición de consecuencias como el istmocele, y otras que comprometen la calidad de vida por presencia de SUA y otras de tipo reproductivo15.
Enfoque terapéutico
Siempre hay que tener un enfoque global cuando el patrón menstrual se sale del contexto de normalidad. Por su puesto, siempre lo primero es descartar la presencia de gestación; hay que aplicarles a las pacientes una historia clínica estructurada, no solamente en la definición, sino también en las causas estructurales y no estructurales, definir adecuadamente el patrón menstrual, y a esto, añadirle un examen ginecológico completo.
Algunas pruebas de laboratorio, las imágenes adecuadas y la biopsia de endometrio guiada por histeroscopia en los casos en que está indicado también pueden ser parte integral de la evaluación de la paciente con SUA.
La ecografía transvaginal es probablemente el método de diagnóstico de primera línea para evaluar la estructura de la cavidad del endometrio y las características del miometrio. Sirve no solamente para hacer el diagnóstico de pólipos y miomas, sino también para la alteración de la estructura endo/miometrial16.
En pacientes que necesitan un estudio más detallado, es posible, aunque pocas veces necesario, que en la histerosonografía las imágenes de resonancia puedan ser útiles. En muchas de las pacientes, la histeroscopia puede ser una herramienta fundamental para obtener información complementaria, permitiendo la intervención terapéutica de causas estructurales ubicadas en la cavidad endometrial.
La evaluación endometrial es importante pero no está indicada en todas las pacientes. Es necesario balancear factores como la edad, los antecedentes personales y familiares, los hallazgos imagenológicos específicos, entre otros, para decidir si la paciente es beneficiaria o no de una biopsia de endometrio.
Siempre se debe asegurar material suficiente y adecuado durante la biopsia cuando esta es necesaria y se realiza bajo guía histeroscópica. No se recomienda hacer biopsias a ciegas, pues se ha descrito un rendimiento 40% menor que en las realizadas con guía histeroscópica para patología benigna17.
Sin duda, está indicado realizar biopsia endometrial en pacientes premenopaúsicas que tengan factores de riesgo para cáncer de endometrio como obesidad, diabetes o el síndrome de Lynch y estados de exceso de andrógenos como el síndrome de ovario poliquístico (SOP).
Pacientes que han tenido falla en el manejo médico, que tienen sangrado intermenstrual, que presentan alteraciones ecográficas de la cavidad o del grosor endometrial o pacientes que muestran ciclos sugestivos de anovulación, podrían beneficiarse de la realización de una biopsia por vía histeroscópica.
En las pacientes posmenopaúsicas hay fundamentalmente dos tendencias: una que sugiere que hay que hacerles biopsia endometrial a todas las pacientes posmenopaúsicas que sangran y otra que sugiere que hay que combinar los hallazgos clínicos con un grosor endometrial superior a 4 mm.
Se sugiere que las pacientes que tienen sospecha de lesión focal o las pacientes usuarias de tamoxifeno que tienen sangrado deben ser sometidas a la toma de muestra endometrial para estudio anatomopatológico. Recordar: la omisión de buenas prácticas es causa de iatrogenia, lo que a toda costa el médico tratante debe evitar.
Manejo médico del SUA
El manejo agudo debe basarse igual que el sangrado crónico en el esquema PALM-COEIN, y la decisión del tratamiento depende de la estabilidad hemodinámica de la paciente, de las causas sospechadas, de la intención de paridad de la paciente, si tiene o no comorbilidades, y del manejo clínico de las condiciones agudas.
El objetivo del tratamiento agudo es controlar el sangrado y disminuir la aparición de nuevos episodios. Algunas circunstancias pueden requerir manejo quirúrgico urgente para solucionar la condición.
En la mayoría de las pacientes, el manejo médico debe ser el tratamiento de elección, y el manejo quirúrgico debe dejarse solamente para las pacientes que con base en su estabilidad hemodinámica, severidad del sangrado, o contraindicaciones para el manejo, terminan teniendo indicación de manejo en cirugía.
El legrado ya no es una opción de tratamiento, porque es inadecuado no solamente para el diagnóstico, sino también para el manejo del sangrado agudo. Esto último se explica por una disminución en la efectividad diagnóstica, pues reduce de una manera temporal el sangrado, pero se ha descrito que algunas pacientes pueden sangrar más después de que se les hace una dilatación y curetaje, siendo este, además, un procedimiento que tiene una mayor morbilidad.
Para sospecha de patología maligna o estudio de SUA en la posmenopausia la aspiración con dispositivo de pipelle puede ser una gran alternativa para el diagnóstico de anormalidad sospechosa, pero la histeroscopia en la actualidad es el estándar de oro para diagnóstico18.
Dentro de las opciones médicas del tratamiento agudo están los estrógenos conjugados, el uso de ácido tranexámico oral o intravenoso, el uso de anticonceptivos orales a dosis altas19 y los antiinflamatorios. Con respecto a los antiinflamatorios, el ácido mefenámico es con el que más se ha demostrado efectividad terapéutica.
En pacientes con cuadro clínico mayor de 6 meses, como ya se expuso, se debe aclarar el diagnóstico para evitar iatrogenia.
Una vez se cuente con este, es fundamental educar a la paciente respecto a que el manejo médico es la primera línea de tratamiento a largo plazo. Este manejo puede ser hormonal o no hormonal, permitiendo conservar el potencial reproductivo si es del caso, mejorar la calidad de vida y evitar los riesgos quirúrgicos no necesarios y así, riesgo de iatrogenia.
Hay que tener en cuenta si las pacientes tienen intención obstétrica, la tolerancia a los medicamentos o las posibles reacciones adversas a estos, e informar que el tratamiento quirúrgico siempre será una alternativa, dando a conocer los riesgos y beneficios con claridad, previo a su realización. «El manejo oportuno en cada caso es una buena práctica clínica».
Dentro de los manejos hormonales en paciente con sangrados hormonales anovulatorios están incluidos los anticonceptivos orales combinados (AOC), los inyectables de solo progesterona, los anticonceptivos orales de solo progestinas, los implantes subdérmicos o el sistema intrauterino de levonorgestrel, el anillo vaginal combinado, los análogos de GnRh, el ulipristal para el sangrado por miomas, y el Danazol, aplicados según la causa específica.
Para anticonceptivos orales, y de acuerdo con la carga estrogénica de la paciente, idealmente utilizar combinaciones de etinil estradiol entre 20, 30 y 50 microgramos, con dienogest 2-3 mg, levonorgestrel 150 μg o drospirinenona 2 mg. Se pueden dar en esquemas cíclicos o esquemas extendidos, pero la mayoría de pacientes responden mejor con los esquemas continuos.
El anillo vaginal puede también utilizarse de manera continua para que las tasas de sangrado sean menores. Dentro de las progestinas están los implantes, y el uso de progestinas de depósito intramuscular, pero son causas frecuentes de amenorreas y trastornos menstruales y “spotting”.
Los orales que tienen un poco mayor tendencia al spotting, y el sistema intrauterino de levonorgestrel, que tiene altas tasas de amenorrea, buena tolerancia y una mejoría sintomática parecida a la ablación endometrial19,20. Los análogos de GnRH tienen altas tasas de amenorrea, pero tienen limitaciones en sus tiempos de uso superior a 6 meses y tienen reacciones adversas incluidos todos los síntomas de hipoestrogenismo.
Por estos efectos, debe seleccionarse adecuadamente la terapia según la causa, e igualmente individualizar. Una práctica adecuada es advertir sobre los fenómenos secundarios, eventos adversos, interacción medicamentosa y posibilidad de aparición de alteración del patrón de sangrado.
Esto hace que un evento que pueda ser considerado iatrogénico por la paciente, sea entendido como un fenómeno posible dentro de la aplicación terapéutica. Siempre que la terapia genere mejores condiciones respecto al patrón de sangrado y disminución de pérdidas sanguíneas o molestias, será preferible a la no aplicación de la terapia.
Igualmente, cuando no hay claridad diagnóstica o se sospecha un efecto iatrogénico, se debe suspender el tratamiento sin exponer a la paciente a riesgos de gestación no deseada o empeoramiento del cuadro por lo menos de manera temporal y con seguimiento adecuado para restructurar el estudio, aclarar diagnóstico y plantear la mejor alternativa de tratamiento, enfocado en la causa o las causas precisas20.
Se puede considerar de manera temporal, el uso de los antiinflamatorios no esteroideos (ácido mefenámico) en esquemas de salvas de 5 o 7 días durante el periodo premenstrual; o el uso de ácido tranexámico, que es un antifibrinolítico, en dosis entre 1 y 3 gramos por vía oral, durante 5 días, encontrándose reducciones de hasta el 50% en la alteración del patrón menstrual para los casos de enfermedad de Von Willebrand.
Estas estrategias, además de corregir los fenómenos de iatrogenia, permiten no perpetuar la iatrogenia generada por simplicidad en el manejo clínico, el cual, se reitera, debe estar orientado a la causa4.
En casos de sangrado intermenstrual —metrorragias— es importante descamar el endometrio antes del inicio de AOC o la terapia hormonal específica.
Conclusión
El SUA es una condición muy frecuente que tiene profundas implicaciones en la calidad de vida de las mujeres.
La aproximación basada en el sistema dual FIGO, incluido el PALM-COEIN, permite acercar el diagnóstico y proponer líneas de tratamiento. Se debe considerar el manejo médico como la primera línea. En las pacientes que no responden al tratamiento médico, es posible que sea necesario indicar tratamientos quirúrgicos.
El conocimiento del patrón de sangrado menstrual normal:
La fisiología del ciclo ovárico y las causas de alteración del patrón de sangrado previene intervenciones u omisiones médicas, las cuales pueden ser consideradas una de la causas de SUA por iatrogenia; así, entonces, la iatrogenia entendida como el daño causado durante un tratamiento o una intervención por parte del equipo de salud, como un evento secundario e inesperado producido por la intervención o acto médico21, no se limita solamente a las causas descritas o incluidas en el PALM-COEIN, sino también, y aun más importante, incluye la mala aplicación diagnóstica y terapéutica, la cual es, quizá, una de las causas más frecuentes de sangrado uterino anormal.
No es infrecuente recibir consulta de pacientes sin estudio previo y expuestas a tratamientos médicos y quirúrgicos sin un diagnóstico claro ; por tanto, cuando no se cuenta con un diagnóstico etiológico, la suspensión de la intervención bajo vigilancia permite el estudio adecuado y la corrección del tratamiento, con la premisa siempre de primero no hacer daño22 y brindar a la paciente la mejor intervención posible.
Hay que tener en cuenta que cuando el manejo no esté en nuestras manos o dentro de nuestra experticia, es necesario derivarla o acompañarnos de equipos médicos para evitar daño no voluntario. El entendimiento y la aplicación de esta premisa será un logro al compartir estas apreciaciones basadas en evidencia y experiencia sobre SUA de causa iatrogénica.
Referencias
- 1. Marnach ML, Laughlin-Tommaso SK. Evaluation and Management of Abnormal Uterine Bleeding. Mayo Clin Proc. 2019;94(2):326- 335. doi:10.1016/j.mayocp.2018.12.012
- 2. Henry C, Ekeroma A, Filoche S. Barriers to seeking consultation for abnormal uterine bleeding: Systematic review of qualitative research. BMC Womens Health. 2020;20(1). doi:10.1186/s12905-020-00986-8
- 3. Szpera-Go dziewicz A, Gruca-Stryjak K, Br borowicz GH, Ropacka-Lesiak M. Uterine arteriovenous malformation – diagnosis and management. Ginekol Pol. 2018;89(5):276-9. doi:10.5603/GP.a2018.0047
- 4. Munro MG, Critchley HOD, Fraser IS, et al. The two FIGO systems for normal and abnormal uterine bleeding symptoms and classification of causes of abnormal uterine bleeding in the reproductive years: 2018 revisions. Int J Gynecol Obstet. 2018;143(3):393- 408. doi:10.1002/ijgo.12666
- 5. Kaunitz AM. Abnormal Uterine Bleeding in Reproductive-Age Women. JAMA – J Am Med Assoc. 2019;321(21):2126-7. doi:10.1001/ jama.2019.5248
- 6. Chapron C, Vannuccini S, Santulli P, et al. Diagnosing adenomyosis: An integrated clinical and imaging approach. Hum Reprod Update. 2020;26(3):392-411. doi:10.1093/ humupd/dmz049
- 7. Dueholm M, Hjorth IMD. Structured imaging technique in the gynecologic office for the diagnosis of abnormal uterine bleeding. Best Pract Res Clin Obstet Gynaecol. 2017;40:23-43. doi:10.1016/j.bpobgyn.2016.09.010
- 8. García-Solares J, Donnez J, Donnez O, Dolmans MM. Pathogenesis of uterine adenomyosis: invagination or metaplasia? Fertil Steril. 2018;109(3):371-
Bibliografías
- 9. doi:10.1016/ j.fertnstert.2017.12.030 9. Bumbuliene Z, Sragyte D, Klimasenko J, Bumbul-Mazurek E. Abnormal uterine bleeding in adolescents: ultrasound evaluation of uterine volume. Gynecol Endocrinol. 2019;35(4):356-9. doi:10.1080/ 09513590.2018.1538345
- 10. ACOG. Practice Bulletin No. 136. Obstet Gynecol. 2013;122(1):176-185. doi:10.1097/ 01.aog.0000431815.52679.bb
- 11. Munro MG, Critchley HOD, Broder MS, Fraser IS. FIGO classification system (PALMCOEIN) for causes of abnormal uterine bleeding in nongravid women of reproductive age. Int J Gynecol Obstet. 2011;113(1):3-13. doi:10.1016/j.ijgo.2010.11.011
- 12. Munro MG. Practical aspects of the two FIGO systems for management of abnormal uterine bleeding in the reproductive years. Best Pract Res Clin Obstet Gynaecol. 2017;40:3-22. doi:10.1016/j.bpobgyn.2016.09.011
- 13. Sepúlveda-Agudelo J, Sepúlveda-Sanguino AJ. Abnormal uterine bleeding and PALM COEIN. Ginecol Obstet Mex. 2020;88(1):59- 67. doi:10.24245/gom.v88i1.3467
- 14. Tower AM, Frishman GN. Cesarean Scar Defects: An Underrecognized Cause of Abnormal Uterine Bleeding and Other Gynecologic Complications. J Minim Invasive Gynecol. 2013;20(5):562-72. doi:10.1016/ j.jmig.2013.03.008
- 15. Iannone P, Nencini G, Bonaccorsi G, et al. Isthmocele: From Risk Factors to Management. Rev Bras Ginecol e Obstet. 2019;41(1):44- 52. doi:10.1055/s-0038-1676109
- 16. Spremovi Radjenovi S, Stefanovi A, Kadija S, Jeremi K, Spari R. Classification and the diagnostics of abnormal uterine bleeding in nongravid women of reproductive age: The PALM-COEIN classification system adopted by the International Federation of Gynecology and Obstetrics. Vojnosanit Pregl. 2016;73(12): 1154-9. doi:10.2298/VSP160709289S
Fuentes
- 17. Maheux-Lacroix S, Li F, Laberge PY, Abbott J. Imaging for Polyps and Leiomyomas in Women with Abnormal Uterine Bleeding: A Systematic Review. Obstet Gynecol. 2016;128(6):1425-36. doi:10.1097/AOG.0000000000001776
- 18. Utida GM, Kulak J. Hysteroscopic and aspiration biopsies in the histologic evaluation of the endometrium, a comparative study. Med (United States). 2019;98(40). doi:10.1097/ MD.0000000000017183
- 19. Bofill Rodriguez M, Lethaby A, Low C, Cameron IT. Cyclical progestogens for heavy menstrual bleeding. Cochrane Database Syst Rev. 2019;2019(8). doi:10.1002/14651858. CD001016.pub3
- 20. Matteson KA, Rahn DD, Wheeler TL, et al. Nonsurgical management of heavy menstrual bleeding: A systematic review. Obstet Gynecol. 2013;121(3):632-43. doi:10.1097/AOG. 0b013e3182839e0e
- 21. González N, González L-J. Hemorragia Uterina Anormal Iatrogénico. In: Vivas C, ed. Hemorragia uterina anormal; 2020:177-195. In Press.
- 22. Marsh Henry. Ante todo no hagas daño. Editorial Narrativa Salamandra. 13 edición. 2018.
Autor
* LEONARDO JOSÉ GONZÁLEZ GARCÍA. Director General de “CEFERTIL S. A. S.” Centro de Fertilidad y Endocrinología Reproductiva, Manizales. Caldas (Colombia). .www.cefertil.net.
Ginecología y Obstetricia. Universidad de Caldas, 2003. Endocrinología Reproductiva e Infertilidad. Center for Androgen Excess and Disorders Related – Cedars Sinai Medical Center. Affiliated of Universidad de California, Los Ángeles UCLA. (EUA), 2007. Fellow Medicina Reproductiva. (Homologación) Universidad del Valle (Colombia), 2020.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO