Casos y Comentarios
Caso 1
Recientemente, he visto tres casos de insuficiencia ovárica primaria (IOP) en mi práctica: dos mujeres de 26 años y una de 29 años.
Después de investigar la insuficiencia ovárica primaria (IOP) en internet. Las mujeres (o sus madres) estaban convencidas de que la vacuna Gardasil era de alguna manera responsable de su déficit hormonal. ¿Hay alguna evidencia para apoyar sus preocupaciones?
Comentario
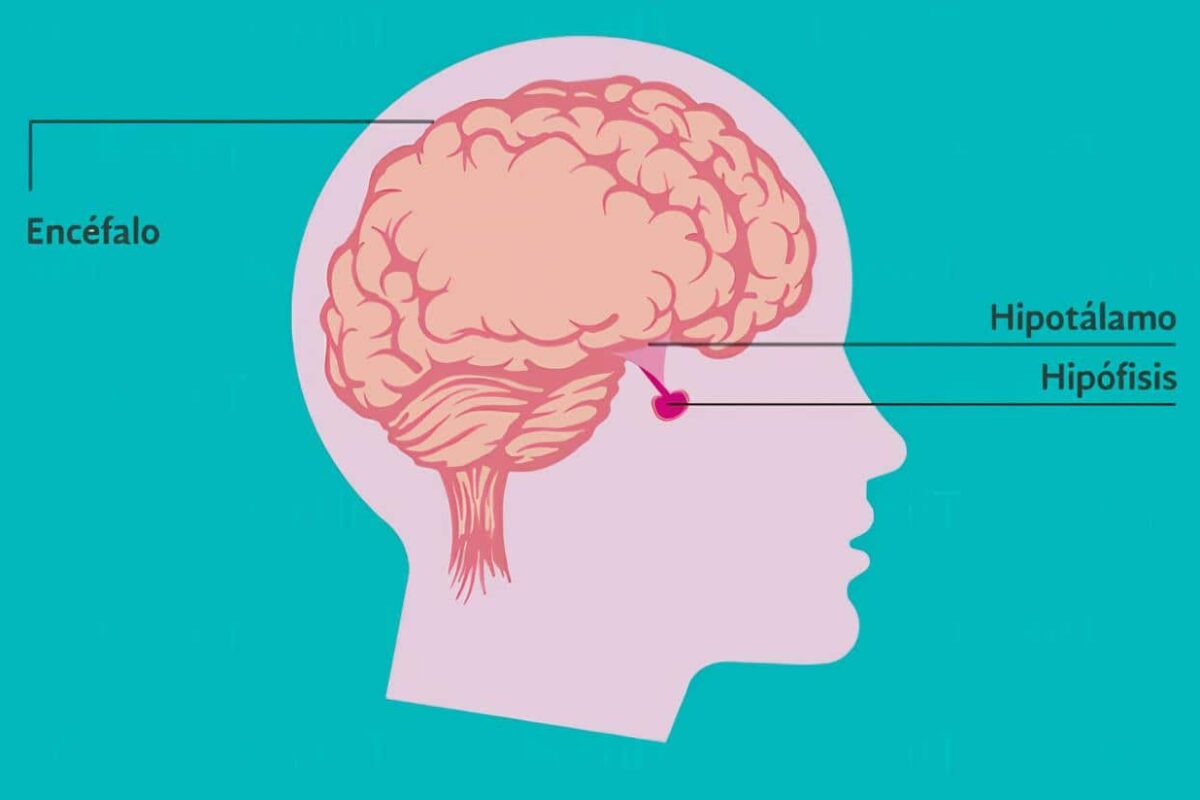
Las etiologías de insuficiencia ovárica primaria (IOP) incluyen causas genéticas, metabólicas, iatrogénicas (incluidas las quirúrgicas y las quimioterapéuticas), autoinmunes y posiblemente virales y ambientales.
2 En el 90% de los casos, la causa es desconocida. La implicación de dos series de casos (tres casos cada una) de la asociación temporal de IOP y la administración de la vacuna Gardasil es desconcertante.3,4 Esta asociación no prueba la causalidad.
No ha habido un aumento en los casos de insuficiencia ovárica primaria (IOP) desde la introducción de la vacuna contra el virus del papiloma humano (VPH). Aunque hasta diciembre de 2017 se habían administrado 100 millones de dosis de la vacuna contra el VPH.
La vacuna cuadrivalente contra el VPH se introdujo en 2006 en los Estados Unidos para niñas de entre 11 y 12 años para prevenir las infecciones por VPH de transmisión sexual. Incluido el cáncer anogenital (vulvar, vaginal, cervical, anal y del pene), verrugas genitales y cánceres de orofaringe.
Esta vacuna incluía partículas purificadas similares a virus de las principales proteínas de la cápside de los tipos 6, 11, 16 y 18 del VPH. Los agentes causantes del 66% de cáncer anogenital y el 90% de las verrugas vulvares6,7.
Actualmente, 13.000 mujeres son diagnosticadas con cáncer cervical cada año, y casi 4.000 mueren a causa de la enfermedad.6 La vacuna cuadrivalente consiste en las proteínas de VPH, aluminio, cloruro de sodio, L-histidina, polisorbato, borato de sodio, proteína de levadura y agua para inyección. Se ha administrado preferentemente a mujeres de 9 a 26 años mayor de 6 meses. Más recientemente, esa vacuna ha sido reemplazada con una que contiene proteínas de HPV 6, 11, 16, 18, 31, 33, 45, 52 y 58 para mejorar su eficacia.6
Posterior al inicio del programa de inmunización en 2006
Hubo informes en la literatura y bases de datos de farmacovigilancia de exacerbaciones de enfermedades autoinmunes.
Ha sido postulado pero no está probado que el aluminio o el polisorbato podría ser tóxico para el tejido ovárico. Alternativamente, las personas sensibles podrían desarrollar una respuesta autoinmune a otros componentes de la vacuna.
La base de datos VAERS, un sistema de notificación de eventos adversos de la vacuna, se estableció en 1990 conjuntamente por los Centros para el Control de Enfermedades y Prevención (CDC) y FDA para identificar sobre eventos de salud posiblemente asociados con vacunas.
Los eventos son informados voluntariamente a VAERS por el fabricante de la vacuna, profesionales de la salud y el público. Ninguna etiología causal puede ser determinada por estos informes. Solo se refiere a que la frecuencia de los informes es mayor que lo esperado.
Una evaluación epidemiológica de casos y controles de los VAERS. Emprendidos desde 2006 hasta 2014 en pacientes de 6 a 39 años sugeridos mostró que la gastroenteritis, la artritis reumatoide, la trombocitopenia, el lupus sistémico eritematoso, la vasculitis, la alopecia, las afecciones centrales desmielinizantes del sistema nervioso y el daño ovárico (incluyendo absceso de ovario, quistes ováricos, síndrome de ovarios poliquísticos, insuficiencia ovárica y síndrome del intestino irritable). Fueron significativamente más probables en los controles que hayan recibido la vacuna de VPH (el inicio medio de los síntomas iniciales osciló entre 3 y 37 días después de la vacunación).7
Los autores sugirieron que deberían hacerse estudios epidemiológicos de confirmación en otras bases de datos.
(Lea También:Osteoporosis Hipoestrogénica)
Según el CDC, hubo 17 informes de insuficiencia ovárica primaria (IOP)
Reportados después de 60 millones de dosis de Gardasil habían sido distribuidas en los Estados Unidos entre enero de 2009 y diciembre del 2015.5 Después de la revisión de los CDC y la FDA. No hubo sugerencia de que la vacuna fue la agente causal. Sin embargo, un estudio para examinar este tema más adelante está en marcha (www.cdc.gov/vaccinesafety/ensuringsafety/monitoreo/vaers/index.html).
El CDC así como la Organización Mundial de la Salud, Comité Asesor Global para la seguridad de la Vacuna, continúa vigilando la seguridad de vacunas contra el VPH. A diciembre de 2017, más de 100 millones de dosis de vacunas contra el VPH y 80 millones de dosis de Gardasil habían sido administradas.
La CDC actualmente no reporta un aumento en incidencia de IOP por encima de la línea de base esperada. Teóricamente, si la incidencia de IOP en mujeres jóvenes menores de 30 años es 1 en 10.000 al año. Uno esperaría que cientos de mujeres desarrollarían IOP por oportunidad en el tiempo que la vacuna ha estado disponible.
Actualmente, no hay mecanismo biológico plausible o estudios epidemiológicos para apoyar cualquier aumento en la incidencia de este trastorno raro en las niñas que han recibido la vacuna. Los beneficios de la prevención de la enfermedad grave de la vacuna contra el VPH actualmente superan cualquier riesgo no comprobado de IOP a partir del Análisis 2018.
Referencias
- Coulam CB, Adamson SC, Annegers JF. Incidence of premature ovarian failure. Obstet Gynecol. 1986;67(4):604-
- Vujovic S. Aetiology of premature ovarian failure. Menopause Int. 2009;15(2):72-
- Little DT, Ward HR. Adolescent premature ovarian insufficiency following human papillomavirus vaccination: a case series seen in general practice. J Investig Med High Impact Case Rep. 2014; 2(4):2324709614556129.
- Colafrancesco S, Perricone C, Tomljenovic L, Shoenfeld Y. Human papilloma virus vaccine and primary ovarian failure: another facet of the autoimmune/inflammatory syndrome induced by adjuvants. Am J Reprod Immunol. 2013;70(4): 309-16.
- Centers for Disease Control and Prevention. Vaccine Safety. Can HPV vaccine damage women’s ovaries? CDC website. Last updated February 21, 2018. www.cdc.gov/vaccinesafety/vaccines/hpv/hpv-safety-faqs.html#A7. Accessed April 4, 2018.
- Immunization Expert Work Group, Committee on Adolescent Health Care. Committee Opinion No. 704: Human Papillomavirus Vaccination. Obstet Gynecol. 2017;129(6):e173-e178.
- Geier DA, Geier MR. Quadrivalent human papillomavirus vaccine and autoimmune adverse events: a case-control assessment of the vaccine adverse event reporting system (VAERS) database. Immunol Res. 2017;65(1): 46-54.
Wendy L Wolfman, MD, FRCS(C),
FACOG, NCMP Professor, Department of Obstetrics and Gynaecology
University of Toronto
Carol Mitchell Chair
in Mature Women’s Health
Director, Menopause Unit
and Premature Ovarian Insufficiency Unit
Mt. Sinai Hospital
Toronto, Ontario, Canadá
Declaración
El Dr. Wolfman reporta ser conferencista de Pfizer, Searchlight y Serono, y consultor de Acerus, Searchlight.
Caso sugerido por Cheryl C Kinney, MD, FACOG, Dallas, Texas