Evaluación del riesgo de diseminación ganglionar y recurrencia
Dentro de la evaluación de riesgo de recurrencia local o diseminación ganglionar del CCT, se han descrito en la literatura factores morfológicos, histopatológicos y técnicos asociados a la resección endoscópica.
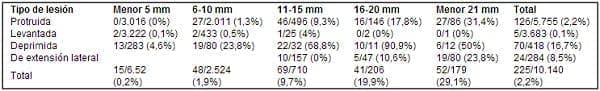
Kudo y colaboradores describieron las tasas de invasión submucosa de acuerdo con la morfología y el tamaño de los pólipos.
Para las lesiones protruidas, el porcentaje de invasión submucosa fue de 0% en las lesiones de 5 mm, de 1,3% en las lesiones de 6 a 10 mm y de 9,3% en los pólipos entre 11 y 15 mm. Las tasas respectivas de invasión submucosa para las lesiones planas o mínimamente elevadas fueron de 0,1%, 0,5% y 4%.
Según el estudio de Kudo, las lesiones protruidas y planas son casi invariablemente benignas cuando son pequeñas y no se tornan invasoras hasta alcanzar tamaños importantes.
Por otro lado, las tasas de invasión submucosa en lesiones deprimidas menores de 5 mm son de 4,6% para lesiones entre los 6-10 mm y, de 23,8%, y del 68%, en caso de lesiones entre 11 y 5 mm de diámetro.
Los pólipos de extensión lateral (LST) no comprometían la submucosa con tamaños entre los 11 y 15 mm, invadían la submucosa en 10,6% de los casos con lesiones entre los 16 y 20 mm y, en 23,8%, cuando eran mayores de 20 mm.
Según este estudio, las lesiones deprimidas crecen a una tasa más rápida e invaden en etapas más tempranas (Tabla 2) (3).
Tabla 2. Tasas de invasión submucosa de acuerdo con el tamaño y el tipo de lesión, Kudo. World J Surg 1997; 21; No 7: 694-701.
Jim Park y colaboradores evaluaron 90 pacientes con CCT y 1.704 pacientes con carcinoma avanzado, y encontraron que el compromiso ganglionar era mayor en presencia de los siguientes factores: invasión linfovascular, ausencia de un patrón adenomatoso de crecimiento (NPG), una configuración sésil de la lesión y un compromiso profundo de la submucosa.
También definieron que, en caso de lesiones pobremente diferenciadas y con invasión linfovascular, el compromiso submucoso era también mayor.
Concluyeron que estas características deben ser consideradas como factores de riesgo para diseminación linfática y recurrencia después del tratamiento local (11).
La serie de Moriera y colaboradores mostró que en 8 de un total de 16 pacientes con lesiones T1 había invasión linfovascular (5 pacientes con compromiso de Sm3 y 3 pacientes con compro-miso de Sm1y Sm2). Todas las 5 lesiones Sm3 tenían infiltración linfovascular (12).
Brodsky y su grupo de trabajo demostraron que en pacientes con lesiones T1 sin invasión linfovascular el riesgo de metástasis ganglionares fue de 0 en 15 pacientes, mientras que en lesiones T1 con invasión linfovascular 3 de 9 pacientes (33%) tenían diseminación linfática (12).
La Sociedad Japonesa de Investigación en Cáncer Colorrectal ha clasificado el grado de invasión linfovascular en:
Ly0 o V0 como ausencia de invasión vascular o linfática; Ly1 o V1 que implican mínima invasión; Ly2 o V2 con invasión moderada y, finalmente, Ly3 o V3 en casos de invasión masiva (8).
El análisis anatomopatológico de la pieza quirúrgica posterior al tratamiento endoscópico permite clasificar la calidad de la resección de la siguiente forma: completa, si los cortes histológicos muestran una orientación microanatómica normal de la lesión, en ausencia de malignidad; completa dudosa, si hay carcinoma presente en el tejido marginal de la lesión que coincide con la quemadura que produce el electrocauterio; e, incompleta, cuando hay evidencia histológica de que el carcinoma no fue completamente resecado (12).
En series colectivas japonesas de 58 pacientes sometidos a resección endoscópica, se encontró que es razonable emplear un margen libre de 2 a 3 mm entre las células malignas y la línea de sección del electrocauterio, como criterio de una resección curativa adecuada.
Aquellos pacientes con resecciones dudosas o incompletas requieren tratamiento adicional (12).
De acuerdo con un estudio de Cooper y colaboradores, se presentaron resultados adversos en 21,4% de los pacientes con márgenes de resección menores o iguales a 1 mm, comparado con sólo 4,8% de resultados adversos en pacientes con márgenes mayores de 1 mm (6).
Debe tenerse en cuenta que, aunque la mayoría de efectos adversos se dan en pacientes con márgenes positivos, en pacientes con márgenes sin tumor también puede presentarse diseminación de la enfermedad.
El riesgo de resultados adversos en pacientes con márgenes negativos después de la polipectomía es del 4%. En la mayoría de los casos, la evaluación del grado de diferenciación histológica y la presencia de invasión linfovascular identifican los pacientes en riesgo.
La incidencia de eventos adversos con márgenes negativos:
En presencia de otros factores de riesgo, es del 17,6%. Claramente, estos pacientes deben ser sometidos a resección quirúrgica. La incidencia de eventos adversos en pacientes con márgenes negativos e histología favorable es sólo del 0,8% (6).
Hase y colaboradores han definido el término budding (gemación) como agrupaciones microscópicas de células indiferenciadas inmediatamente por encima del frente invasor de la lesión.
De acuerdo con sus trabajos, el budding se asocia con un aumento en el grado de Dukes y de la diferenciación de la lesión, como también, con mayor riesgo de invasión linfática y venosa.
La presencia de budding fue un factor pronóstico independiente de supervivencia a 5 y 10 años. En un estudio más reciente, también de Hase y colaboradores, se confirmaron estos hallazgos y se describieron cinco factores histológicos adicionales de mal pronóstico en cuanto al riesgo de enfermedad ganglionar: 1. presencia de budding severo o moderado; 2. frente invasor pobremente definido; 3. células moderada o pobremente diferenciadas en el frente invasor; 4. invasión submucosa intermedia o profunda; 5. células cancerígenas en los linfáticos (6).
La incidencia de infiltración submucosa es mayor en el CCT de tipo deprimido (IIc, IIc + IIa y IIa + IIc) que en las lesiones no deprimidas o levantadas (Ip, Isp, Is) (8).
Tasa de invasión submucosa
Ajiok y colaboradores de la Universidad de Niigata, Japón, reportaron una mayor tasa de invasión submucosa para las lesiones IIa + IIc, IIc + IIa y IIc, al compararlas con las lesiones de tipo polipoide.
No hubo diferencias estadísticamente significativas entre las lesiones superficiales (no polipoideas) y las polipoides desde el punto de vista de grado de diferenciación histológico y frecuencia de metástasis ganglionares (8).
Tratamiento
De acuerdo con Nivatvongs, las lesiones del colon y el recto superior de tipo pediculado con carcinoma invasor Haggit grados 1, 2 y 3 (Sm1) pueden manejarse con polipectomía endoscópica, siempre y cuando no existan los factores adversos que hemos descrito con anterioridad.
De no ser éste el caso, está indicado el tratamiento quirúrgico convencional. El mismo enfoque se aplica para las lesiones pediculadas Haggit 4 (sésiles Sm1 y Sm2).
Los pacientes con lesiones Sm3, lesiones planas o deprimidas tipo Sm2 deben ser llevados a resección intestinal.
Para los tumores T1 del recto medio (7 a 10 cm del margen anal), se aplican los mismos criterios que para las lesiones del colon y el recto superior.
En caso de tumores T1 del recto inferior (a menos de 7 cm del margen anal) menores de 3 cm, se debe realizar una resección local de espesor completo como conducta inicial.
El tratamiento a seguir estaría indicado por la presencia de factores adversos o invasión Sm3, caso en el cual la conducta sería una resección abdominoperineal o una resección anterior ultrabaja.
Aunque no existen estudios controlados conclusivos que evalúen la quimiorradiación postoperatoria en pacientes con lesiones T1 con factores adversos concomitantes, el tratamiento adyuvante para lesiones T2 después de resección local ha mostrado buenos resultados.
Sería entonces razonable utilizar quimiorradiación adyuvante en pacientes con lesiones T1 con factores adversos, como una alternativa al tratamiento quirúrgico radical que implica una resección abdominoperineal (12).
Una resección anterior de recto o una resección abdominoperineal realizada inmediatamente después del tratamiento local:
En pacientes con lesiones tempranas y factores patológicos adversos, tiene una supervivencia libre de enfermedad del 94% a 5 años, comparada con sólo un 55% para aquellos pacientes con igual tratamiento quirúrgico después de una recaída local o en presencia de metástasis ganglionares (12).
Kudo y colaboradores establecieron las siguientes guías de tratamiento para el CCT.
Polipectomía convencional o avanzada (mucosectomía endoscópica) para todas las lesiones, excepto aquéllas con centro deprimido y márgenes elevadas, es decir, lesiones de tipo IIa, lesiones tipo IIc mayores de 10 mm y lesiones de tipo IIa + IIc.
Para pacientes con lesiones de este tipo estaría indicado la cirugía radical.
Los tumores de tipo IIa, Ip, Isp y LST menores de 3 cm pueden ser manejados con polipectomía convencional o avanzada, al igual que los carcinomas intramucosos (8).
El CCT de tipo LST mayor de 3 cm requiere una resección endoscópica fragmentada (EPMR), con evaluación histológica, para definir la conducta a seguir (3).
El papel de la cirugía laparoscópica en el manejo de los pacientes con CCT aún no está definido.
Hoy por hoy, los estudios retrospectivos y prospectivos sugieren que la laparoscopia es una técnica tan segura como la cirugía abierta, con ventajas desde el punto de vista de dolor postoperatorio, recuperación más pronta de los parámetros respiratorios y del íleo, como también mejor preservación en cuanto a inmunidad celular se refiere.
Estudios randomizados han demostrado, hasta ahora que el resultado oncológico y de supervivencia a corto plazo no se ve comprometido. No hay resultados a largo plazo disponibles en la literatura que sean conclusivos de supervivencia a 5 y 10 años.
Por ahora, podemos afirmar que la cirugía laparoscópica seguramente jugará un papel importante en un grupo seleccionado de pacientes con CCT (13).
Conclusión
El número de pacientes con CCT sigue en aumento gracias a las políticas de tamizaje y al mayor envejecimiento de nuestra población.
Esto implica esfuerzos en el análisis individual de las diferentes opciones de tratamiento, teniendo en cuenta los riesgos en cuanto a la recurrencia y la morbilidad asociadas a cada procedimiento.
Los japoneses han a cada procedimiento. Los japoneses han propuesto una serie de nuevas clasificaciones que deben ser aplicadas y evaluadas en el mundo occidental, en especial el valor pronóstico de la división en tres grados del compromiso de la submucosa.
Las versiones simplificadas de tales clasificaciones pueden ser útiles para evaluar el resultado del tratamiento local de este tipo de lesiones.
A su vez, estandarizar el uso de tales clasificaciones permitirá comparar los resultados de los diferentes protocolos de tratamiento.
Referencias
- 1. Lush DT. Screening Programs in the population at large and in high-risk groups. Surg Oncol Clin of NA July 1996; 5; No3: 545-52.
- 2. Parkin DM, Whelan SL. International Agency for Research on Cancer, World Health Organization and International Association of Cancer Registries 1987-91: Cancer incidence in 5 continents. Volume VII.
- 3. Kudo SE, Kashida H, Nakajima T, Tamura S, Nakajo K. Endoscopic diagnosis and treatment of early colorectal cancer. World J Surg 1997; 21: No 7: 694-701.
- 4. Jass JR. Histopathology of early colorectal cancer. World J Surg 2000; 24: 1016-21.
- 5. Kudo S, Kashida H, Tamura T, Kogure E, Imai Y. Colonoscopic diagnosis and management of nonpolypoid early colorectal cancer. World J Surg 2000; 24: 1081-90.
- 6. Kafka NJ, Coller JA. Endoscopic management of malignant colorectal polyps. Surg Oncol Clin of NA July 1996; 5; No3 : 633-61.
- 7. Watanabe T, Muto T. Colorectal carcinogenesis based on molecular biology of early colorectal cancer, with special reference to nonpolypoid (superficial) lesions. World J Surg 2000; 24: 1091-7.
- 8. Mainprize KS, McC. Mortensen NJ, Warren BF. Early colorectal cancer: recognition, classification and treatment. Br J Surg 1998; 85: 469-76.
- 9. Matsui T, Yao T, Iwashita A. Natural history of early colorectal cancer. World J Surg 2000; 24: 1022-8.
- 10. Kronborg O. Screening for early colorectal cancer. World J Surg 2000; 24: 1069-74.
- 11. Park JY, Kim WH, Paeng SS, Park JG. Histoclinical analysis of early colorectal cancer. World J Surg 2000; 24: 1029-35.
- 12. Nivatvongs S. Surgical management of early colorectal cancer. World J Surg 2000; 24: 1052-5.
- 13. Fazio VW, Lopez-Kostner F. Role of laparoscopic surgery for treatment of early colorectal carcinoma. World J Surg 2000; 24: 1056-60.