Nanoelementos para la Administración de Medicamentos en Cáncer
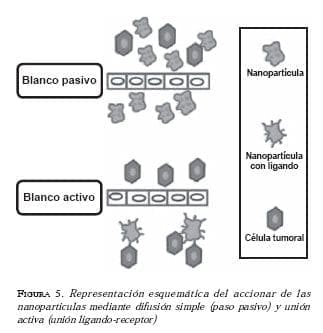
Estos problemas han comenzado a ser resueltos, gracias a las nanopartículas que tienen paso directo a través de los poros endoteliales aberrantes (por su tamaño inferior a 200 nm), mayor acumulación del medicamento en el blanco terapéutico y mayor selectividad hacia las células tumorales (25). Esta selectividad hacia las células tumorales se da mediante dos mecanismos, el pasivo y el activo (figura 5).
Hood, et al., (26) profundizaron sobre una alternativa antiangiogénica para el tratamiento de los tumores sólidos, consistente en el uso de un análogo de vb3 sintético, unido a un complejo de genes terapéuticos y nanopartículas catiónicas a nivel endotelial de las células tumorales. Esto también ha servido para la detección de procesos de angiogénesis tempranos por medio de la detección de moléculas paramagnéticas de vb3 por RM.
La tecnología stealth (5) ha aprovechado la acumulación pasiva de los medicamentos que existen, al presentarse un fenómeno de extravasación de nanopartículas por vía intravenosa (20 a 150 nm). La circulación de las nanopartículas, junto con su extravasación, permite llegar a zonas de tejido donde se presentan células cancerígenas e inflamación. La microcirculación del tejido sano presenta una unión intercelular de 10 nm de distancia, a diferencia del tejido tumoral que presenta una arquitectura discontinua con poros entre 100 y 1.000 nm de diámetro.
Las nanopartículas, al poseer tamaños mucho más reducidos que el resto de sustancias circulantes en el organismo, tienen la capacidad de alcanzar selectivamente poros con los diámetros que presentan los tejidos tumorales (5).
Para lograr en un futuro la implementación de esta clase de fármacos, es necesario solucionar distintos inconvenientes. Uno de ellos es que se deben alcanzar altas concentraciones de carga del medicamento, al igual que se debe mantener un rango terapéutico elevado, lo cual ha sido difícil considerando su importante extravasación y las complicaciones en el control de su circulación.
La liberación del fármaco ha sido un tema de amplio estudio. Se ha logrado demostrar que se puede implementar un recubrimiento liposómico capaz de activarse al contacto con sustancias particulares que la activen, por ejemplo, la fosfolipasa A2 que se encuentra en altas concentraciones en los procesos inflamatorios y cancerígenos puede inducir su liberación. Por lo tanto, la elección de una adecuada composición de lípidos acompañantes sería suficiente para lograr la estabilización y la prolongación de los perfiles farmacocinéticos y solo actuar en los lugares donde sea necesario (5). Otro método interesante que se ha desarrollado es la utilización del ácido fólico como coadyuvante, el cual se ha unido al extremo distal del polietilenglicol de las cadenas de la superficie de los macrófagos circulantes. Esto ha sido clave para llegar a sitios comprometidos por procesos inflamatorios y tejido neoplásico. El ácido fólico ha demostrado tener claras ventajas al interiorizarse rápidamente en receptores que expresan las neoplasias de ovario, endometrio, colon, recto y pulmón, ausentes en la mayoría de los tejidos normales (5).
Medicina regenerativa
La ingeniería de tejidos es una nueva práctica en la medicina, que reúne las sofisticadas prácticas de la ingeniería con la ciencia y la biología, todo con el fin de ayudar a la reparación y reemplazo de tejidos y órganos que van a ser incorporados al ser humano para mejorar su funcionalidad.
Desde el inicio se ha convertido en un campo multidisciplinario que ha sabido incorporar combinación de células, matrices y reactores que, en conjunto, han sido capaces de generar un nuevo tejido. Se espera acabar con los problemas de incompatibilidad inmunológica ya que, a partir de la extracción de células, se puede llegar a obtener un tejido que se va a implantar en este mismo organismo.
El logro más ambicioso de la medicina regenerativa es tener el control de las nanoestructuras subyacentes de la célula y la matriz extracelular. La nanotecnología tiene el potencial de proporcionar instrumentos que pueden acelerar el progreso en esta práctica (27, 28).
Enfoque hacia el futuro
La nanotecnología ha comenzado a generar gran impacto en el tratamiento del cáncer, al reducir la recurrencia y evitar la segunda o tercera cirugía después de la resección inicial. Por ello, la nanotecnología es una de las prioridades del futuro de la medicina, la cual se empieza a enfocar en cuatro pilares fundamentales:
1. la necesidad de desarrollar nanopartículas multifuncionales, útiles como blanco, medicamento o medio de contraste en imágenes diagnósticas;
2. el desarrollo de nanopartículas biocompatibles que puedan identificar tumores mediante enlaces moleculares activos biodegradables que puedan ser eliminadas por filtración renal o excreción hepatobiliar;
3. la creación de nanopartículas con menor toxicidad, y
4. la integración de la nanotecnología con otras ciencias tecnológicas, como robótica (cirugía robótica miniinvasiva), computación de alta velocidad y gráficas en tercera dimensión (29-31).
Conclusiones
La nanotecnología permite plantear una gran cantidad de aplicaciones en el campo de la cirugía, generando enormes cambios en la forma de visualizar y aplicar la medicina en el corto y mediano plazo.
A pesar de los grandes avances en enfermedad tumoral, la nanotecnología sigue siendo un área poco comprendida por el hombre, pero plantea una interesante posibilidad para futuras investigaciones, buscando ante todo el bienestar de nuestros pacientes.
La nanotecnología (biomarcadores moleculares y bioinformática) es una gran promesa para el tratamiento individualizado del cáncer, en el cual las decisiones quirúrgicas se han comenzado a basar en información en tiempo real molecular y celular (27).
Este trabajo no recibió el apoyo económico de la industria farmacéutica.
Nanotechnology: advances and expectations in surgery
Abstract
Nanotechnology is the science that focuses on the study and manipulation of solid colloidal particles ranging in size from10 nm to 1000 nm. The manipulation of these particles and elements can be widely applied in surgery, with elements such as those that allow the early diagnosis of tumor lesions, intra-operative tumor markers, or the delivery of drugs to specific targets, among others.
Key words: nanotechnology; particle size; spectrum analysis, raman; neoplasms.
Referencias
1. Kreuter J. PharmazeutischeTechnologie, Definición de nanopartículas. Fecha de consulta: 1 de abril de 2011. Disponible en: https://www.pharmazie.uni-frankfurt.de/PharmTech/ipt_kreuter/ indexl.
2. Whitesides GM. The “right” size in nanobiotechnology. Nat Biotechnol. 2003;21:1161-5.
3. Álvarez JD, Hernández C, Cataño JG. Nanotecnología, avances y expectativas en urología. Urol colomb. 2008;18:41-8.
4. Sahoo SK, Labhasetwar V. Nanotech approaches to drug delivery and imaging. Drug Disc Today. 2003;8:1112-20. 5. Emerich DF, Thanos CG. Targeted nanoparticle-based drug delivery
and diagnosis. Journal of Drug Targeting. 2007;15:163- 83.
6. Medical Subject Headings (MeSH) Database. Fecha de consulta: 1 de abril de 2011. Disponible en: https://www.ncbi.nlm. nih.gov/mesh/68008081.
7. Kim P, Lieber CM. Nanotube nanotweezers. Science. 1999;286:2148-50.
8. Kim P, Lieber CM. Report: Nanotube nanotweezers. 1999;286:2148-50.
9. Baughman RH, Zakhidov AA, de Heer WA. Carbon nanotubes –the route toward applications. Science. 2002;297:787-92.
10. Wu X, Liu H, Liu J, Haley KN, Treadway JA, Larson JP, et al. Immunofluorescent labeling of cancer marker Her2 and other cellular targets with semiconductor quantum dots. Nat Biotechnol. 2002;21:41-6.
11. Singhal S, Nie S, Wang MD. Nanotechnology applications in surgical oncology. Annu Rev Med. 2010;61:359-73.
12. Galanzha EI, Shashkov EV, Kelly T, Kim JW, Yang L, Zharov VP. In vivo magnetic enrichment and multiplex photoacoustic detection of circulating tumour cells. Nat Nanotechnol. 2009;4:855-60.
13. Jain KK. Advances in the field of nanooncology. Jain BMC Medicine. 2010;8:83.
14. Akerman ME, Chan WCW, Laakkonen P, Bhatia SN, Rouslahti E. Nanocrystal targeting in vivo. Proc Natl Acad Sci USA. 2002;99:12617-21.
15. Gao XH, Yang LL, Petros JA, Marshal FF, Simons JW, Nie SM. In vivo cancer targeting and imaging with semiconductor quantum dots. Nat Biotechnol. 2004;22:969-76.
16. Yu XF, Chen LD, Li KY, Li Y, Xuan Luo SX, Liu Jia, et al. Immunofluorescence detection with quantum dot bioconjugates for hepatoma in vivo. J Biomed Opt. 2007;12:014008-1 – 014008-5.
17. Weibo C, Shin DW, Chen K, Gheysens O, Qizhen C, Shan X. Peptide-labeled near-infrared quantum dots for imaging tumor vasculature in living subjects. Nano Lett. 2006;6:669-76.
18. Stroh M, Zimmer JP, Duda DG, Levchenko T, Cohen K, Brown E. Quantum dots spectrally distinguish multiple species within the tumor milieu in vivo. Nat Med. 2005;11:678-82.
19. Tada H, Higuchi H, Wanatabe TM, Ochuchi N. In vivo realtime tracking of single quantum dots conjugated with monoclonal anti-HER2 antibody in tumors of mice. Cancer Res. 2007;67:1138-44.
20. Qian XM, Peng XH, Ansari DO, Yin-Goen Q, Chen G, Shin D. In vivo tumor targeting and spectroscopic detection with surface-enhanced Raman nanoparticle tags. Nat Biotechnol. 2008;26:83-90.
21. Tanaka E, Choi HS, Fujii H, Franfioni JV. Image-guided oncologic surgery using invisible light: Completed preclinical development for sentinel lymph node mapping. Ann Surg Oncol. 2006;13:1671-81.
22. Kircher MF, Mahmood U, King RS, Weissleder R, Josephson L. A multimodal nanoparticle for preoperative magnetic resonance imaging and intraoperative optical brain tumor delineation. Cancer Res. 2003;63:8122-5.
23. Schulz MD, Khullar O, Frangioni JV, Grinstaff MW, Colson Y. Nanotechnology in thoracic surgery. Ann Thorac Surg. 2010;89:S2188-90.
24. Troyan S, Kianzad V, Gibbs-Strauss S, Gioux S, Matsui S, Oketokoun R. The FLARE intraoperative near-infrared fluorescence imaging system: A first-in-human clinical trial in breast cancer sentinel lymphnode mapping. Ann Surg Oncol. 2009;16:2943-52.
25. Flaherty KT, Malkowicz SB, Vaughn DJ. Phase I study of weekly liposome-encapsulated doxorubicin in patients with advanced, androgen-independent prostate cancer. Am J Clin Oncol. 2004;27(2):136-9.
26. Hood JD, Bednarski M, Frausto R, Guccione S, Reisfeld RA, Xiang R, et al. Tumor regression by targeted gene delivery to the neovasculature. Science. 2002;296:2404-7.
27. Boulaiz H, Álvarez PJ, Ramírez A, Marchal JA, Prados J, Rodríguez-Serrano F, et al. Nanomedicine: Application areas and development prospects. Int J Mol Sci. 2011;12:3303-21.
28. Garry MD, Mark S, Jerzy K. Nanotechnology for the treatment of coronary in stent restenosis: A clinical perspective. Vascular Cell. 2011;3:8.
29. Varshosaz J, Soheili M. Production and in vitro characterization of lisinopril loaded nanoparticles for the treatment of restenosis in stented coronary arteries. J Microencapsul. 2008;25:478-86.
30. Hakim M, Billan S, Tisch U, Peng G. Diagnosis of head-and-neck cancer from exhaled breath. Br J Cancer. 2011;104:1649-55.
Correspondencia: ERICK ESPITIA
Correo electrónico: espitiae@javeriana.edu.co
Bogotá, D.C., Colombia
CLIC AQUÍ Y DÉJANOS TU COMENTARIO