Ginecomastia
Ginecomastia: Consideraciones Médicas y Quirúrgicas en Cirugía General, Artículo de revisión
- Ginecomastia: Consideraciones Médicas y Quirúrgicas en Cirugía General, Artículo de revisión
- Resumen
- Palabras clave: ginecomastia; cirugía general; cirugía pediátrica; mastectomía subcutánea; mastectomía simple; tamoxifeno.
- Introducción
- Epidemiología
- Etiología y fisiología
- Ginecomastia fisiológica
- Ginecomastia patológica
- Ginecomastia medicamentosa
- Hallazgos clínicos
- Diagnóstico
- Clasificación
- Estudios diagnósticos
- Enfoque terapéutico
- Tratamiento farmacológico
- Tratamiento quirúrgico
- Conclusión – Ginecomastia
Gynecomastia: Medical and Surgical Considerations in General Surgery
Resumen
La ginecomastia, definida como el crecimiento del tejido glandular mamario en los hombres, aparece desde la etapa neonatal hasta la senil, puede ser unilateral o bilateral, y es de causa multifactorial, incluyendo aquellos pacientes asociados al uso de medicamentos, donde predomina un desbalance en la relación testosterona–estrógeno.
Relativamente, la idiopática es la más frecuente. La mayoría involucionan espontáneamente, las neonatales por perdida del influjo transplacentario en las primeras semanas, y las puberales entre 12 a 24 meses.
Se presenta como un aumento del tamaño mamario, asintomático o con hipersensibilidad por inflamación durante el crecimiento del tejido fibroglandular mamario, con una repercusión psicológica enorme, sobre todo en la etapa de la adolescencia. El estudio y manejo es interdisciplinario y se ofrece de acuerdo con las condiciones y la etiología.
Aquellos pacientes púberes en quienes no involuciona reciben tratamientos médicos, o tratamientos quirúrgicos cuando falla la terapéutica o hay presión social, e incluso radioterapia en casos donde desarrollan ginecomastia con hipersensibilidad al tratamiento hormonal del cáncer de próstata.
Palabras clave: ginecomastia; cirugía general; cirugía pediátrica; mastectomía subcutánea; mastectomía simple; tamoxifeno.
Abstract
Gynecomastia, defined as the growth of breast glandular tissue in men, appears from the neonatal to senile stage, can be unilateral or bilateral, and is of multifactorial cause, including those patients associated with the use of medications, where an imbalance in the testosterone – estrogen ratio.
Relatively, idiopathic is the most common. Most regress spontaneously, neonatals due to loss of transplacental influx in the first weeks, and pubertal ones between 12 to 24 months.
It presents as an increase in breast size, asymptomatic or with hypersensitivity due to inflammation during the growth of the mammary fibroglandular tissue, with an enormous psychological repercussion, especially in adolescence. The study and management is interdisciplinary and offered according to conditions and etiology.
Those pubertal patients in whom it does not regress receive medical treatments, or surgical treatments when therapy fails or there is social pressure, and even radiotherapy in cases where they develop gynecomastia with hypersensitivity to hormonal treatment of prostate cancer.
Keywords: gynecomastia; general surgery; pediatric surgery; mastectomy, subcutaneous; mastectomy, simple; tamoxifen.
Introducción
La ginecomastia es el aumento benigno en tamaño y cantidad del tejido glandular mamario en el hombre. Posee múltiples etiologías, sin embargo, todas concuerdan en un desbalance entre testosterona y estrógeno, a favor del último 1.
En general es un proceso bilateral, siendo unilateral de un 20 % de los casos 2. En la mayoría cede espontáneamente, pero en los que no ceden, lo más indicado es implementar tratamiento médico con un punto de vista amplio, ya que provoca un impacto emocional, psicológico, orgánico y físico y, en los casos refractarios a ese tratamiento, el manejo es quirúrgico.
Es una patología que en los últimos años ha aumentado de manera considerable, con una incidencia más alta en edades pospuberales (16-20 años), vinculada con el constante incremento de los índices de obesidad en todas las edades.
La ginecomastia de más de 12 meses, por su diversidad de etiologías, se ha asociado a diferentes neoplasias, como tumor de células de Sertoli, tumor de células de Leydig, tumor de células germinales, tumores suprarrenales, tumor hepatocelular y síndrome de Peutz-Jeghers 4.
Aunque no existe consenso, consideramos que para hablar de ginecomastia se necesita la exploración de un tejido glandular con tamaño de 0,5 a 2 cm 5.
Epidemiología
La ginecomastia constituye la principal patología mamaria en el sexo masculino, presentándose en el 38 % de los hombres jóvenes. Comúnmente ocurre en las principales etapas de cambios hormonales como en la infancia (neonatos 60 – 90 %), adolescencia (ente los 13 y 14 años 46 – 64 %) y adultez (mayores de 50 años 40 – 65 %) 6.
Según los primeros estudios de Nuttal 7, la prevalencia de ginecomastia aumenta mientras se avanza en edad, con un pico en los pacientes con 44 años de 57 %, llegando a la conclusión de que la ginecomastia es un hallazgo común en adultos normales y, haciendo un llamado al uso crónico de fármacos, que agravan el cuadro.
Etiología y fisiología
Se debe reconocer si la ginecomastia hace parte de un proceso normal del crecimiento o si está ligada a alguna patología subyacente. El 25 % es consecuencia de una alteración subyacente, entre las cuales las más frecuentes son el hipogonadismo y los adenomas hipofisarios.
En el restante 75 % de los pacientes con ginecomastia no se encuentra ninguna causa orgánica aparente. Estas idiopáticas se agrupan en ginecomastia peripuberal que no ha regresado completamente (20 %), de origen farmacológico (25 %) y sin causa identificada (30 %) 1.
A excepción de las ginecomastias en el periodo neonatal, puberal y senil, que involucionen en menos de 12 meses, el resto se consideran patológicas. Las causas pueden ser variadas, por eso la anamnesis es parte fundamental como estudio de un caso de ginecomastia 2. La etiología se debe dividir en ginecomastia fisiológica y patológica.
Ginecomastia fisiológica
Esta posee una distribución trimodal:
-
Ginecomastia neonatal:
De carácter transitorio, suele ser secundario al influjo de los estrógenos maternos placentarios y de la caída de los estrógenos al finalizar el embarazo, que estimula la secreción de prolactina. La placenta transforma dos derivados de la testosterona, provenientes de la madre y el feto, en estrona y estradiol, que estimulan el crecimiento glandular mamario 8.
Es la más común, se observa hasta en un 70 % de los recién nacidos y es independiente del sexo del neonato. Aparece principalmente en las primeras semanas, para desaparecer en las siguientes, incluso en los casos de ginecomastia neonatal gigante 2,9. -
Ginecomastia puberal:
Se desencadena a partir de los 10 a 13 años, de forma transitoria y corresponde al crecimiento benigno de la mama, sin asociación patológica endocrina y tampoco farmacológica. Puede estar relacionada con la producción de estrógenos, fuera o dentro de los testículos, que sobrepasa el nivel normal de testosterona producida 8 .
Tiene una incidencia aproximada de un 60 % hacia los 14 años, aunque esta es variable según los diferentes autores. Involuciona tras 12 a 14 meses de su aparición, en la mayoría de los casos, persistiendo sólo en el 8 % en los siguientes 3 años 6.
Posee un pico de incidencia entre los estadios Tanner 2 – 4, con testículos de entre 5 y 10 ml. No es común su presencia en mayores de 17 años, es bilateral en dos terceras partes de los casos y hay similitud de prevalencia en raza blanca y negra 7. -
Ginecomastia senil:
Como se ha mencionado, la prevalencia de la ginecomastia aumenta con la edad 7. Entre los 50 y 80 años estaría ligada a cambios hormonales como hipogonadismo relativo, disminución de la testosterona, aumento de la conversión periférica de andrógenos a estrógenos en el tejido adiposo, o aumento de la obesidad, sumado a las comorbilidades intrínsecas de la edad y los tratamientos farmacológicos que empeoran el cuadro. Estas alteraciones inexorables del proceso de senectud normal contribuyen al desarrollo de la ginecomastia en adultos mayores 2. -
En conclusión:
Lo que determina la aparición de la ginecomastia es la relación estrógenos/ andrógenos, a favor de los estrógenos, aunque cabe aclarar la particularidad, como propuso Pensler, que muchas veces esto no se refleja en las determinaciones hormonales en sangre, como en las ginecomastias idiopáticas 6,10.
Ginecomastia patológica
Aparece fuera de los periodos mencionados e incluye todos los aumentos del volumen de la mama o tejido glandular mamario en el hombre, que tienen como posible origen procesos patológicos, tales como trastornos sistémicos (insuficiencia renal, insuficiencia hepática, hipo/hipertiroidismo, hipogonadismo, enfermedades neoplásicas, déficit de testosterona por anorquia, síndrome de Klinefelter, enfermedades testiculares crónicas, u orquiectomía); tumores testiculares secretores de estrógenos, o el efecto secundario de diversas drogas legales e ilegales (alcohol, anfetaminas, marihuana, opiáceos, estrógenos, anabolizantes esteroides, agentes quimioterapéuticos, cimetidina, antidepresivos tricíclicos, entre muchos otros descritos) 2,5.
En el año 2015, en Francia, un estudio demostró que el efecto secundario de los fármacos como inductores de ginecomastia correspondía al 25 %, en las siguientes proporciones: antirretrovirales (23,5 %), diuréticos (15,5 %), inhibidor de la bomba de protones (11,9 %), inhibidores de la CoA-HGM reductasa (9,1 %), neurolépticos (6,5 %), bloqueador de los canales de calcio (6,3 %) e inhibidores de la 5 alfa–reductasa (4 %) 11.
Aunque antes, en Japón, se había probado que la ginecomastia no era un efecto secundario muy común de los neurolépticos 12, al parecer evidencia reciente demuestra lo contrario, lo que puede significar una incidencia mayor de este efecto secundario en población del hemisferio occidental.
Otro ejemplo de ginecomastia patológica sería la prepuberal, entidad poco conocida y de pocos reportes en la literatura, que representa el 5 % del total y que se caracteriza por una masa de tejido mamario palpable, unilateral o bilateral, en hombres, sin otros signos de maduración sexual 13.
Ginecomastia medicamentosa
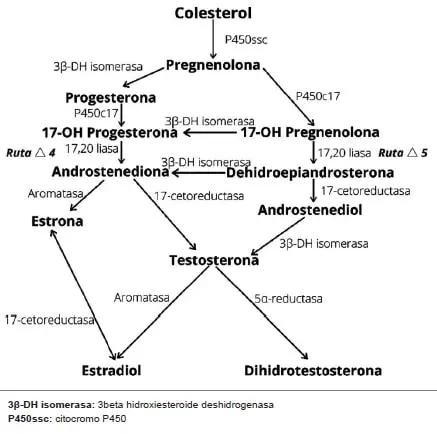
Ante todo, se debe tener en cuenta lo relacionado con el metabolismo de los andrógenos, ya sean en el sexo femenino como en el masculino, que parte de un precursor en común, el cual es el colesterol.
Luego de una serie de procesos metabólicos, terminan dividiéndose en dos vías principales, una que da origen a la testosterona y otra que conlleva a la formación de estradiol 14,15. Este proceso consta de varias rutas (figura 1) entre las que se encuentran la ruta 4 y 5.
Figura 1. Biosíntesis de los estrógenos, progestágenos y andrógenos. Elaborado por los autores, con base en Brunton L, Chabner B, Knollmann B, editors. Goodman & Gilman: Las bases farmacológicas de la terapéutica. 12 ed., capítulos 40 y 41 14,15. Adaptado de Hormonas esteroides gonadales con permiso de themedicalbiochemestrypage.org
Ruta 4:
1. El colesterol como principal precursor de este metabolismo se obtiene de la dieta animal.
2. Luego este colesterol pasa a convertirse en pregnenolona.
3. La pregnenolona tiene dos vías por las cuales puede metabolizarse, ya sea transformándose en progesterona.
4. La progesterona es transformada a 17- hidroxiprogesterona.
5. La 17- hidroxiprogesterona pasa a ser androstenodiona.
6. La androstenodiona finalmente, con la enzima aromatasa, pasa a formar el estradiol.
Algo que se debe tener presente es que estos procesos se encuentran interrelacionados, tanto el sexo masculino como en el femenino 14,15.
Ruta 5:
1. La 17 hidroxi-pregnenolona con la enzima 17, 20 liasa pasa a convertirse en androstenediona.
2. La androstenediona con la enzima 17 B-hidroxiesteroide- deshidrogenasa pasa a convertirse en testosterona.
3. Finalmente, con la 5 alfa-reductasa la testosterona se convierte en dihidrotestosterona, la cual tiene mayor afinidad por los receptores androgénicos que la misma testosterona, es decir es un metabolito funcional, que deriva los aspectos fenotípicos del varón, y es un potente inhibidor del crecimiento de la glándula mamaria 14,15.
Como se debe inferir, al momento de bloquear la enzima 5 alfa-reductasa, la testosterona no puede convertirse a dihidrotestosterona, y por lo general, cuando esto sucede, la testosterona pasa a transformarse en estradiol, gracias a la enzima aromatasa.
Como se ha mencionado en el proceso fisiopatológico de la ginecomastia, hay una inhibición en la vía de la testosterona que desencadena la ruta del estradiol.
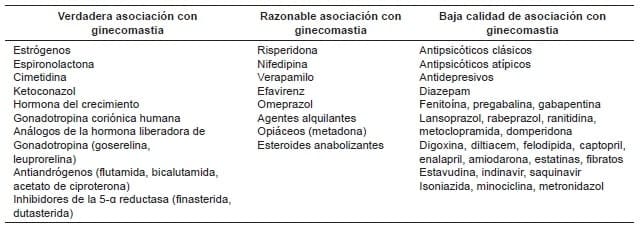
Existen fármacos con acciones específicas anti- androgénicas (Tabla 1) 16, como el tratamiento médico adyuvante del cáncer de próstata, cuyos efectos secundarios simulan una orquiectomía medicamentosa, con agonistas y antagonistas de la hormona liberadora de hormona luteinizante (LHRRH) u hormona liberadora de gonadotropina (GnRH), que luego de su accionar específico, sus efectos secundarios producen crecimiento de las glándulas mamarias.
Tabla 1. Fármacos asociados al desarrollo de ginecomastia según la evidencia de asociación. Basado en Boletín de Farmacovigilancia de Cataluña 16.
En otros casos, se caracterizan por inhibir la síntesis de andrógenos o el efecto de los mismos, al impedir la unión del andrógeno al receptor específico, o en su defecto, inhibir la acción de la enzima 5 alfa-reductasa, evitando así el paso de testosterona a su mayor metabolito activo, dihidrotestosterona 14,15.
Dentro de los antagonistas de los receptores de andrógeno se encuentran fármacos tales como: Flutamida, bicalutamida, nilutamida y Degarelizx (LHRRH).
La espironolactona, que se utiliza en el manejo de la ascitis por cirrosis hepática, en edema por insuficiencia cardiaca congestiva, para combatir la retención de líquidos (diurético), y en algunos casos, como coadyuvante en el manejo de la hipertensión en varones, puede causar ginecomastia como evento adverso, y esto se debe a la inhibición la secreción de la aldosterona, además de ser un antagonista débil del receptor androgénico y un inhibidor débil de la síntesis de testosterona (Citocromo P450 o CYP 17) en los procesos de oxidación y desalquilación 17.
La cimetidina hace parte del grupo de los antagonistas del receptor H2, es decir, se caracteriza por el bloqueo o inhibición de la producción de ácido gástrico por competencia reversible de la unión de histamina a los receptores H2. El uso en dosis muy altas, durante un tiempo prolongado, disminuye la unión de la testosterona al receptor de andrógeno e inhibe una CYP que hidroxila el estradiol.
Clínicamente estos efectos se pueden apreciar con galactorrea en las mujeres y ginecomastia en los hombres.
Desde el año 2012 se reportó la ginecomastia como uno de los efectos secundarios de las estatinas, por inhibición de la enzima CoA reductasa hidroximetil glutaril (HMG) 18.
Hallazgos clínicos
Se encuentra aumento del volumen de la glándula mamaria, que se detecta como una cresta circular de tejido glandular palpable y asible en el pezón, unilateral o bilateral.
La presentación sintomática suele ser diferente de acuerdo con la edad, mientras los jóvenes sienten dolor y sensibilidad en el pezón, los adultos generalmente suelen ser asintomáticos, es por ello que, la mayoría de los diagnósticos de ginecomastia son incidentales al examen físico.
Si el adulto aqueja mucho dolor, es un indicador potencial de requerimiento quirúrgico temprano 19.
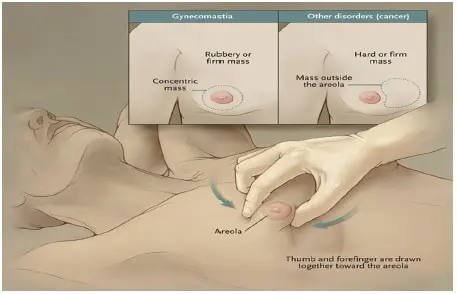
La ginecomastia se detecta mejor cuando el tamaño del tejido glandular supera los 0,5 cm de diámetro, sin embargo, como puede ser una variante normal en todos los hombres, se esperan estas cuatro características típicas durante el examen físico, descritas por Braunstein: tejido glandular en el centro de la areola, de forma simétrica, normalmente bilateral y en fases tempranas sensible a la palpación.
Se reconoce que, en un mismo paciente, la ginecomastia puede ser asimétrica, por ejemplo, agrandarse más un lado que el otro 19,20 (figura 2).
Figura 2. Examen físico en paciente con ginecomastia. Reimpreso de Braunstein GD. Gynecomastia. N Engl J Med. 2007;357:1229–37. Con permiso de Massachusetts Medical Society, license number 4875070757005. Copyright © (Julio 23/2020)
No importa el estímulo o la etiología, ya sea fisiológica o patológica, desde el punto de vista histológico se presentará los mismos cambios, que suelen estar separados por la fase temprana o de crecimiento y la fase tardía o fibrosa.
En la primera etapa hay hiperplasia y alargamiento de los conductos, con una marcada proliferación de células inflamatorias y edema periductales, lo que se traduce en dolor e hipersensibilidad, característicos en los primeros 6 meses, mientras que, en la fase fibrosa, después de los 12 meses, aumenta el número de conductos, con desaparición de la reacción inflamatoria que, en compañía de la fibrosis estromal, disminuye la frecuencia del dolor. En esta última etapa, no es recomendable utilizar terapia médica por su poca efectividad 19,21.
Diagnóstico
Se debe proceder, en el examen físico, a valorar la presencia de obesidad con el índice de masa corporal; a la inspección, observar el torso del paciente, por si posee abultamiento visible aún con la camisa.
Luego se debe desvestir el torso y, sentando el paciente con las palmas de las manos en las rodillas, el medico procederá a colocar pulgar e índice en lados contrarios del pezón para intentar unirlos por medio de la piel lentamente; se repite la acción táctil, pero con el paciente colocando sus manos detrás de la cabeza o nuca, para comparar el tamaño cuando el músculo pectoral se levante (figura 2).
Se deberá también evaluar, especialmente cuando sea una ginecomastia grado III (severo aumento de volumen mamario con piel redundante o una mama ptósica), el paciente acostado y con las manos detrás de la cabeza, para percibir la cresta circular firme, que debe estar debajo de la areola 19.
Se debe hacer énfasis en la edad de inicio, duración del proceso o tumefacción, dolor o secreción por el pezón, antecedentes de parotiditis, trauma o masa testicular, consumo crónico de alcohol, drogas legales o ilegales, hipotiroidismo, enfermedad hepática (cirrosis), signos de feminización, antecedentes de infertilidad, disfunción sexual, antecedentes familiares de ginecomastia y cáncer de mama.
La adherencia a los pasos anteriores, junto con una buena anamnesis, son fundamentales para el diagnóstico diferencial con pseudoginecomastia o lipomastia, provocada por el aumento del tejido graso periareolar de forma difusa, sin aumento del tejido glandular o ductal subareolar concéntrico.
En adición, se definirá la consistencia de la glándula mamaria, presencia de nódulos excéntricos o adenomegalias axilares, retracción de la piel o pezón, para considerar el diagnóstico diferencial con lipoma, neuroma, o en algunos casos, cáncer de mama o de tejidos blandos, al encontrar masas firmes indoloras o secreciones del pezón 19.
Clasificación
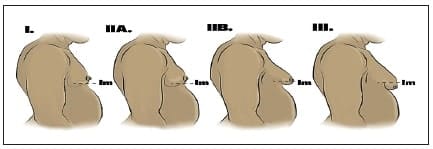
La clasificación más utilizada para los pacientes con ginecomastia es la de Simon BE 1,2,6,22, que la divide en 3 grados (figura 3), así:
Figura 3. Clasificación de la ginecomastia según Simon BE 22: se debe tener en cuenta el surco infra mamario (im). Imagen diseñada por los autores.
- Grado 1: existe un leve aumento mamario, especialmente alrededor de la areola, sin exceso cutáneo y sin tórax adiposo; generalmente resuelve de forma espontánea.
- Grado 2: se presenta aumento moderado del volumen mamario, hay un tórax más graso, no definido en márgenes. Se divide a su vez en grado 2A, que no presenta exceso cutáneo y grado 2B donde existe exceso cutáneo. Se necesita lipoaspiración y, generalmente, requiere tratamiento quirúrgico.
- Grado 3: simula una mama femenina y, por lo tanto, existe un notable aumento del volumen mamario, con exceso cutáneo, que requiere resección. Normalmente está presente en adultos mayores.
Sin embargo, desde el punto de vista práctico, se recomienda no centrarse de lleno en la clasificación, y tener en cuenta los criterios clínicos para obtener buenos resultados en los planes terapéuticos 1.
Estudios diagnósticos
Generalmente, la ginecomastia fisiológica no amerita estudios especiales, solo la observación y seguimiento, pero en las patológicas se debe determinar la posibilidad de origen endocrino, por lo que se requiere de niveles séricos de testosterona matinal (9 A.M.), globulina fijadora de hormonas sexuales (testosterona libre), estradiol, hormonas tiroideas (TSH), hormona gonadotrópica, luteinizante, folículo estimulante y prolactina.
En caso de hallar reportes anormales, se debe remitir el paciente a Endocrinología. Adicionalmente, se evalúan función renal y hepática, y en algunos casos, cariotipos o marcadores tumorales.
En caso de ginecomastia atípica se debe realizar ecografía de tejidos blandos de la mama para descartar presencia de masas u otras lesiones, mamografía, o biopsia por aspiración con aguja fina (BACAF) o con aguja de TRU-CUT en pacientes mayores de la tercera edad, para descartar neoplasias 23.
Si se sospechan tumores testiculares, es necesario solicitar gonadotropina coriónica humana beta, alfa-fetoproteína y deshidrogenasa láctica.
Enfoque terapéutico
Los principios del tratamiento de la ginecomastia dependen principalmente de la etiología, seguida de la duración, el grado, la severidad y la sensibilidad presente, por lo que se debe tener presente los siguientes pasos:
El primer paso en el manejo de la ginecomastia reciente medicamentosa no es el tratamiento farmacológico ni la observación, sino evitar o descontinuar, si es posible, el uso de las drogas que la causan, como espironolactona, isoniazida, omeprazol, metotrexate, imatinib, amiodarona y alcohol.
Esto debe favorecer la regresión del tejido glandular mamario en aproximadamente un mes luego de suspender el medicamento o el tratamiento causal del desorden subyacente, con desaparición en menos de 3 meses en casos de ginecomastia de reciente aparición.
Sin embargo, si la ginecomastia no es reciente, y lleva presente sin interrupción por más de 12 meses, descontinuar un medicamento probablemente no tendrá un efecto terapéutico en la regresión del tejido glandular debido a la fibrosis desarrollada 24.
El segundo paso es la observación del paciente durante un año, basado en el principio sobre regresión espontánea de la ginecomastia neonatal (menores de 6 meses de edad) y puberal, que se han reportado en el 70 % y 80 % de los casos, respectivamente. Si esto no ocurre, el siguiente paso es el tratamiento farmacológico.
Tratamiento farmacológico
Antes de iniciar un tratamiento específico es recomendado revisar desórdenes tratables subyacentes, como hipertiroidismo e hipogonadismo, y si esto es diagnosticado, el siguiente paso sería tratar estas patologías y observar las glándulas mamarias mediante un examen físico tres meses después 24.
El tratamiento farmacológico temprano solo estará indicado para los pacientes con crecimiento de la mama visible, y con los síntomas generales de dolor, hipersensibilidad, afecciones sociales y psicológicas que afecten la vida diaria.
El tratamiento no siempre resultará en la regresión de la ginecomastia, pero puede significar el alivio de síntomas, como dolor y disminución del tamaño, que tendrá como resultado una mejor calidad de vida 24.
Es importante reconocer que no se ha aprobado ningún fármaco para el tratamiento de la ginecomastia, y esto se debe informar a cada paciente con ginecomastia o a los padres y/o familiares en caso de menores de edad.
Existen, sin embargo, tres tipos de tratamientos farmacológico para la ginecomastia 4:
1. Andrógenos: testosterona, dihidrotestosterona y danazol.
2. Antiestrógenos: citrato de clomifeno y tamoxifeno.
3. Inhibidores de la aromatasa: letrozol y anastrazol.
El principal medicamento en pacientes con ginecomastia única, sin otras patologías, es el modulador selectivo de receptor de estrógenos (SERM) Tamoxifeno, a dosis de 20 mg cada día por 1 año. En niños y adolescentes con ginecomastia severa (grado 2-3) y que afecte su vida social, se recomienda Tamoxifeno 20 mg cada 24 horas o 10 mg cada 12 horas por 3 meses como prueba para analizar la regresión o no de la patología 24.
En adultos con ginecomastia de más de 3 meses, que hayan estado en observación y no se pudo determinar la causa, se recomienda una breve prueba de 6 meses con Tamoxifeno 20 mg cada 24 horas, para evaluar la mejoría o no de su condición.
La regresión del tejido glandular con Tamoxifeno en comparación con Danazol se registra en 78,2 % de los casos 25.
Desde el extraordinario estudio doble ciego, aleatorizado, multicéntrico, con placebo de control, publicado por Fradet et al. en 2007 26, donde se demostró la eficacia del tamoxifeno (20 mg/ día) en la disminución de eventos mamarios en hombres con cáncer de próstata, como efecto secundario en su tratamiento con bicalutamida (150 mg/día), el Tamoxifeno se convirtió en una adición esencial para el tratamiento combinado de pacientes con ginecomastia y cáncer de próstata, e incluso con cáncer de próstata solo, para prevenir eventos adversos mamarios.
Con respecto al Danazol, un andrógeno débil que posee la capacidad de inhibir la secreción de gonadotropinas y disminuye los niveles séricos de testosterona, en un estudio prospectivo controlado se demostró la resolución de la ginecomastia en el 23 % de los pacientes, en comparación con el 12 % de pacientes que utilizaban placebo 27.
La dosis recomendada de Danazol es de 200 mg dos veces al día, vía oral; pero se ha asociado a efectos adversos como edema, acné y calambres, que han limitado su uso 4.
Tamoxifeno es más seguro y eficaz que el Danazol, sin embargo, en pacientes con ginecomastia solitaria puede provocar efectos secundarios como eventos gastrointestinales, trombosis venosa profunda postraumática y eventos cardiovasculares.
En algunas investigaciones, en menos del 5 % de los hombres provoca toxicidad, lo que sugiere que puede ser bien tolerada en la población masculina 28, por esta razón, se prefiere por encima de otros SERM, como Raloxifeno.
Una de las contraindicaciones del Tamoxifeno en ginecomastia sucede cuando el paciente sufre de hipogonadismo, en cuyo caso el tratamiento recomendado es la terapia de reemplazo hormonal androgénica o testosterona.
Sin embargo, este tratamiento con testosterona, paradójicamente, puede producir efecto secundario de ginecomastia, por la aromatización de la testosterona a estradiol.
Aunque este tratamiento no presenta suficiente información de ser eficaz en hombres eugonadales 29,30, la dihidrotestosterona, andrógeno no aromatizable, sí ha demostrado buenos resultados en pacientes con ginecomastia puberal prolongada 4.
Al igual que el paso de observación, el manejo farmacológico solo será efectivo en fases tempranas y no fibrosa de la ginecomastia, es decir, antes del primer año.
Además, se debe tener en cuenta la gravedad de esta, porque es poco probable que la ginecomastia severa (grado 3), con pezones en forma de péndulos, responda a tratamiento farmacológico.
Los inhibidores de aromatasa, como Anastrozol y Letrozol, en teoría serían efectivos para la ginecomastia al bloquear la biosíntesis de estrógenos, ayudando a reducir la diferencia estrógeno/ andrógeno a favor de la testosterona, sin embargo, en la actualidad y por razones desconocidas, no se ha demostrado su utilidad en estudios clínicos para beneficio en ginecomastia puberal o en pacientes seniles con cáncer de próstata 31.
Entre más temprana en etapas de la vida sea la ginecomastia, más sintomática y tratable será. Mientras que la cirugía estará indicada en ginecomastia persistente o resistente, y se llevará a cabo luego de saber la causa subyacente.
Tratamiento quirúrgico
La decisión de tomar la conducta quirúrgica generalmente es dada por la falla en la involución espontánea, la falla del tratamiento médico, o por la angustia del paciente o la vergüenza con el entorno social y familiar, causado por el malestar físico de la apariencia femenina en un hombre, la cual hay que debatir muy bien con el paciente o con su tutor, en caso de menores de edad o adolescente 20.
En pacientes con antecedente familiar de cáncer de mama, y en aquellos con síndromes de hiperestrogenismos (Klinefelter) o insuficiencia hepática, se debe descartar la posibilidad de neoplasia, aunque sea muy baja la prevalencia del cáncer de mama en el hombre, sobre todo en mayores de 65 años con ginecomastia unilaterales.
En un estudio de 5113 especímenes de ginecomastia se reportó hiperplasia ductal atípica en el 0,4 %, carcinoma in situ en el 0,2 % y carcinoma invasivo en el 0,1 %, en un paciente mayor de 65 años, confirmando que la ginecomastia por sí sola no es un factor de riesgo para desarrollar cáncer de mama 32-34.
Históricamente, las técnicas quirúrgicas se conocen desde el siglo VII, en uno de los 7 libros del griego Paulus Aegineta (625 al 690 AD), quien describió las primeras resecciones en semilunas.
Luego se reconocen por sus publicaciones científicas a Menville JG 35, año 1933; Maliniac, 1943 36; Webster JP 37, 1946, por sus técnicas semicirculares intraareolares; Pitanguy I 38, en 1966, con la técnica transareolar; Davidson BA 39, en 1979, con la técnica de círculos concéntricos; Benelli L 40, en 1990, por la mamoplastia periareolar o mastectomía subcutánea, técnica del bloque redondo (escisión de piel concéntrica periareolar), liposucción con adenectomía o lipoplastia asistida por ultrasonido o VASER (Vibration Amplification of Sound Energy) 41.
Para las correcciones se deben tener en cuenta la posición inferior de la placa areo-mamilar respecto al surco infra mamario, el tamaño de la areola, tacto respecto al tejido adiposo y glandular y la elasticidad cutánea (figuras 3 y 4).
Existen múltiples clasificaciones de la ginecomastia, manteniéndose durante mucho tiempo las descritas por Simon BE, en 1973 22, luego de variaciones, seguidores y detractores 42.
Finalmente, Rohrich R 43, en el año 2003 propone una nueva clasificación con 4 grados. Dependiendo del grado de la ginecomastia, el manejo quirúrgico debe ser individualizado, de acuerdo con diferentes técnicas operatorias descritas 44,45:
1. Técnicas mínimamente invasivas, incluyendo liposucción, mastectomía asistida por vacío y mastectomía endoscópica.
2. Mastectomía simple subcutánea con conservación de piel.
3. Mastectomía simple subcutánea con resección de piel.
4. Mastectomía simple con injerto libre de pezón / Amputación de mama.
5. Combinación de técnicas.
Las técnicas de mastectomía subcutánea simple más colgajo más usadas en cirugía general, para la ginecomastia grado 1 y 2 según la clasificación de Simon BE, son las de Webster JP 37 y de Benelli L 40.
A pesar de las nuevas clasificaciones de la ginecomastia, la gran variedad de técnicas quirúrgicas nos da a entender las dificultades a las que se enfrenta el cirujano general en los pacientes con diagnóstico de ginecomastia de mayor grado 37,40,41. Pocas son las referencias recientes que han mostrado éxito en los resultados psicológicos y de autoestima 20,46.
La mastectomía subcutánea, unilateral o bilateral, es un procedimiento ambulatorio, que pueden ser realizado por varias disciplinas, bajo anestesia general inhalatoria preferiblemente, aunque puede llevarse a cabo con anestesia local y sedación en aquellos casos grado 1, en paciente adulto, tranquilo y colaborador.
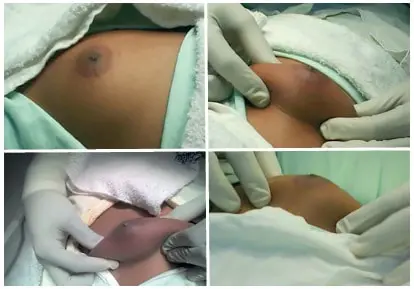
Con el paciente en decúbito dorsal, previa asepsia y antisepsia del tórax anterior y colocación de campos quirúrgicos, se procede a realizar maniobra de Braunstein 20 (figura 4) antes de la incisión periareolar inferior, que compromete piel y tejido celular subcutáneo.
Figura 4. Delimitando el tejido fibroglandular, previo a la incisión periareolar, en paciente con ginecomastia grado IIA según la clasificación de Simon BE.
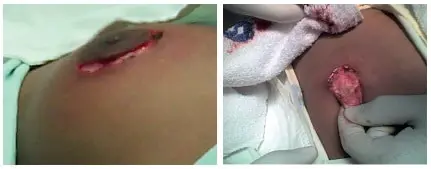
Se tallan los colgajos inferior y laterales, se diseca el complejo areola -pezón, separándolo del tejido fibroglandular y conservando su pedículo vascular (figura 5).
Figura 5. Incisión periareolar de la mama en paciente varón, donde se preserva la irrigación del complejo areola pezón y del colgajo de piel compuesto de vecindad.
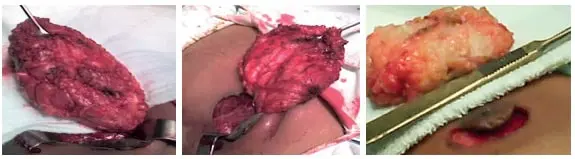
Luego se talla un colgajo superior suficiente, sin comprometer su irrigación y por ende su viabilidad, hasta llegar a la fascia prepectoral, conservándola; se evita a futuro mayor riesgo de hematomas o formación de seromas, con una disección en bloque con el tejido fibroglandular (figura 6), y se envía a estudio de patología.
Se procede a practicar hemostasia rigurosa, se fijan los colgajos y pezón con sutura absorbible 3/0, se deja drenaje cerrado de 1/8 de pulgada, o con uno de Penrose delgado (en cigarrillo) para aquellas instituciones que no cuenten ese dicho dispositivo.
Se cierra la piel con sutura no absorbible monofilamento 3/0, con puntos separados para evitar la isquemia del colgajo periareolar, previa confirmación de normotensión y no sangrado del lecho operatorio.
Figura 6. Mastectomía subcutánea simple con colgajo de piel compuesto de vecindad.
El tiempo promedio del procedimiento bilateral es 55 minutos +/- 10 minutos, se da de alta al recuperarse de la anestesia y verificación de no sangrado, se prescribe manejo ambulatorio con acetaminofén 1 gr cada 8 horas vía oral por 3 días y curaciones diarias con suero fisiológico; se proscribe el uso de antibiótico, basados en los protocolos de manejo de herida quirúrgica limpia.
Luego se retira el dren según su producción (alrededor de tres días), evitando así formación de seromas. Se retiran las suturas de piel en 10 a 12 días.
El procedimiento, generalmente conlleva a una gran satisfacción personal en la mayoría de los pacientes (84,5 % al 100 %), pero no está exenta de riesgos.
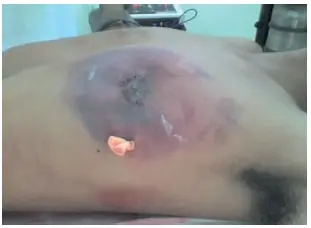
En la literatura se encuentran reportes de seromas (2,4 % al 12,5 %); hematomas (5,8 %) y equimosis (10 %), a pesar de una meticulosa hemostasia (figura 7); algunos relacionados con el uso de drenajes 44,45.
Otras complicaciones reportadas son queloides (2,5 %), alteración en la sensibilidad (3 – 14 %), asimetría (7 %) por redundancia de piel, necrosis de la areola o del colgajo y retracciones, hipertrofia (14 %), resección insuficiente o incompleta con persistencia glandular o recurrencia (8 %) 47.
Figura 7. Hematoma, complicación postoperatoria más frecuente de la mastectomía subcutánea simple más colgajo.
Esto ocurre sobre todo en aquellos pacientes con ginecomastia grado 3, por lo que en estos casos se recomienda que el manejo ser haga en conjunto con Cirugía plástica, asociando lipoaspiración, uso de la técnica VASER.
Se debe aclarar al paciente que el objetivo principal del procedimiento es lo funcional 20,34,40,44,45.
Por último, se ha demostrado que el tratamiento quirúrgico para la ginecomastia en pacientes jóvenes trae efectos beneficiosos significativos en la calidad de vida, con mejoría en ámbitos de función física, salud general, vitalidad, salud mental y psicosocial.
Los mejores cambios en el desarrollo hacia una mejor calidad de vida posoperatorio se obtienen en los pacientes más jóvenes, más obesos y con ginecomastia moderada a severa (grado 2 y 3) 45,46,48.
Conclusión – Ginecomastia
La ginecomastia, ya sea idiopática, patológica o medicamentosa, consiste en el crecimiento glandular mamario en el hombre, como consecuencia de la alteración en la relación testosterona- estrógeno.
Como es un hallazgo común en adultos, resulta un motivo relativamente frecuente de consulta en los servicios de cirugía general, en búsqueda de mejoría de la apariencia física y disminución de repercusión psicológica.
Su diagnóstico se realiza con base en la inspección visual y táctil de la mama, que suele ser más fácil al superar los 0,5 cm de diámetro.
Además, se debe hacer una anamnesis completa, teniendo en cuenta su duración, inicio y presencia de dolor, para poder estadificarla en la clasificación de Simon BE.
El manejo farmacológico se recomienda en la fase temprana de la enfermedad o en estadio o grado menor de 2.
Aunque existan tres tipos de fármacos para el manejo de la ginecomastia, el más eficaz (a excepción de pacientes con hipogonadismo), es el Tamoxifeno, utilizado a dosis de 20 mg por día.
Se debe plantear la opción quirúrgica, de acuerdo con el grado de la ginecomastia, al fallar el tratamiento médico o aumentar la angustia del paciente, por la presión psicológica, sobre todo en los adolescentes, o en aquellos pacientes con mayor riesgo de desarrollar cáncer de mama, como aquellos con antecedentes familiares de cáncer de mama o enfermedades con hiperestrogenismo.
Se debe informar, con una explicación clara, detallada y minuciosa, sobre los riesgos del procedimiento, por ejemplo: sangrado, hematomas, dehiscencia de sutura, necrosis de la areola o colgajo, retracción de la piel y un mal resultado estético, antes de obtener el consentimiento informado diligenciado.
Consideraciones éticas
Consentimiento informado: Este estudio es una revisión de la literatura, y como tal no hay necesidad de un consentimiento informado ni de aprobación del Comité de Ética Institucional. Sin embargo, se obtuvo consentimiento informado de los pacientes para los procedimientos, aceptación de la reproducción y publicación de las fotos con fines académicos.
Conflicto de intereses: Ninguno declarado por los autores.
Fuentes de financiación: Recursos propios de los autores.
Contribución de los autores:
– Concepción y diseño del estudio: Alfonso Palmieri- Luna, Linda Lucía Guardo-Martínez.
– Adquisición de datos: Alfonso Palmieri-Luna.
– Análisis e interpretación de datos: Alfonso Palmieri- Luna.
– Redacción del manuscrito: Alfonso Palmieri-Luna, Jaime Andrés González-Vega, Linda Lucía Guardo- Martínez, Adriana María Palmieri, Luz Adriana Hernández.
– Revisión crítica: Alfonso Palmieri-Luna, Jaime Andrés González-Vega, Luz Adriana Hernández.
Referencias – Ginecomastia
1. Bonte A, Guerreschi P, Duquennoy-Martinot V. Ginecomastia: técnicas quirúrgicas e indicaciones. EMC – Cirugía Plástica Reparadora y Estética. 2013;21:1–9. https:doi.org/10.1016/s1634-2143(13)65966-x
2. Oroz J, Pelay MJ, Roldán P. Ginecomastia. Tratamiento quirúrgico. Anales Sis San Navar. 2005;28:109–16.
3. Koch T, Bräuner EV, Busch AS, Hickey M, Juul A. Marked increase in incident gynecomastia: A 20-year national registry study, 1998 to 2017. J Clin Endocrinol Metab. 2020;105:3134–40. https://doi.org/10.1210/clinem/dgaa440
4. Swerdloff RS, Ng CM. Gynecomastia: Etiology, Diagnosis, and Treatment. In: Feingold KR, Anawalt B, Boyce A, Chrousos G, de Herder WW, Dungan K, et al., editors. Endotext. South Dartmouth (MA): MDText.com, Inc.; 2000–. PMID: 25905330.
5. Barrantes-Rodríguez K. Ginecomastia: manifestaciones, etiología, abordaje diagnóstico y tratamiento. Med Leg Costa Rica. 2016;33:205–10.
6. Calderón W, Cabello R, Israel G, Bassa J, Kauak L, Olguín F, Calderón D. Ginecomastia y pseudoginecomastia. Tratamiento. Rev Chil Cir. 2009;61:131–5. https:doi.org/10.4067/s0718-40262009000200005
7. Nuttall FQ. Gynecomastia as a physical finding in normal men. J Clin Endocrinol Metab. 1979;48:338–40. https:doi.org/10.1210/jcem-48-2-338
8. Braunstein GD, Anawalt BD. Epidemiology, pathophysiology, and causes of gynecomastia. Up to date. 2020. Fecha de consulta: 28 de agosto de 2020. Disponible en: https://www.uptodate.com/contents/epidemiology- pathophysiology-and-causes-of-gynecomastia
9. Jacome-Roca A. Ginecomastia: ¿cuándo estudiarla? Rev Colomb Endocrinol Diabetes Metab. 2017;4:25–32.
10. Pensler JM, Silverman BL, Sanghavi J, Goolsby C, Speck G, Brizio-Molteni L, Monteni A. Estrogen and progesterone receptors in gynecomastia. Plast Reconstr Surg. 2000;106:1011–3. https:doi.org/10.1097/00006534-200010000-00009
Bibliografías – Ginecomastia
11. Batteux B, Llopis B, Muller C, Khuori C, Moragny J, Liabeuf S, et al. The drugs that mostly frequently induce gynecomastia: A national case – noncase study. Therapie. 2020;75:225–38. https:doi.org/10.1016/j.therap.2019.06.001
12. Kaneda Y, Fujii A, Yamaoka T, Morimoto T, Nagamine I. Neither gynecomastia nor galactorrhea is a common side effect of neuroleptics in male patients. Neuro Endocrinol Lett. 2000;21:447–51.
13. Nuñez-Rodríguez FJ, Artola-Aizalde E, Cancela-Muñiz V, Fernandez-Ramos C, Rodrigo-Palacios J. Ginecomastia. Fisiopatología y actualización de las opciones terapéuticas. Bol Pediatr. 2010;50:263–71.
14. Levin E, Hammes S. Capítulo 40: Estrógeno y progestágeno. En: Brunton L, Chabner B, Knollmann B, editors. Goodman & Gilman: Las bases farmacológicas de la terapeútica. 12 ed. México: McGraw Hill; 2012. p. 1165–75.
15. Snyder P. Capítulo 41: Andrógenos. En: Brunton L, Chabner B, Knollmann B, editors. Goodman & Gilman: Las bases farmacológicas de la terapéutica. 12 ed. México: McGraw Hill; 2012. p. 1196–205.
16. Direcció General d’Ordenació i Regulació Sanitària (Departament de Salut). Boletín de Farmacovigilancia de Cataluña. Ginecomastia inducida por medicamentos. Departamento de salud Generalidad de Cataluña. 2013;11: 1–4. Fecha de consulta: 28 de agosto de 2020. Disponible en: https://scientiasalut.gencat.cat/handle/11351/2327
17. Caminos-Torres R, Ma L, Snyder PJ. Testosterone -induced inhibition of the LH and FSH responses to gonadotropin-releasing hormone occurs slowly. J Clin Endocrinol Metab. 1977;44:1142–53. https:doi.org/10.1210/jcem-44-6-1142
18. Roberto G, Biagi C, Montanaro N, Koci A, Moretti U, Motola D. Statin-associated gynecomastia: evidence coming from the Italian spontaneous ADR reporting database and literature. Eur J Clin Pharmacol. 2012;68:1007–11. https:doi.org/10.1007/s00228-012-1218-5
Lecturas Recomendadas – Ginecomastia
19. Braunstein GD, Anawalt BD. Clinical features, diagnosis, and evaluation of gynecomastia in adults. Up to date. 2020. Fecha de consulta: 28 de agosto de 2020. Disponible en: https://www.uptodate.com/contents/ clinical-features-diagnosis-and-evaluation-of-gynecomastia- in-adults
20. Braunstein GD. Gynecomastia. N Engl J Med. 2007; 357:1229–37. https:doi.org/10.1056/NEJMcp070677
21. Andersen JA, Gramo JB. Gynecomasty: histological aspects in a surgical material. Acta Pathol Microbiol Immunol Scand A. 1982;90:185–90.
22. Simon BE, Hoffman S, Kahn S. Classification and surgical correction of gynecomastia. Plast Reconstr Surg. 1973;51:48–52. https:doi.org/10.1097/00006534-197301000-00009
23. Mainiero MB, Lourenco AP, Barke LD, Argus AD, Bailey L, Carkaci S, et al. ACR appropriateness criteria evaluation of the symptomatic male breast. J Am Coll Radiol. 2015;12:678–82. https:doi.org/10.1016/j.jacr.2015.03.024
24. Braunstein GD, Anawalt BD. Management of gynecomastia. Up to date. 2019. Fecha de consulta: 28 de agosto de 2020. Disponible en: https://www.uptodate.com/contents/management-of-gynecomastia#H23
25. Ting AC, Chow LW, Leung YF. Comparison of tamoxifen with danazol in the management of idiopathic gynecomastia. Am Surg. 2000;66:38–40.
26. Fradet Y, Egerdie B, Andersen M, Tammela TL, Nachabe M, Armstrong J, et al. Tamoxifen as prophylaxis for prevention of gynaecomastia and breast pain associated with bicalutamide 150 mg monotherapy in patients with prostate cancer. Eur Urol Suppl. 2007;6:28. https:doi.org/10.1016/S1569-9056(07)60024-4
27. Jones DJ, Holt SD, Surtees P, Davison DJ, Coptcoat MJ. A comparison of danazol and placebo in the treatment of adult idiopathic gynaecomastia: results of a prospective study in 55 patients. Ann R Coll Surg Engl. 1990;72:296–8.
Citas Bibliográficas – Ginecomastia
28. Wibowo E, Pollock PA, Hollis N, Wassersug RJ. Tamoxifen in men: a review of adverse events. Andrology. 2016;4:776–88. https:doi.org/10.1111/andr.12197
29. Kuhn JM, Roca R, Laudat MH, Rieu M, Luton JP, Bricaire H. Studies on the treatment of idiopathic gynaecomastia with percutaneous dihydrotestosterone. Clin Endocrinol (Oxf). 1983;19:513–20. https:doi.org/10.1111/j.1365-2265.1983.tb00026.x
30. Eberle AJ, Sparrow JT, Keenan BS. Treatment of persistent pubertal gynecomastia with dihydrotestosterone heptanoate. J Pediatr. 1986;109:144–9. https:doi.org/10.1016/S0022-3476(86)80596-0
31. Braunstein GD. Aromatase and gynecomastia. Endocr Relat Cancer. 1999;6:315–24. https:doi.org/10.1677/erc.0.0060315
32. Lapid O, Jolink F, Meijer SL. Pathological findings in gynecomastia: Analysis of 5113 breasts. Ann Plast Surg. 2015;74:163–6. https:doi.org/10.1097/SAP.0b013e3182920aed
33. Krause W. Male breast cancer – an andrological disease: risk factors and diagnosis. Andrologia. 2004;36:346– 54. https:doi.org/10.1111/j.1439-0272.2004.00639.x
34. Baumann K. Gynecomastia – Conservative and surgical management. Breast Care. 2018;13:419–24. https:doi.org/10.1159/000494276
35. Menville JG. Gynecomastia. Arch Surg. 1933;26:1054- 83. https:doi.org/10.1001/archsurg.1933.01170060123008
36. Maliniac JW. Breast Hypertrophy in the Male: Report of Two Cases of Pseudogynecomastia with Surgical Reconstruction. J Clin Endocrinology & Metabolism. 1943;3:364–6. https://doi.org/10.1210/jcem-3-6-364
37. Webster JP. Mastectomy for gynecomastia through a semicircular intra-areolar incision. Ann Surg. 1946;124:557–75. https:doi.org/10.1097/00000658-194609000-00011
38. Pitanguy I. Transareolar incision for gynecomastia. Plast Reconstr Surg. 1966;38:414-9. https://doi.org/10.1097/00006534-196611000-00004
Reseñas Bibliográficas – Ginecomastia
39. Davidson BA. Concentric circle operation for massive gynecomastia to excise the redundant skin. Plastic & Reconstructive Surgery. 1979;63:350-4. http://dx.doi.org/10.1097/00006534-197903000-00009
40. Benelli L. A new periareolar mammaplasty: The “round block” technique. Aesthetic Plast Surg. 1990;14:93– 100. https:doi.org/10.1007/BF01578332
41. Longheu A, Medas F, Corrias F, Farris S, Tatti A, Pisano G, et al. Surgical management of gynecomastia: Experience of a general surgery center. G Chir. 2016;37:150–4. https:doi.org/10.11138/gchir/2016.37.4.150
42. Waltho D, Hatchell A, Thoma A. Gynecomastia classification for surgical management: A systematic review and novel classification system. Plastic and Reconstructive Surgery. 2017;139:638e-648e. https:doi.org/10.1097/PRS.0000000000003059
43. Rohrich RJ, Ha RY, Kenkel JM, Adams WP. Classification and management of gynecomastia: defining the role of ultrasound-assisted liposuction. Plast Reconstr Surg. 2003;111:909-25. https:doi.org/10.1097/01.PRS.0000042146.40379.25
44. Filho D de LF, Ferreira NCF de L, Ferreira T de L. Clinical and surgical evaluation of gynecomastia: tactic and results. Mastology. 2020;30:1–7. https:doi.org/10.29289/25945394202020200010
45. Holzmer SW, Lewis PG, Landau MJ, Hill ME. Surgical management of gynecomastia: A comprehensive review of the literature. Plast Reconstr Surg Glob Open. 2020;8:e3161. https:doi.org/10.1097/GOX.0000000000003161
Referencias Bibliográficas – Ginecomastia
46. Nuzzi LC, Firriolo JM, Pike CM, Cerrato FE, DiVasta AD, Labow BI. The effect of surgical treatment for gynecomastia on quality of life in adolescents. J Adolesc Heal. 2018;63:759–65. https:doi.org/10.1016/j.jadohealth.2018.06.028
47. Thiruchelvam P, Walker JN, Rose K, Lewis J, Al-Mufti R. Gynaecomastia. BMJ. 2016;354:i4833. https:doi.org/10.1136/bmj.i4833
48. Ratnam BV. A new classification and treatment protocol for gynecomastia. Aesthetic Surg J. 2009;29:26–31. https:doi.org/10.1016/j.asj.2008.11.003
Autores – Ginecomastia
1 Alfonso Palmieri, Médico, especialista en Cirugía General y Cirugía Laparoscópica; Clínica Santa María; docente de cátedra, asignatura Salud del
Adulto II, Programa de Medicina, Universidad de Sucre, Sincelejo, Colombia.
2 Jaime Andrés González, Linda Lucía Guardo, Estudiante de Medicina, Universidad de Sucre, Sincelejo, Colombia
3 Adriana María Palmieri, Estudiante de Medicina, Universidad del Norte, Barranquilla, Colombia.
4 Luz Adriana Hernández, Maestría en Enfermería, especialista en Auditoría y Salud Ocupacional; coordinadora de la relación docencia-servicio, Facultad de Ciencias de la Salud, Universidad de Sucre, Sincelejo, Colombia
Fecha de recibido: 13/11/2020 – Fecha de aceptación: 14/02/2021 – Fecha de publicación en línea: 19/04/2021
Correspondencia: Alfonso Palmieri-Luna, Carrera 43 # 25A – 04, Sincelejo, Colombia. Teléfono: +57 3205122401 Dirección electrónica: alfonso.palmieri@unisucre.edu.co, alfonsopalmieri@hotmail.com
Citar como: Palmieri A, González JA, Guardo LL, Palmieri AM, Hernández LA. Ginecomastia: Consideraciones médicas y quirúrgicas en cirugía general. Rev Colomb Cir. 2021;36:499-513. https://doi.org/10.30944/20117582.750
Este es un artículo de acceso abierto bajo una Licencia Creative Commons – BY-NC-ND https://creativecommons.org/licenses/by-ncnd/ 4.0/deed.es
CLIC AQUÍ Y DÉJANOS TU COMENTARIO