Manejo de metástasis hepáticas, Resección quirúrgica
El hígado es un órgano complejo y, por ende, los procedimientos quirúrgicos hepáticos requieren no solo de un conocimiento preciso de la anatomía, sino también, de una técnica quirúrgica depurada y precisa que permita la resección completa de las lesiones neoplásicas, dejando siempre un adecuado parénquima funcional que sea compatible con la vida 25,26.
Los objetivos quirúrgicos son poca pérdida sanguínea, periodos cortos de isquemia hepática y baja morbimortalidad posquirúrgica. La pérdida sanguínea es por sí misma un factor predictor independiente de mortalidad e impacta, al igual que las complicaciones posoperatorias, en el pronóstico a largo plazo de las metastasectomías hepáticas por cáncer colorrectal.
Es necesario garantizar un volumen mínimo de hígado remanente, adecuado para un buen funcionamiento que evite la aparición de falla hepática posquirúrgica y la muerte. En general, se acepta que en los pacientes oncológicos se deje un volumen residual funcional de más del 20 %, cuando el parénquima hepático se considera sano, de más del 30 %, cuando ha habido quimioterapia previa, y de más del 40 %, cuando existe alguna hepatopatía crónica 27,28.
Idealmente, a menos que sea indispensable, se debe evitar la maniobra de Pringle (pinzar en bloque el hilio hepático), ya que su uso prolongado genera un daño isquémico que se ha asociado con una mayor tasa de recurrencia de la enfermedad metastásica. Si bien es posible hacer esta maniobra con interrupciones, hasta durante 120 minutos y de manera segura, el preacondicionamiento isquémico permite hacerlo por un tiempo mayor, también de manera segura 29.
Uno de los parámetros que claramente impacta el pronóstico oncológico de los pacientes operados, es la posibilidad de una adecuada resección de la lesión tumoral con márgenes microscópicos negativos para patología tumoral; de hecho, este es el único factor que ha logrado impactar la supervivencia, la tasa de recurrencia y el tiempo libre de enfermedad, cuando se ofrece un tratamiento quirúrgico 30.
Existen dos tipos de resección, la anatómica y la preservadora de parénquima. En varios estudios se ha demostrado que el tipo de resección no influye en forma importante en el pronóstico del paciente 31-33. No obstante, las que preservan el parénquima se asocian con menores tasas de sangrado y de complicaciones que las resecciones anatómicas 34; además, la preservación de más parénquima sano es esencial para la función hepática posoperatoria 35,36.
La discusión se ha centrado en el tamaño necesario del margen de resección, es decir, la distancia entre la línea de resección y el borde microscópico de la lesión tumoral, por lo cual se han llevado a cabo múltiples estudios, todos con resultados variables. Are, et al. 37, analizaron el impacto del tamaño del margen de resección en el pronóstico a largo plazo de estos pacientes; en total, se incluyeron 1.019 casos en los cuales se comparó la supervivencia a cinco años, según el tamaño del margen de resección. La supervivencia fue del 29 % con márgenes menores de 1 mm, de 35 % con márgenes entre 1 y 5 mm, de 40% con márgenes de 5 a 10 mm, y de 45 % con márgenes de más de 10 mm. Se concluyó que, idealmente, los márgenes de resección en estas circunstancias deben ser de más de un cm, pero que la imposibilidad para lograrlos no es una contraindicación para no resecar la lesión tumoral.
Por otro lado, Pawlik, et al. 38, midieron la supervivencia a cinco años de los pacientes sometidos a cirugía y su relación con los márgenes de resección. Con márgenes microscópicamente positivos para tumor, la supervivencia fue de 17,1 % y, con márgenes negativos, fue de 63,8 %; no hubo variación importante según el tamaño del margen de resección: 62,3 % con márgenes de 1 a 4 mm, 71 % con márgenes de 5 a 9 mm y 63 % en márgenes de más de 1 cm.
Por lo anterior, y teniendo en cuenta que el promedio de la diseminación tumoral microscópica es de 4 mm con respecto al margen macroscópico, se recomienda practicar la resección dejando márgenes de un cm de ancho, para garantizar la ausencia de enfermedad tumoral residual.
Cirugía mínimamente invasiva
Con el avance de las técnicas mínimamente invasivas, ahora es posible realizar procedimientos mayores completamente laparoscópicos de manera segura, con resultados oncológicos equiparables a los de la cirugía abierta y con una aceptable morbimortalidad 39,40, y, además, con menor tasa de sangrado, menor tasa de infección y una recuperación más rápida 41-45. Para conseguir estos resultados, Vigano, et al., consideran necesaria una adecuada curva de entrenamiento y practicar, como mínimo, 60 procedimientos, lo cual solo es posible en centros de alta complejidad y con gran volumen de casos de este tipo 46.
Ecografía intraoperatoria
Desde su descripción por Makuuchi en 1977, el examen hepático intraoperatorio mediante ecografía ha venido ganando popularidad, hasta convertirse en un componente fundamental de la cirugía hepática moderna. Este método diagnóstico es esencial para practicar una resección preservadora de parénquima, ya que permite minimizar los márgenes de resección mientras se conserva la radicalidad oncológica, disminuyendo la resección innecesaria de tejido 47,48.
La ecografía intraoperatoria permite confirmar las metástasis ya conocidas e identificar aquellas que pasaron inadvertidas en los estudios previos de extensión, particularmente las de menos de un cm, en las cuales es menor el rendimiento diagnóstico de la resonancia magnética y de la tomografía axial. Además, hace posible observar las relaciones vasculares y biliares de las lesiones neoplásicas, e identificar el flujo portal, como guía para el tipo de resección o la ablación necesaria, y está disponible también por vía laparoscópica.
En una revisión de Ruzzenente, et al., la ecografía intraoperatoria con contraste permitió identificar lesiones adicionales en 14 % de los casos y se cambió la conducta quirúrgica en el 18 %, lo cual mejoró la tasa de resección con márgenes negativos para tumor (R0) 49.
Técnicas ablativas
La ablación consiste en destruir el tumor hepático sin resecarlo. Los procedimientos ablativos se dividen en dos grandes grupos, la ablación regional transarterial y la ablación local 50. En la ablación regional transarterial, se hacen llegar agentes quimioterápicos al tumor por medio de su irrigación, para inducir isquemia citotóxica. En la ablación local, se induce necrosis tumoral mediante la inyección de agentes citotóxicos o sustancias químicas que producen isquemia, o mediante la transmisión de energía térmica directamente al tejido tumoral 51.
Se han descrito múltiples técnicas para el manejo ablativo de las metástasis hepáticas, y la más frecuentemente utilizada es la ablación por radiofrecuencia. En varios estudios se han demostrado mejores resultados oncológicos al comparar la ablación con el manejo paliativo; sin embargo, cuando se compara con la resección quirúrgica, muestra una menor supervivencia, ya que la ausencia de una necrosis completa de coagulación y la persistencia de células tumorales residuales después del procedimiento llevan a que las tasas de recurrencia sean mayores 52. Esto es particularmente cierto en lesiones mayores de 2,5 cm.
Por lo tanto, todos los pacientes con lesiones susceptibles de manejo quirúrgico deben ser sometidos a cirugía, reservando las terapias ablativas únicamente para aquellos que por sus condiciones clínicas no pueden ser operados, o para aquellos pacientes cuyas lesiones se localicen profundamente en el parénquima hepático y sean de tamaño pequeño, requiriendo procedimientos quirúrgicos complejos para su resección con pérdida de gran cantidad de parénquima hepático sano; en este último grupo de pacientes, se puede acompañar con la resección quirúrgica de otras lesiones a las cuales, por su localización, se puede acceder más fácilmente 53.
Volumen hepático funcional residual
El volumen funcional residual del hígado se refiere al volumen de parénquima hepático que queda después de una resección quirúrgica, ya sea por enfermedad benigna o maligna. Su entendimiento es esencial, ya que, si bien el ser humano es incapaz de vivir sin hígado, puede tolerar resecciones hepáticas amplias siempre que se conserve un volumen de parénquima que cumpla las funciones orgánicas, inmunológicas, metabólicas y digestivas normales.
Está claro que un volumen hepático funcional residual insuficiente lleva a disfunción hepática posoperatoria, que provocará la muerte del paciente. Así las cosas, garantizar un adecuado volumen funcional residual es importante durante la planeación de un procedimiento quirúrgico que involucre la resección hepática en cualquier proporción. Su cálculo se hace mediante una volumetría hepática por resonancia magnética o tomografía axial, las cuales permiten la reconstrucción tridimensional del hígado residual futuro y su comparación con el volumen total hepático, lo cual da como resultado un porcentaje que será la guía para definir la posibilidad o imposibilidad de practicar la resección quirúrgica (figura 3).
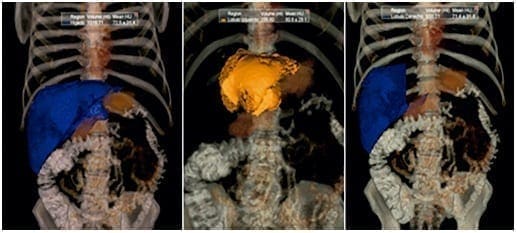
En general, se acepta como guía para la práctica de cualquier procedimiento quirúrgico que involucre la resección hepática, la regla 20/30/40. Según esta regla: el volumen funcional residual necesario cuando el parénquima hepático está sano, debe ser de, por lo menos, el 20 %; cuando el parénquima está sano pero va a someterse a quimioterapia, se requiere un remanente hepático de más del 30 % 54, y cuando el hígado es cirrótico, se requiere un volumen funcional residual de más del 40 % 55-57. Esto garantiza intervenciones quirúrgicas seguras con poca morbimortalidad posoperatoria. Como todos estos pacientes se encuentran con enfermedad diseminada que requerirá el uso de quimioterapia, se debe garantizar, por lo menos, un volumen funcional residual de más del 30 % con el fin de evitar la disfunción hepática posoperatoria.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO