Varios estudios con los cuales se ha evaluado el desempeño de la neuromonitorización, determinaron que su sensibilidad puede estar entre el 25 y el 75 % y, su especificidad, por encima del 93 %. Esto quiere decir que si al final del procedimiento la señal es buena, podemos estar casi seguros (error del 7 %) de que no hay lesión. Pero, por el contrario, si al final la señal es pobre, la posibilidad de que el nervio esté realmente lesionado es baja (error entre 25 y 75 %). La reflexión que se debe hacer es para qué se utiliza el neuromonitor: para que diga que el nervio está sano (muy específico) o para que diga si está lesionado (muy sensible). Si se practica una tiroidectomía de forma rutinaria y la frecuencia de complicaciones está cercana a lo reportado en la literatura científica, lo más probable es que se utilice la tecnología para determinar si las cosas no van como ocurren normalmente (un método muy sensible), donde el método tiene serias deficiencias. Sería difícil pensar en el caso contrario, el de un cirujano a quien la mayoría de las veces le vaya mal y, entonces, utilice el método para asegurarse que en ese caso las cosas van bien (muy específico).
Pero, además de esto, el desempeño de la neuromonitorización parece no modificar de forma importante los resultados durante el acto operatorio. A continuación se muestran algunos ejemplos utilizando el nomograma de Fagan 30, que es una herramienta útil para graficar el efecto de un resultado de sensibilidad y especificidad sobre un determinado hecho. He escogido dos situacio nes para facilitar el entendimiento: una de bajo riesgo y otra de alto riesgo.
En el caso de bajo riesgo (figura 2), la probabilidad de tener una lesión definitiva del nervio laríngeo recurrente es de 2 %, mientras que en el caso de alto riesgo (figura 3) es de 10 % (de acuerdo con lo reportado en la literatura). Se utiliza una sensibilidad de 50 % y una especificidad de 90 %, también basadas en la información bibliográfica. Con estos datos se calcula una razón de verosimilitud (likelihood ratio) positiva de 5, que quiere decir que cuando hay una pérdida de señal evidenciada con el monitor, la lesión esperada del nervio es cinco veces mayor que si no hubiera pérdida de señal; y una razón de verosimilitud negativa de 0,5, que quiere decir que cuando la señal del monitor es adecuada, la lesión esperada del nervio es de 0,5 veces (se disminuye a la mitad) que cuando no es adecuada.
En el primer caso de bajo riesgo (figura 2a), si se espera una lesión en el 2 % de los casos y la señal del monitor se pierde, la probabilidad de que el nervio en verdad tenga un daño es de 9,2 %. Aquí surge la pregunta ¿qué hacer? El grupo de estudio en neuromonitorización 31 refiere que primero deben verificarse todas las causas de pérdida de señal (que haya daño del equipo, que se haya desplazado el tubo endotraqueal, que el sensor del estimulador se haya roto, etc.). Si no se encuentra daño, en publicaciones más recientes sugieren esperar de 15 a 20 minutos y volver a estimular; y si definitivamente la señal no se recupera, se sugiere suspender el procedimiento quirúrgico, practicar una laringoscopia al terminar la cirugía y, si no se confirma la parálisis, reintervenir al paciente en la misma hospitalización.
Respecto a esta recomendación hay varios reparos. La primera es que los dos lados de la tiroidectomía tienen riesgos independientes, esto es, que si la lesión ocurre en un lado, el riesgo de que haya lesión en el otro lado sigue siendo el basal, 2 %. Por lo tanto, suspender la cirugía no parece ser una recomendación válida si se tiene experiencia en cirugía de tiroides. Incluso, en casos de invasión tumoral del nervio en un lado, este se secciona y la cirugía se continúa al otro lado sin mayores inconvenientes.
Los autores que favorecen esta recomendación sugieren que el riesgo de lesión del lado contralateral se aumenta, lo cual carece de todo fundamento lógico. Otros aducen que todo depende del lado que se aborde inicialmente. Si se aborda el lado difícil (el de mayor riesgo) y ocurre un daño, es claro que el otro lado tiene un riesgo menor y probablemente se pueda practicar la disección sin mayor dificultad. Si se aborda el lado de menor riesgo inicialmente y hay lesión, el lado de mayor riesgo implicará una posibilidad de lesión más alta y, entonces, debería abortarse la cirugía. Si esta lógica es clara, lo que se debería recomendar es empezar siempre por el lado de menor riesgo y no la de suspender el procedimiento, para evitar las consecuencias propias de esta decisión, como un segundo acto anestésico y quirúrgico, además de la carga emocional que esto conlleva y los costos para el sistema de salud.
En el segundo caso de bajo riesgo (figura 2b), si la señal del monitor se mantiene, la probabilidad de lesión baja de 2 % a 1,2 %, que es escasamente menor a lo esperado. La discusión en este caso es idéntica a la anterior, ¿de qué sirve usar el monitor si el riesgo del nervio contralateral sigue siendo de 2 %? Además, surge la pregunta de si clínicamente es relevante que el riesgo baje de 2 % a 1,2 %.
En el tercer caso de riesgo alto (figura 3a), si la señal del monitor se pierde, el riesgo de lesión neural pasa de 2 % a 35 %, y vuelve a tomar relevancia la discusión del primer caso acerca de cuál lado intervenir primero.
En el cuarto y último caso de alto riego (figura 3b), si la señal del monitor se mantiene, el riesgo de lesión pasa de 10 % a 5,8 %. ¿Qué hacer en este caso? ¿Es esta una disminución que da tranquilidad? O, por el contrario, como es mayor de 2 %, ¿se debe suspender el procedimiento? Pero incluso es menor de 9 % del primer caso, luego, ¿dónde está el límite para detener un procedimiento?
En un estudio más grande sobre pérdida de señal publicado hasta el momento y que incluyó 290 pacientes, se encontró pérdida de señal en 16 de ellos (5,5 %), pero a pesar de todo, el procedimiento quirúrgico se continuó y solo 1 de estos (6,25 % de todas las pérdidas de señal o 0,003 % de todos los pacientes) finalmente tuvo una lesión definitiva y ninguno presentó lesión bilateral de nervios o necesidad de traqueostomía 32.
En últimas, en todos los casos el panorama es muy incierto y el uso del monitor ayuda poco en la toma de decisiones, específicamente cuando se pierde la señal, que es el objetivo con el cual se usa. Puede esperarse que el uso del monitor simplemente introduzca mayor ruido a la decisión de explorar el lado contrario, sin que cambie la probabilidad de una manera tan radical como para confiar en él.
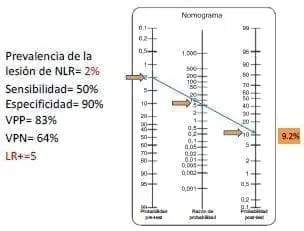 Figura 2a. Comportamiento del resultado de la neuromonitorización en pacientes de bajo riesgo de lesión de nervio cuando la señal se pierde
Figura 2a. Comportamiento del resultado de la neuromonitorización en pacientes de bajo riesgo de lesión de nervio cuando la señal se pierde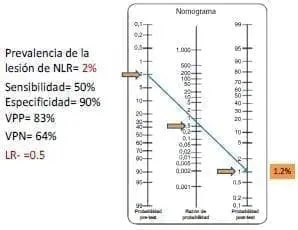 Figura 2b. Comportamiento del resultado de la neuromonitorización en pacientes de bajo riesgo de lesión de nervio cuando la señal se mantiene
Figura 2b. Comportamiento del resultado de la neuromonitorización en pacientes de bajo riesgo de lesión de nervio cuando la señal se mantiene
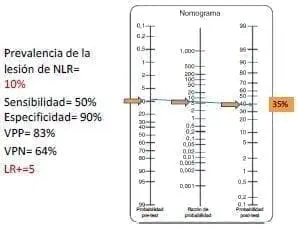 Figura 3a. Comportamiento del resultado de la neuromonitorización en pacientes de alto riesgo de lesión de nervio cuando la señal se pierde
Figura 3a. Comportamiento del resultado de la neuromonitorización en pacientes de alto riesgo de lesión de nervio cuando la señal se pierde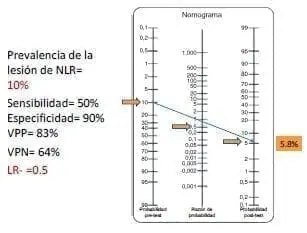 Figura 3b. Comportamiento del resultado de la neuromonitorización en pacientes de alto riesgo de lesión de nervio cuando la señal se mantiene
Figura 3b. Comportamiento del resultado de la neuromonitorización en pacientes de alto riesgo de lesión de nervio cuando la señal se mantieneSe puede ver con mayor facilidad que el número de pacientes efectivamente protegidos por el uso rutinario de la monitorización neural en la tiroidectomía es muy bajo. Esto se explica porque el riesgo de lesión es muy infrecuente (1 %), porque la sensibilidad del método es muy baja (ofrece poca confianza en su resultado de pérdida de señal) y porque, además, introduce ruido donde no lo había previamente (induce a tomar decisiones de suspensión de la cirugía que, finalmente, eran innecesarias y pone en un riesgo inexistente al nervio contralateral, que no depende de la señal del primer nervio explorado).
Así, de entrada, se espera que su efecto en el costo de un procedimiento sea excesivo. Si a esto se le agrega el valor propio de la tecnología (que puede estar alrededor de COP$ 4’500.000 por paciente) y los costos derivados de su uso (el tiempo de la cirugía se prolonga unos minutos porque hay que explorar el nervio vago para hacer las mediciones de entrada) y de las decisiones derivadas de sus resultados (esperar quince minutos que alarga el tiempo quirúrgico, suspender el 5 % de las cirugías, luego reintervenir este mismo número de pacientes) y esto en relación con lo que se evita (unas semanas de disfonía en un porcentaje de los casos, porque algunas parálisis son silentes; la traqueostomía en un número ínfimo de pacientes), se puede ver que la relación costo-beneficio es desequilibrada.
Un estudio realizado por este autor y presentado en el Congreso Nacional de Endocrinología 33, demuestra que la razón ‘incremental’ de costo-utilidad es de COP$ 27 millones por cada unidad de utilidad que se gana y la de costo-efectividad ‘incremental’ es de COP$ 9 millones por cada evento que se evita. Esto es que se debe invertir esa cantidad para disminuir un caso de lesión del nervio laríngeo recurrente. También, más del 60 % de los casos simulados se encuentran en el cuadrante de menor efectividad y mayor costo, lo que hace que el uso de esta tecnología sea oneroso en el medio. Si se compara este valor con lo que cuesta la reparación de una parálisis vocal unilateral, se puede entender que la alternativa de reparación supera con creces la alternativa potencialmente preventiva que se ofrece con el uso del monitor.
