Abordaje Transesternal Transpericárdico, Discusión
Fístula broncopleural
Ocasionalmente los pacientes con tuberculosis requieren resección pulmonar mayor en el manejo de complicaciones asociadas con su enfermedad (hemoptisis, absceso pulmonar, necrosis pulmonar) (4, 27). En este grupo de pacientes, la neumonectomía se relaciona con alto riesgo de desarrollar fístula broncopleural y empiema crónico, en especial en presencia de hilio pulmonar difícil. A pesar de controlar el proceso agudo y salvar la vida del paciente, una fístula broncopleural y empiema pueden complicar el postoperatorio temprano o tardío.
Para el manejo de los pacientes con empiema agudo y fístula broncopleural postresección pulmonar se han diseñado diferentes abordajes.
La ventana de Eloesser, descrita en 1935 para el tratamiento del empiema tuberculoso (9), consiste en realizar una incisión en U invertida, fijando la pleura parietal a la piel y una resección de uno a tres arcos costales para el drenaje libre de la cavidad torácica. Este procedimiento se recomienda como un paso intermedio entre el control de la infección y la mejoría del estado nutricional del paciente, mientras se intenta un procedimiento definitivo para el cierre de la fístula broncopleural y la obliteración del espacio pleural (10, 11).
Sin embargo, en series con seguimiento a largo plazo, la mayoría de los pacientes permaneció con el tórax abierto, en general ante la persistencia de una fístula broncopleural crónica (12). Clagget describió una alternativa a la ventana de Eloesser para controlar el proceso infeccioso y el cierre de la fístula broncopleural postneumonectomía (13). El método consiste en realizar una toracostomía abierta con resección costal, por lo regular el sitio de la toracotomía previa, seguida de múltiples desbridamientos de la cavidad torácica con intercambio de compresas de húmedas a secas hasta obtener una cavidad limpia, momento en el cual se intenta cerrar la fístula con remodelación del muñón bronquial, si la fístula es aún evidente.
Para el cierre de la cavidad torácica se rellena el espacio pleural con antibióticos y se procede al cierre por planos (8); casi siempre es necesario liberar los planos musculares de las adherencias para obtener un afrontamiento adecuado de las fascias.
La persistencia de una fístula broncopleural se asocia con falla del procedimiento de Clagget (14):
Lo cual lleva a la transposición de los colgajos musculares intratorácicos para el cierre del muñón bronquial, que permite reforzar el cierre de la fístula con tejido vascularizado e idealmente disminuye el espacio muerto intratorácico (15). La rotación de los colgajos musculares intratorácicos para el cierre de la fístula broncopleural y reforzamiento del muñón bronquial controla el proceso infeccioso más rápidamente en la mayoría de los pacientes (16), con cierre posterior de la cavidad torácica en 79% de los casos (15, 17), morbilidad alrededor de 45% y mortalidad entre 16,4% y 20% (18-20).
Otras alternativas en el manejo del empiema con fístula broncopleural postresección pulmonar incluyen el uso de sellantes intrabronquiales para fístulas pequeñas (21) y la transposición de epiplón mayor. El cierre de la fístula con sellante de fibrina (22) o hueso esponjoso descalcificado a través de broncoscopia, en fístulas menores de 5 mm, se asocia con mortalidad de 14%, y probabilidades de cierre de 31%.
Sin embargo, uno de cada tres pacientes requiere cirugía adicional por falla del procedimiento (23). La remodelación del muñón vía transtorácica, con el tórax abierto, se asocia con control de la fístula en 43% y mortalidad de 41% (24). La rotación de omento al mediastino, descrito en el manejo de la anastomosis bronquial en el trasplante pulmonar (25), se ha popularizado para el manejo de la fístula broncopleural postresección pulmonar; sin embargo, a pesar de requerir una laparotomía adicional, los resultados son comparables a los colgajos musculares intratorácicos (26).
El desarrollo de una fístula broncopleural tardía (fístula broncopleural crónica) y empiema (en ocasiones a necesidad) es una situación crónica debilitante.
Los muñones bronquiales largos acentúan el proceso infeccioso con acumulación de secreciones sobreinfectadas. El manejo inicial con la ventana de Eloesser permite controlar el proceso infeccioso agudo. Sin embargo, la persistencia de la fístula broncopleural crónica se caracteriza por drenaje constante a través de la ventana de toracostomía, desnutrición y riesgo de reactivación de la tuberculosis con gérmenes multirresistentes o reinfección.
Adicionalmente, hay implicaciones sociales serias por el rechazo social y familiar del individuo debido al drenaje purulento fétido permanente por la cavidad torácica; lo anterior, asociado al dolor crónico, genera limitaciones funcionales e incapacidad laboral.
Un muñón bronquial largo con fístula persistente e infección crónica se asocia con engrosamiento severo de la pleura mediastinal, de manera que el abordaje transtorácico es laborioso y raramente exitoso, por la difícil identificación de las estructuras anatómicas y el adecuado control vascular. Por el contrario, al abordar el mediastino anteriormente por una estereotomía media, se identifican y disecan con relativa facilidad las estructuras hiliares en un campo operatorio virgen, teóricamente libre de infección.
La vía transesternal transpericárdica se considera el abordaje más efectivo para el cierre de la fístula broncopleural crónica cuando otras estrategias han fallado, o cuando el abordaje directo a través de la cavidad torácica (por toracotomía) no es posible (43).
La técnica consiste en realizar una estereotomía mediana.
Una vez disecada la grasa mediastinal anterior, se rechazan lateralmente en sentidos opuestos la vena cava superior y la aorta, lo cual permite abordar el pericardio por vía anterior. Después se realiza una pericardiotomía longitudinal para acceder a la porción intrapericárdica de la arteria pulmonar derecha.
Luego de disecado el aspecto superior de la arteria pulmonar derecha, ésta se rechaza de manera delicada en sentido caudal, llegando al pericardio posterior. Una vez se practica la pericardiotomía posterior, se logra la exposición de la carina. Es posible encontrar el mediastino severamente desviado hacia el lado de la neumonectomía previa. En este momento es posible disecar ambos bronquios fuentes.
Se debe tener cuidado al desvascularizar la tráquea en su aspecto lateral, y no lesionar las arterias bronquiales y el esófago (localizado posteriormente). Luego de identificado el muñón bronquial largo, se diseca en forma circunferencial. En el lado izquierdo es posible encontrar el esófago adherido por el proceso infeccioso crónico y es importante no lesionar el recurrente laríngeo. El corte del muñón bronquial largo se realiza a ras de la carina y el cierre se hace manual con vicril tres o cuatro ceros con puntos separados.
Existe discusión acerca del manejo del muñón distal al corte.
general, el muñón distal a la carina está firmemente adherido a la pleura mediastinal y en sentido anterior al muñón de la arteria pulmonar correspondiente correspondiente a la neumonectomía previa; su disección puede complicarse con lesión vascular mayor.
En presencia de adherencias severas y riesgo importante de lesión vascular es preferible cauterizar la mucosa distal para evitar mucoceles. Algunos autores usan grapadora mecánica y sólo realizan grapado a ras de la carina sin cortar el bronquio, lo cual se puede asociar con recanalización de la fístula; otros refuerzan el muñón con tejido vascularizado, incluyendo rotación de pericardio (43) o transposición del omento para reforzar la cobertura del muñón (44).
Se han descrito diferentes técnicas cuando la longitud del muñón bronquial derecho es menor de 5 mm.
Debido al limitado número de casos, los resultados varían con base en reporte y la experiencia del autor. En ocasiones se describe la reamputación del tronco remanente de la arteria pulmonar derecha para obtener una adecuada exposición del bronquio fuente derecho y de la carina (43). La resección de la carina y el reimplante del bronquio izquierdo a la tráquea se reportan con éxito (45). Alternativamente, se han descrito la resección en cuña de la tráquea y el cierre con tejido bronquial sano para evitar tensión sobre las suturas (46).
Históricamente, el abordaje anterior a la carina y el bronquio fuente derecho fue descrito por Goez, en 1907 para la extracción de un cuerpo extraño (28); y hace más de cuatro décadas se reintrodujo en la literatura norteamericana para el manejo de la fístula broncopleural (29). La técnica consistía en una toracotomía vertical parasternal con resección de múltiples cartílagos pericostales.
En 1961 se describe su uso en el manejo de la fístula broncopleural crónica por tuberculosis (30). En 1967 se reporta en la literatura japonesa el abordaje transesternal para el manejo del muñón bronquial (31). Y en Europa, el abordaje transesternal se describe a principios de los años 70 y los resultados se publican una década más tarde (32).
Posteriormente, se propone la abertura del pericardio anterior y posterior (abordaje transesternal transpericárdico) para facilitar el acceso de la carina y del bronquio fuente izquierdo (33).
En 1973 aparece en los libros de texto franceses como una de las técnicas propuestas en el manejo quirúrgico de la tuberculosis pulmonar (34). Después se publica una serie de cuatro casos para el manejo de la fístula broncopleural tardía (35).
En Norteamérica en 1983, se describe un caso exitoso en el manejo de una fístula broncopleural crónica posterior a una neumonectomía por trauma (36); en 1988 aparece una descripción en textos norteamericanos para el abordaje del bronquioderecho (37). Debido a la baja incidencia de tuberculosis en los países desarrollados, su divulgación en la literatura contemporánea es escasa y generalmente se reserva para el abordaje de la carina en la resección de tumores carinales (38, 39). Reportes recientes describen su uso para neumonectomías en necrosis pulmonar y empiema crónico (40), o para el manejo de la fístula broncopleural crónica postlobectomía que requiere completar la neumonectomía (41), y en el manejo de la mediastinitis necrotizante (42).
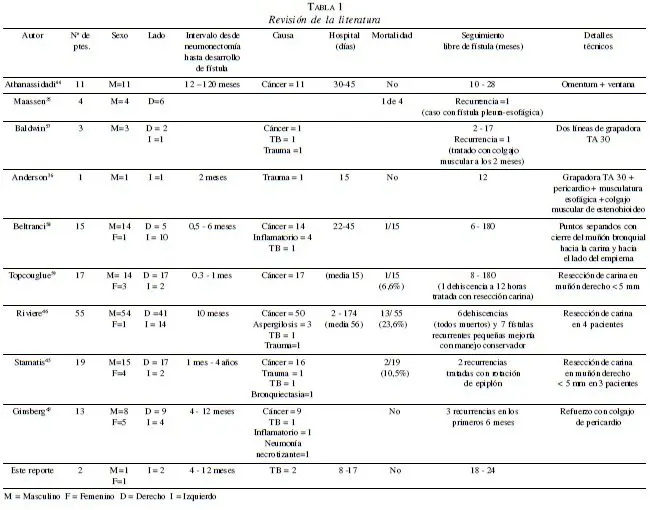
La tabla 1 describe la revisión de 140 casos en la literatura publicados durante los últimos 25 años (incluyendo los dos descritos), con pacientes recolectados en períodos de hasta 20 años según de la serie. La tuberculosis fue la patología primaria en 7% de los casos (diez pacientes) y la mayoría fue secundaria a cáncer pulmonar en 84% (118 pacientes).
Otras patologías abarcaron el 9% de los casos (enfermedad inflamatoria crónica, aspergilosis y trauma en tres pacientes cada uno, respectivamente; y neumonía necrotizante, bronquiectasia y granulomatosis bronquial en un paciente cada uno, respectivamente).
El 70% de los casos ocurrió posterior a neumonectomía derecha, concordando con complicaciones descritas en otras series postneumonectomía (44, 47-49, 50, 51). El 89% de los pacientes fueron hombres; la mayoría de las fístulas se presentó durante el primer año de la neumonectomía (intervalo entre 10 días a 120 meses).
La mortalidad perioperatoria es alrededor de 14% (20 de 140 pacientes), más baja que el 20% asociado con la neumonectomía postresección pulmonar previa (“completion pneumonectomy”) por cáncer (52- 54), o el 24% por enfermedad crónica con Mycobacterium (55). El tiempo de hospitalización varía entre 8 a 174 días. Con una tasa de recurrencia de 10%. La fístula recurrió en todos los casos (catorce pacientes) durante los primeros seis meses del seguimiento.
La principal desventaja del abordaje transmediastinal es que no permite manejar el empiema en un solo acto quirúrgico y se requieren múltiples múltiples lavados de la cavidad pleural infectada. El manejo tópico de la cavidad pleural se facilita una vez se cierra la fístula broncopleural y disminuye la contaminación proveniente de la vía área. Algunos autores realizan lavados tópicos a través de un tubo de toracostomía (45); nosotros preferimos un drenaje más amplio con una ventana de Eloesser. En general, los lavados quirúrgicos iniciales se hacen en las salas de cirugía progresando a cambios periódicos de compresas impregnadas con iodopovidona en la habitación (20, 56), según evolucione el grado de contaminación.
La producción de pus en la cavidad pleural disminuye significativamente después del cierre de la fístula, y en general es posible el cierre del tórax con el procedimiento de Clagget en una segunda intervención (8, 13).
El análisis multivariado de la serie con más casos en la literatura describe al intervalo corto en desarrollarse la fístula, el uso de grapadora lineal, un muñón bronquial corto y la falta de drenaje previo de la cavidad torácica infectada, como los factores asociados con el incremento de riesgo de mortalidad (46).
En nuestros dos casos, el tiempo transcurrido desde la cirugía hasta el cierre de la fístula varió entre cuatro y doce meses; el proceso infeccioso se controló con 18 y 7 lavados quirúrgicos posteriores; el cierre definitivo de la cavidad torácica se logró a los 90 y 30días, y ambos pacientes permanecen libres de enfermedad a los 18 y 24 meses de seguimiento, respectivamente.
Conclusión
El abordaje transmediastinal es un método alternativo para el cierre de la fístula broncopleural crónica postneumonectomía, en pacientes con múltiples intervenciones en la cavidad torácica o fibrosis perihiliar por infección a repetición, en quienes el abordaje transtorácico no es seguro. El cierre de la comunicación de la vía aérea con la cavidad infectada permite controlar el espacio pleural infectado y el cierre posterior de la cavidad torácica. El abordaje transmediastinal transpericárdico se puede hacer de manera segura y usar en el manejo de la fístula broncopleural tardía posterior a neumonectomía por tuberculosis.
Transternal Transpericardial Approach in the Treatment of Late Bronchopleural Fistula and the Management of Chronic Tuberculous Empyema
Abstract
One third of the world population is affected by tuberculosis, and approximately 2 million people die of it. The Colombian prevalence is 23.4 per 100,000 people. Some tuberculosis complications require surgical management. However, these patients’ anatomy is complex due to the presence of hiliar pulmonary fibrotic tissue.
Material and methods: Literature review of 140 patients in 10 series published during the past 25 years that underwent transmediastinal transpericardial approach for closure of late bronchopleural fistula, including two patients from the Santa Clara Hospital.
Results: 10 patients presented tuberculosis. The operative mortality was 14% and the recurrence rate was 10% at five years, with the majority of cases appearing within the first six months of follow-up.
Discussion: Postneumonectomy broncopleural fistula is a deadly complication. Late presentation of broncopleural fistula severely compromise the life quality of the patient, and it is associated with a severe fibrosis of the pulmonary hilium. Thus, its management requires a virgin field to achieve a precise and secure dissection of the pulmonary hilium.
Morbidity and mortality rates and long term results of transmediastinal transpericardial approach for the closure of late bronchopleural fistula are comparable with intrathoracic muscle transposition and the use of omentum for the management of early bronchopleural fistula.
Conclusion: Transpericardial transmediastinal approach is feasible and safe, and can be used for the management for the management of late bronchopleural fistula after pneumonectomy for tuberculosis.
Key words: pulmonary tuberculosis, respiratory tract fistula, pleural empyema, thoracic surgical procedures
Referencias
1. WHO. Global Tuberculosis Surveillance -Planning, Finance, WHO Report 2005.
2. Min Protección Social. Boletín del Ministerio de la Protección Social, Colombia: Ministerio de la Protección Social, Colombia, 2005
3. WHO. World Health Organization TB Country Epidemiology Profile as March 8, 2005.
4. FREIXINET J, RIVAS J, RODRÍGUEZ DE CASTRO F, et al. Role of surgery in pulmonary tuberculosis. Med Sci Monit 2002; 8: CR782-786.
5. CAMPANA JM. Fístulas traqueoesofágicas en el adulto. Tracheoesophageal fistula in the adult Rev Argent Cir 1983; 44: 224-229.
6. BRAGHETTO I, VARGAS M, ROJAS J, et al. Tuberculous esophagobronchial fistulae: review. Arq Bras Cir Dig 1994; 9: 110-115.
7. ÁLVAREZ R, ROCABADO J, CASTILLO M, et al. Reparación protésica de pared posterior de tráquea por destrucción secundaria a tuberculosis esofágica / Prosthetic repair of posterior tracheal wall by secondary destruction due to esophageal tuberculosis. Cuad Cir 1996; 10: 24-27.
8. STAFFORD E, CLAGETT O. Postpneumonectomy emphyema. Neomycin instillation and definitive closure. J Thorac Cardiovasc Surg 1972; 63: 771-775.
9. Eloesser L. An operation for tuberculous empyema. Surg Gynecol Obst 1935; 60: 1096-1097.
10. ELOESSER L. Of an operation for tuberculous empyema. Ann Thorac Surg 1969; 8: 355-357.
11. DESLAURIERS J, JACQUES L, GREGOIRE J. Role of Eloesser flap and thoracoplasty in the third millennium. Chest Surg Clin N Am 2002; 12: 605-623.
Otras Referencias
12. THOURANI VH, LANCASTER RT, MANSOUR KA, et al. Twenty-six years of experience with the modified Eloesser flap. Ann Thorac Surg 2003; 76: 401-406.
13. CLAGETT O, GERACI J. A procedure for the management of postpneumonectomy empyema. J Thorac Cardiovasc Surg 1963; 45: 141-145.
14. SHAMJI F, GINSBERG R, COOPER J, et al. Open window thoracostomy in the management of postpneumonectomy empyema with or without bronchopleural fistula. J Thorac Cardiovasc Surg 1983; 86: 818-822.
15. DESCHAMPS C, PAIROLERO P, ALLEN M, et al. Management of postpneumonectomy empyema and bronchopleural fistula. Chest Surg Clin N Am 1996; 6: 519-527.<
16. PAIROLERO P, ARNOLD P, PIEHLER J. Intrathoracic transposition of extrathoracic skeletal muscle. J Thorac Cardiovasc Surg 1983; 86: 809-817.
17. HANKINS J, MILLER J, MCLAUGHLIN J. The use of chest wall muscle flaps to close bronchopleural fistulas: experience with 21 patients. Ann Thorac Surg 1978; 25: 491-499.
18. PAIROLERO P, ARNOLD P, TRASTEK V, et al. Postpneumonectomy empyema. The role of intrathoracic muscle transposition. J Thorac Cardiovasc Surg 1990; 99: 958-968.
19. ARNOLD P, PAIROLERO P. Intrathoracic muscle flaps. An account of their use in the management of 100 consecutive patients. Ann Surg 1990; 211: 656-662.
20. VISBAL A, QUINTERO M, GARZÓN J, et al. Uso de los colgajos musculares en la enfermedad pleuropulmonar infecciosa complicada. Rev Col Neumol Cir Torax 2004; 16: 42-50.
21. JANEIRO J, PAVÓN J, VARGAS A. Primera experiencia clínica en México con un sello de fibrina / First clinical experience in Mexico with the use of fibrin glue. Cir Gen 1997; 19: 103-108.
22. TORRE M, CHIESA G, RAVINI M, et al. Endoscopic gluing of bronchopleural fistula. Ann Thorac Surg 1987; 43: 295-297.
Bibliografías
23. HOLLAUS PH, LAX F, EL-NASHEF BB, et al. Natural history of bronchopleural fistula after pneumonectomy: a review of 96 cases. Ann Thorac Surg 1997; 63: 1391-1396.
24. HANKINS J, MILLER J, ATTAR S, et al. Bronchopleural fistula. Thirteen-year experience with 77 cases. J Thorac Cardiovasc Surg 1978; 76: 755-762.
25. PATTERSON G, COOPER J, DARK J, et al. Experimental and clinical double lung transplantation. J Thorac Cardiovasc Surg 1988; 95: 70-74.
26. SHRAGER JB, WAIN JC, WRIGHT CD, et al. Omentum is highly effective in the management of complex cardiothoracic surgical problems. J Thorac Cardiovasc Surg 2003; 125: 526-532.
27. VENCEVICIUS V, GRAZELIS E, SERPYTIS J, et al. The surgical treatment of lung tuberculosis[Article in Lithuanian]. Medicina (Kaunas) 2002; 38 Suppl 2: 30-32.
28. GOELTZ F. “Successful anterior thoraco-bronchotomy for a foreign body impacted in the bronchus”. Ann Surg Oncol 1907; 43: 369-372.
29. PADHI R, LYNN R. The management of bronchopleural fistulas. J Thorac Cardiovasc Surg 1960; 39: 385-393.
30. ABRUZZINI P. “Trattamento chirurgico delle fistule del bronco principale consecutive a pneumonectomia per tuberculosi”. Chir Torac 1961; 14: 165-171.
31. NAGAMINE I, UEMURA H, KAWATA S, et al. [New surgical method for bronchial fistula after unilateral pneumonectomy. Transmediastinal approach by splitting the sternum to the bronchial stump][Article in Japanese]. Kyobu Geka 1967; 20: 67-69.
32. PERELMAN MI, AMBATJELLO GP. Transpleural, transsternal and contralateral approach in surgery of bronchial fistulas following pneumonectomy. Thoraxchirurgie, Vaskulare Chirurgie 1970; 18: 45-57.
33. BOGUSCH L. [Indication and results of transpericardial surgery of main bronchi and pulmonary vessels][Article in German]. Z Erkr Atmungsorgane Folia Bronchol 1970; 131: 275-277.
Otras Bibliografías
34. BRIGAND H, LEVASSEUR P, LUIZY J. Traitement chirugical de la tuberculosee pulmonaire. Encyclopédie médico-chirurgicale: Editions Techniques 1972; 1-18.
35. MAASSEN W. [The transsternal and transpericardial approach for surgical treatment of fistulas of the main bronchus after pneumonectomy (author’s transl)][Article in German]. Thoraxchir Vask Chir 1975; 23: 257-261.
36. ANDERSON R, LI W. Anterior transpericardial closure of a main bronchus fistula after pneumonectomy. Am J Surg 1983; 145: 630-632.
37. RAVITCH M, STEICHEN F. Transpericardial approach to the right main bronchus. In: Atlas of General Thoracic Surgery. W.B. Saunders Company, 1988; 250-253.
38. GRILLO HC. Development of tracheal surgery: a historical review. Part 1: techniques of tracheal surgery. Ann Thorac Surg 2003; 75: 610-619.
39. PEARSON F, TODD T, COOPER J. Experience with primary neoplasms of the trachea and carina. J Thorac Cardiovasc Surg 1984; 88: 511-518.
40. MORIMOTO K, TANIGUCHI I, NAKAMURA Y, et al. Transparasternal transpericardial operation in the treatment of chronic empyema with bronchopleural fistula. Japanese J Thorac Cardiovasc Surg 2002; 50: 246-248.
41. REFAELY Y, PALEY M, SIMANSKY D, et al. Transsternal transpericardial closure of a postlobectomy bronchopleural fistula. Ann Thorac Surg 2002; 73:635-636
42. STELLA F, PETRELLA F. Transsternal transpericardial approach for acute descending necrotizing mediastinitis. J Thorac Cardiovasc Surg 2005; 129: 212-214.
43. GINSBERG RJ, GRIFFITH PEARSON F, COOPER JD, et al. Closure of chronic postpneumonectomy bronchopleural fistula using the transsternal transpericardial approach. Ann Thorac Surg 1989; 47: 231-235.
44. ATHANASSIADI K, VASSILIKOS K, MISTHOS P, et al. Late postpneumonectomy bronchopleural fistula. Thorac Cardiovasc Surg 2004; 52: 298-301.
45. STAMATIS G, MARTINI G, FREITAG L, et al. Transsternal transpericardial operations in the treatment of bronchopleural fistulas after pneumonectomy. Eur J Cardiothorac Surg 1996; 10: 83-86.
Fuentes
46. DE LA RIVIERE B, DEFAUW JJ, KNAEPEN PJ, et al. Transsternal closure of bronchopleural fistula after pneumonectomy. Ann Thorac Surg 1997; 64: 954-958.
47. DARLING GE, ABDURAHMAN A, YI Q-L, et al. Risk of a right pneumonectomy: role of bronchopleural fistula. Ann Thorac Surg 2005; 79: 433-437.
48. OPITZ I, KESTENHOLZ P, LARDINOIS D, et al. Incidence and management of surgical complications after induction chemotherapy followed by extrapleural pneumonectomy for malignant pleural mesothelioma. Lung Cancer 2005; 49: S226.
49. FLORES R, ZAKOWSKI M, VENKATRAMEN E, et al. Malignant pleural mesothelioma (MPM): New predictors of survival and an analysis of the impact of current treatment. Lung Cancer 2005; 49: S28.
50. SUGARBAKER DJ, JAKLITSCH MT, BUENO R, et al. Prevention, early detection, and management of complications after 328 consecutive extrapleural pneumonectomies. J Thorac Cardiovasc Surg 2004; 128: 138-146.
51. RUSCH VW, ROSENZWEIG K, VENKATRAMAN E, et al. A phase II trial of surgical resection and adjuvant high-dose hemithoracic radiation for malignant pleural mesothelioma. J Thorac Cardiovasc Surg 2001; 122:788-795
52. MILLER D, DESCHAMPS C, JENKINS G, et al. Completion pneumonectomy: factors affecting operative mortality and cardiopulmonary morbidity. Ann Thorac Surg 2002; 74: 876- 883.
53. JUNGRAITHMAYR W, HASSE J, OLSCHEWSKI M, et al. Indications and results of completion pneumonectomy. Eur J Cardiothorac Surg 2004; 26: 189-196.
54. GUGGINO G, DODDOLI C, BARLESI F, et al. Completion pneumonectomy in cancer patients: experience with 55 cases. Eur J Cardiothorac Surg 2004; 25: 449-455.
Otras Fuentes
55. SHERWOOD JT, MITCHELL JD, POMERANTZ M. Completion pneumonectomy for chronic mycobacterial disease. J Thorac Cardiovasc Surg 2005; 129: 1257-1264.
56. MULLINS M, WALKER I, STANDRIDGE R. Using povidone-iodine to treat empyema. J Wound Care 2001; 10: 155-156.
57. BALDWIN JC, MARK JBD. Treatment of bronchopleural fistula after pneumonectomy. J Thorac Cardiovasc Surg 1985; 90: 813- 817.
58. BELTRAMI V, ANGELICI A, BERTAGNI A, et al. Transsternal approach to closure of bronchopleural fistulas after pneumonectomy. A fifteen cases report. Lung Cancer 2000; 29: 43-47.
59. TOPCUOGLU MS, KAYHAN C, ULUS T. Transsternal transpericardial approach for the repair of bronchopleural fistula with empyema. Ann Thorac Surg 2000; 69: 394-397.
Correspondencia: ANTONIO LUIS VISBAL, MD. Princess Margaret. Hospital/University Health Network, Toronto, Canadá
Correo electrónico: antonio.visbal@uhn.on.ca Canadá
CLIC AQUÍ Y DÉJANOS TU COMENTARIO