N. ZUNDEL, MD, scc; H. RES TREPO, MD, SCC; J. MORALES, MD, SCC; H. CUERVO, MD
Palabras clave: Acalasia, Esfínter esofágico inferior, Disfagia, Esofagomiotomía.
Se presenta la experiencia de los autores en el manejo endoscópico del paciente con acalasia esofágica. De 1992 a 1997, se practicaron 53 procedimientos quirúrgicos. De 1992 a 1994, 23 casos de esofagomiotomía por vía torácica. De 1994 a 1997, 30 casos de esofagomiotomía por vía lapa roscópica. Se describen las vías de acceso al tórax y al abdomen. La respuesta de los pacientes en el 96% y 99%, respectivamente, ha sido la mejoría clínica y la de los parámetros manométricos; no fue necesaria ninguna conversión y sólo se presentó la ruptura de la mucosa esofágica en 1 caso.
En el tratamiento del paciente con acalasia esofágica, se consideran estos como los pilares del procedimiento quirúrgico por su seguridad y efectividad.
Introducción
La acalasia esofágica es el desorden de la motilidad del esófago, caracterizado por la ausencia de peristaltismo y la falta parcial o completa de relajación del esfínter esofágico inferior (EEI) durante la deglución, acompañado de un aumento de la presión basal del EEI, en la mayoría de los pacientes que la sufren.
Aunque es un desorden que ocurre en forma primaria, también puede ser secundario a cáncer (pseudoacalasia), diabetes, vagotomía o enfermedad de Chagas (1).
La incidencia estimada es de 0.5 por 100.000 habitantes, presentándose igual en hombres que en mujeres y es más frecuente entre los 30 y 60 años (2).
No es clara la etiología de esta enfermedad, pero se piensa que es un desorden neurogénico o neuroendocrino, con ausencia de células ganglionares en el plexo mientérico de Auerbach en el esófago distal.
Otros han encontrado disminución en los niveles de VIP o de óxido nítrico, lo que resulta en un balance positivo para la parte excitadora del esfínter por la acetilcolina y la sustancia P (3). El paciente con acalasia se caracteriza por una larga historia de disfagia progresiva, regurgitación intermitente que aumenta en posición horizontal durante la noche; pérdida de peso y síntomas pulmonares. El dolor torácico es generalmente secundario a obstrucción por material alimenticio (4).
Diagnóstico
Se sospecha usualmente por la descripción de los síntomas del paciente y se confirma por los hallazgos en la manometría; sin embargo, es necesario realizar una endoscopia digestiva para descartar otras posibles causas de disfagia, como procesos inflamatorios o neoplásicos.
El hallazgo clásico en la manometría, es la falta de relajación del EEI; a la deglución, hay ausencia de peristaltismo en el cuello esofágico y ondas de baja amplitud. Se describe la acalasia vigorosa que se presenta en nivel esofágico, ondas de gran amplitud pero sin una adecuada actividad peristáltica.
El estudio radiológico permite clasificar la severidad del proceso según el grado de dilatación y motilidad esofágica, así:
Estado I: Inicial, con diámetro esofágico de 4 cm y alteración al paso del medio de contraste.
Estado 11:No avanzado, con diámetro del esófago de 4 a 6 cm.
Grado III: Avanzado, con diámetro esofágico mayor de 6 cm y ausencia de peristaltismo.
Tratamiento
El tratamiento del paciente con acalasia está diseñado para disminuir la resistencia al flujo a través del EEI, Yasí mejorar el vaciamiento esofágico.
Hay tres métodos para lograrlo: a) Drogas y otras sustancias que afectan el tono muscular. b) Dilatación con balón. c) Miotomía esofágica.
a) Los bloqueadores de Ca y los nitratos son las drogas más frecuentes utilizadas, pero los resultados son desalentadores, excepto en pacientes con síntomas leves. Otra propuesta de manejo consiste en la administración de un agente bloqueador de la acetilcolina. Pasricha inyectó por endoscopia 80 U de toxina botulínica, y obtuvo una baja presión del EEI de 33%, con respuesta en 90% de los casos y efecto sostenido a 6 meses en el 60%. No se han presentado efectos adversos (3).
b) La dilatación con balón es el método inicial de tratamiento más popular en las dos últimas décadas; el más comúnmente usado en la actualidad es el regiflex, radiolúcido con guía metálica y balón de polietileno. El resultado en la dilatación neumática oscila entre el 65 y el 93% en las diferentes series, con posibilidad de perforación de O a 6.6% y mortalidad del 0.2%. Más del 16% requiere nuevas dilataciones, y el 8% requiere un tratamiento quirúrgico; puede ocurrir el reflujo gastroesofágico (ROE) hasta en 27% de los pacientes así tratados (7, 8).
c) La miotomía esofágica fue descrita por Heller en 1913, quien realizó una doble cardiomiotomía; esta operación sufrió múltiples modificaciones entre las cuales figura la incisión única sobre la cara anterior lateral del esófago y el estómago. Ferguson evaluó 1.199 casos publicados con una rata de éxito de 89%; 3% requiere de una segunda intervención, la incidencia de ROE fue de 10%, y la mortalidad, de 0.3% (9).
Es así como el procedimiento quirúrgico empleado para el tratamiento de la acalasia ha demostrado ser eficaz en el control de los síntomas, pero requiere de una toracotomía o una laparotomía con un período de recuperación prolongado, ocasiona dolor severo posquirúrgico y, además, exige una gran incisión, por lo que ha motivado el empleo de la cirugía mínimamente invasora.
Pacientes y Métodos
De febrero 1992 a junio 1997 se evaluaron 53 pacientes referidos con disfagia y diagnóstico de acalasia esofágica; de ellos, 28 hombres y 25 mujeres, con edad promedio de 28 años, y rango entre 15 y 64 años.
Los pacientes relataban disfagia, regurgitación de alimentos no digeridos y pérdida variable de peso; además, cumplían con los criterios manométricos para el diagnóstico de acalasia (ondas simultáneas sin progresión y ausencia de relajación en el EEI). A todos los pacientes se les practicó en su evaluación prequirúrgica, endoscopia digestiva y, Rx del esófago con bario.
Ninguno de los pacientes había sido intervenido anteriormente y todos ellos fueron sometidos a tratamiento médico y/o dilataciones endoscópicas. El procedimiento quirúrgico empleado en la etapa inicial (junio de 1992 a junio de 1995) fue la esofagomiotomía por toracoscopia; de junio de 1995 a junio de 1997 se practicó esofagomiotomía por laparoscopia, más procedimiento antirreflujo tipo Dor. A todos estospacientes se les efectuó manometría pre y posquirúrgica:
Esofagotomía por toracoscopia se usó la técnica descrita por Shimi y Curchieri en 1991, para obtener los beneficios de la cirugía mínimamente invasora con un procedimiento quirúrgico de resultados ya demostrados como satisfactorios.
Para este procedimiento, el paciente requiere intubación selectiva del bronquio principal derecho con un tubo de doble luz lo que permite el colapso del pulmón izquierdo; luego el paciente se coloca en decúbito lateral derecho.
Para el acceso torácico se emplean cuatro trocares que toman una forma de rombo: cada uno de éstos de 10 mm, lo que nos permite el paso de instrumental diferente, y el cambio de posición de la cámara en caso de necesidad. Puede utilizarse un trocar para la cámara, y el otro instrumental se introduce directamente, ya que la cavidad torácica no requiere neumoinsuflación. El lente utilizado es de O grados.
La dilatación de los trocares es la siguiente:
1°-SO. EH 2 cm, post A L.A.P. para pasar cámara (ayudante).
2°_3°. EH entre línea L.A.M. y L.A.P. para disección por el cirujano.
3°_7″. EH nivel L.A.M. para corte o disección por el cirujano.
4°_6°. EH con L.A.A. para empleo de retractor (ayudante).
Después de pasar los diferentes trocares, se practica la exposición y sección de ligamento pulmonar inferior, lo que permite una retracción adecuada del pulmón. Así se expone la pleura que recubre el esófago.
Simultáneamente se pasa el endoscopio para un reparo más adecuado de la miotomía esofágica. Luego de disecar el tejido conectivo de la superficie esofágica se inicia la miotomía señalando el trayecto desde la vena pulmonar inferior hasta el hiato diafragmático con la espátula o con el gancho (hook), incidiendo en la parte media hasta seccionar las fibras musculares circulares, aparece la submucosa y se continúa de plano de disección inferior; es necesario rechazar el diafragma hacia abajo y traccionar el esófago.
Al mismo tiempo el endoscopista señala hasta dónde extender la disección para lograr dividir el esfínter completamente. Cuando se llega al área de la unión gastroesofágica se aprecia un aumento de la vasculatura o un adelgazamiento de la mucosa; la disección se extiende más o menos 0.5 cm sobre el estómago. Una vez finalizada la mioto mía es necesario resecar 30 a 40% de la circunferencia de la muscular para prevenir el acercamiento posterior de los bordes de la miotomía. Para terminar, se deja un tuvo de tórax No. 30 conectado a una trampa de agua.
El paciente sale del quirófano con sonda nasogástrica (SNG), se inicia líquido por vía oral a las 6 u 8 horas de terminada la cirugía, se da de alta entre el segundo y el tercer día del postoperatorio, una vez retirado el tubo.
Técnica quirúrgica de la esofagomiotomía por laparoscopia
El paciente se encuentra en decúbito supino, en posición de Trendelenburg invertido 20 a 30 grados. Las extremidades superiores del paciente van adosadas a su cuerpo y los miembros inferiores abiertos, para que allí se localice el cirujano que practicará el procedimiento.
Se aplican para este procedimiento 5 trocares, 3 de 10 mm y 2 de 5 mm. La distribución de ellos en forma de pentágono se ilustra en la figura 1.
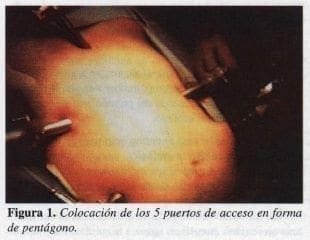
El procedimiento se inicia con la introducción de un separador o retractor. para levantar el lóbulo hepático izquierdo y
• permitir una visualización adecuada del hiato.
Por el trocar inferior izquierdo se practica tracción de la curva menor, para localizar el ligamento gastrohepático, el cual se secciona en su parte superior, continuando con la sección de la membrana frenoesofágica de derecha a izquierda, para permitir la disección de la parte distal esofágica; es importante la visualización y preservación del nervio vago anterior.
Con disección cortante se separa la rama derecha del pilar derecho de la unión gastroesofágica; aquí se identifica el vago posterior y no es necesaria la disección del pilar izquierdo, a menos que haya diagnóstico asociado a hernia hiatal.
Por esta vía se logra la cauterización de la porción distal del esófago en unos 5 a 8 cm (Figura 2). Para iniciar la miotomía se demarca el trayecto del nervio vago anterior, cauterizando la capa longitudinal de la muscular con pinza de gancho (hook). Las fibras musculares son divididas hasta alcanzar el plano de la submucosa. El sangrado en este procedimiento es mínimo, por lo que se recomienda el empleo de coagulación con bajo voltaje.
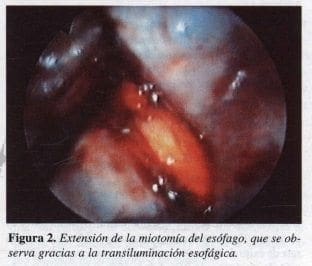
Se extiende la miotomía hasta 6 cm; por encima de la unión gastroesofágica, esta maniobra se realiza con el uso de tijeras curvas; para facilitar el procedimiento laparoscópico se emplea simultáneamente endoscopio intraoperatorio, que permite movimientos alternos de insuflación y relajación esofágica, lo que hace más fácil la identificación de las fibras musculares circulares (Figura 3).
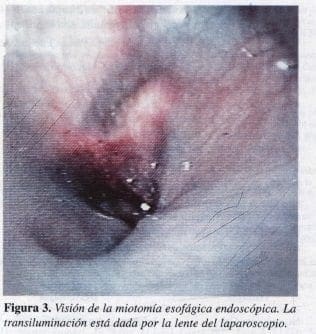
La miotomía se extiende 1.5 a 2 cm por debajo del cardias. Esta miotomía se debe realizar hacia la parte anterolateral izquierda de la unión gastroesofágica, teniendo cuidado de preservar el vago. El uso del endoscopio intraoperatorio permite, además, detectar perforaciones de la mucosa y definir la extensión de la miotomía.
El procedimiento de esofagomiotomía por laparoscopia se complementa con una fundoplicatura anterior tipo Dor, que consiste en aplicar pared anterior medial del fondo gástrico al borde izquierdo de la esofagomiotomía (3 puntos con poliéster 2-0); y luego la pared anterolateral del fondo al borde derecho de la esofagotomía con 3 puntos fijando los 2 superiores al pilar derecho.
El paciente permanece las primeras 8 horas del postoperatorio con SNG; al retirarse ésta se inicia la vía oral con dieta líquida.
Resultados y Discusión
Esofagomiotomía por toracocoscopia
Pellegrini informa 30 casos en los que se logran resultados excelentes y buenos en el 92% de los casos, obteniendo cifras de manometría que disminuyen de 32 mm a 10 mmHg. Debido a la lesión de la mucosa esofágica, convirtió un caso a cirugía abierta. Su estancia hospitalaria fue de 3 días y como complicaciones pos quirúrgicas reporta miotomías incompletas en los tres primeros casos, razón por la cual se practicó la laparoscopia para complementar la miotomía (10)
El autor principal entre 1992 y 1994 realizó 23 procedimientos por vía torácica e informó 96% de buenos resultados, logrando bajar la PEEI de 36 mm a 13 mm, y no fue necesaria convertir ningún caso; la estancia hospitalaria observada fue de 3 días y se presentó una miotomía incompleta, la cual fue posteriormente intervenida por la vía tradicional (11).
Los autores mencionados, al igual que otros, en la práctica de cardiomiotomía por vía torácica, no agregan procedimiento antirreflujo pues se aduce una menor movilización del hiato esofágico, manteniendo íntegro el lecho frenoesofágico, lo que evitaría el RGE en estos pacientes; aunque la monitoría de pH en 24 horas, demostró que en 6 de 10 pacientes estudiados, sólo 1 fue sintomático (10, 12).
Se pueden presentar como complicaciones tardías el daño de la mucosa causado por quemadura durante la miotomía; por esto es importante el corte del músculo alejado de la mucosa y evitar el uso de cauterización en la sección muscular.
Después del acto quirúrgico la única causa de incomodidad es el tubo de tórax, el cual se retira a las 24 ó 48 horas del postoperatorio; la dieta blanda se inicia 3 días después de la cirugía.
No se informaron muertes en el postoperatorio.
Esofagomiotomía laparoscópica
De Paula informó 85 casos convirtiéndose en el trabajo de mayor número de pacientes, con resultados excelentes después de 20 meses, 96.4%; Rosati en 33 casos, anota 96% de excelentes resultados (13, 14). Ancona, 18 casos con 96% de buenos resultados, con baja PEEI de 24 a 14 mm; nosotros con 22 casos, reportamos 99% de buenos resultados con disminución la PEEI de 34 + 3 a 13 + 2 mm (15).
La falla en este 1-4% de casos se debe a esofagomiotomía incompleta, generalmente por dificultad en la identificación esofágica; por esta razón recomendamos el uso intraoperatorio del endoscopio.
La estancia hospitalaria es de 2 a 4 días en los diferentes trabajos.
El reflujo es un problema frecuente después de la cardiomiotomía abierta (3 a 50%); por esto la literatura indica que se debe realizar un procedimiento antirreflujo, pues con la cirugía se lesionan varios de los mecanismos de éste por sección muscular freno esofágica, sección del EEI, etc.
Por ello, para su complemento, se utilizan técnicas en su mayoría fundoplicatura parcial (Dor y Toupet). El Dor requiere menos movilización y protege la cara anterior esofágica, semejando un parche de Thal (16); por lo cual, es el procedimiento utilizado de rutina por los autores.
El Toupet utilizado por De Paula y Oddsdottir, requiere una mayor disección y el tiempo quirúrgico se prolonga por lo menos 30 a 60 minutos (17).
Según Robertson y Streitz no es necesaria la práctica de un procedimiento antirreflujo como complemento de la que se denomina esofagomiotomía corta, la cual se extiende sólo 3 a 5 mm sobre la pared gástrica; de 9 casos, 8 no acusaron disfagia, 4 permitieron monitoría pH 24 horas y no se demostró evidencia de reflujo.
Doctores: Natan Zundel, Cirujano General, Fundación Santa Fe de Bogotá, Coordinador del Comité de Cirugía Endoscópica de la SCC; Hernán Restrepo, Cirujano General, Hospital Pablo Tobón Uribe, Medellín: Julián Morales, Profesor Asistente de la Universidad del Quindío; Hernán Cuervo, Residente de Cirugía General de la Escuela Colombiana de Cirugía; Santafé de Bogotá, D.C., Colombia
Anotan que la necesidad de un procedimiento antirreflujo sólo se da para corregir una miotomía incorrecta (18, 19). Argumentan, además, que hay un remanente de zona de alta presión inferior, que desciende 2 cm, y la presencia de fibras crurales del diafragma que pueden disminuir el RGE posquirúrgico.
Es necesario, por tanto, realizar un seguimiento a largo plazo de estos pacientes intervenidos por vía laparoscópica para obtener resultados definitivos.
Disimone evalúa 129 casos con seguimiento promedio de 97.4 meses; reporta la disfagia secundaria a miotomía insuficiente y cicatriz periesofágica que recurre temprano, a menos de 3 años. Contrariamente el RGE y sus complicaciones pueden aparecer hasta 10 años después de la cirugía; por eso el seguimiento quirúrgico inicial clínico y de manometría, debe hacerse después de 5 años con endoscopia e histología (18).
Complicaciones
La complicación mayor y más frecuente informada es la lesión de la mucosa; ésta se presenta generalmente en la unión gastroesofágica o en la porción gástrica donde la mucosa se hace más delgada. Pellegrini reporta 2 casos, Rosati 5 y en nuestra experiencia hay l caso que, a diferencia de los iniciales de dichos autores, fueron corregidos por vía laparoscópica sin necesidad de convertir el procedimiento (10, 14).
Es necesario anotar también la posibilidad de una lesión tardía por quemadura, aunque aún no se ha reportado. Si el paciente desarrolla fiebre y no está progresando adecuadamente, se debe realizar un esofagograma para descartar la perforación.
La perforación gástrica reportada en los procedimientos de fundoplicatura es otra de las complicaciones potenciales, pero no se ha descrito.
El sangrado puede dificultar el procedimiento y se puede producir por una lesión durante la separación del hígado o por desgarro esplénico, éste sí reportado en un paciente de Ancona, lo que obligó a convertir la cirugía (16).
Otras complicaciones posibles descritas en cirugía antirreflujo, pero no en la corrección de la acalasia, son la presencia de neumotórax y el enfisema subcutáneo.
Resultados
Nuestros resultados y su comparación con los de otros autores nos llevan a concluir de una manera segura que por cualquiera de los dos accesos expuestos se mantienen las ventajas de la cirugía mínimamente invasora: menor dolor posquirúrgico, pronta recuperación del paciente, además delmejor aspecto’ estético.
Hacemos énfasis en la importancia de la endoscopia intraoperatoria para transiluminar, insuflar y ejercer mejor control sobre las perforaciones tempranas. Tanto la laparoscopia como la toracoscopia, tienen ventajas y desventajas que se anotan en los siguientes cuadros comparativos:
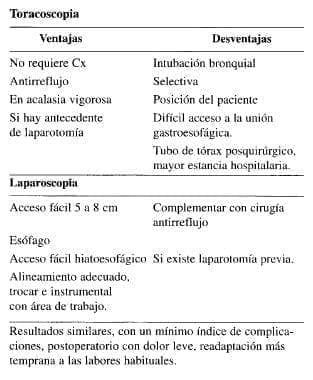
Resultados similares, con un mínimo índice de complicaciones, postoperatorio con dolor leve, readaptación más temprana a las labores habituales.
Referencias
1. Sugarbaker D, Keamey D, Richards W: Esophageal physiology and patophysiology. Surg Clin North Am 1993; 73 (6): 1101
2. Ellis FH: Acalasia. En: Maingot. Operaciones Abdominales. Schwartz-Ellis. 8a. edición, 1986. Ed. Medice Panam S.A., pp. 563-78
3. Pasricha PJ, Ravich WJ, Hendix TR, Sostre S, Jones B, Kalloo A: Intrasphincteric Botulinum toxin for the treatment of achalasia. N Engl J Med 1995; 332 (12): 774
4. Henderson RD: Esophageal Motor disorders. Surg Clin North Am 1987; 67 (3): 455
5. Stewart E: Radiographic evaluation of the esophagus and its motor disorders. Med Clin North Am 1981; 65 (6): 11-73
6. Abid S, Champion G, Richter J, Mc Elvein. Slaughter 12, Kochler R: Treatment of achalasia: The best of both worlds. Am J Gastroenterol 1994; 89 (7): 979
7. Lambroza A, Shuman R: Pneumatic di lation for Achalasia without fluroscopic guidance; Safcty and etficacy. Am J Gastroenterol 1995; 90: 126-9
8. Molira E, Stollmon N, Graver L, Reiner D: Conservative management of esophageal nontransmural Tears after pneumatic dilation. Am J Gastroenterol 1995; 91 (1): 15
9. Ferguson MK: Achalasia: Current evaluation and therapy (review). Ann Thoracic Surg 1991; 52: 336
10. Pellegrini C, Wetter A, Patti M, Leichter R, Mussan G, Morit et al: Thoracoscopic esophagomyotomy. Ann Surg 1992; 216 (3) 291
11. Zundel N: Tratamiento de la acalasia por toracoscopia. En: Cirugía laparoscópica. J Cervantes, JF Patiño, Eds., México, Mc Graw-Hill, Interam, 1997; 332-5
12. Ellis FH: Disorders of the esophagus in the adult. In: surgery of the Chest. Sabinston D, Spencer F, 5a. Ed, WB Saunders Company, 1990; 847-89
13. De Paula AL, Hashiba K, Bafutto M: Laparoscopic approach to esophageal achalasia. Surg Endosc 1995; 9: 220
14. Rosati 12, Fumagalli U, Bonavira L et al: Laparoscopic approach to esophageal achalasia. Am J surg 1995; 169: 424
15. Zundel N: Tratamiento de la acalasia por videolaparoscipia. En: Cirugía Laparoscópica y Toracoscópica. J. Cervantes, JF Patiño, Eds., México, McGraw-Hill, Interam, 1997; 152-4
16. Ancona E, Anselmino M, Zaninotto G et al: Esophageal achalasia: Heller-Dor operation. Am J Surg 1995; 70: 265
17. Oddsdottir M: Laparoscopic Management of achalasia. Surg Clin North Am 1996; 76 (3): 4-51
18. Robertson GSM, lloyd DM, Wicks AC: Laparoscopic Hellers cardiomiotomy without and antirelex procedure. Br J Surg 1995; 82: 957-95
19. Streite J, Ellis FH, Williamson W et al: Objetive Assessment of gastroesophageal reflux for achalasia with the use of manometry and pH m onitoring. J Thorac Cardiovasc Surg 1996; ¡II (1): 107
Correspondencia:
Dr. Natan Zundel. Av. 9 No. Jl7-20, Cons. 602. Fax 2151376, Santafé de Bogotá, D.C.
Corrección
En la entrega de la revista ~IRUGIA correspondiente al Vol. 12 Núm. 3, Julio -Septiembre de 1997, fue publicado el trabajo titulado, Tumores Mesenquimatosas
Benignos del Tracto Gastrointestinal. Estudio de 7 casos y Revisión de la Literatura. (Pág. 171).En realidad, dicho estudio no incluye 7 sino 12 pacientes estudiados, como puede comprobarse al leer el texto del trabajo en mención.
Doctores: Natan Zundel, Cirujano General, Fundación Santa Fe de Bogotá, Coordinador del Comité de Cirugía Endoscópica de la SCC; Hernán Restrepo, Cirujano General, Hospital Pablo Tobón Uribe, Medellín: Julián Morales, Profesor Asistente de la Universidad del Quindío; Hernán Cuervo, Residente de Cirugía General de la Escuela Colombiana de Cirugía; Santafé de Bogotá, D.C., Colombia.
