Métodos
El polen de F. sinensis fue recolectado tomando flores masculinas de diferentes árboles, suspendiéndolas y manteniéndolas a temperaturas elevadas para evitar contaminación especialmente por hongos ambientales. Las flores al secarse, liberaron el polen el cual fue recogido en papel de filtro y envasado en tubos estériles.
El de Cecropia sp fue recolectado por Ramiro Fonnegra, de la Universidad de Antioquia, de plantas de los alrededores de la zona suburbana de Medellín. Se recibieron flores completas, secas, las cuales se pulverizaron mecánicamente debido a la imposibilidad de liberar el polen exclusivamente.
Extractos alergénicos
Se prepararon extractos acuosos (10% p/v) del polen de Fraxinus sinensis y de Cecropia sp en una solución de carbonato de amonio 0.1 M, en agitación por 48 horas a 4o C (17). Los extractos se clarificaron por centrifugación a 15.000 g por 15 minutos en centrífuga refrigerada y se esterilizaron a través de un filtro de 0.22 mm. (Millipore Corporation, Bedford M. A.).
La concentración de proteínas se determinó por la técnica de Lowry (18). Esta preparación se utilizó para las pruebas bioquímicas. Para las pruebas dérmicas se realizó una dilución posterior al 50% en glicerina.
Grupos de estudio
Se tomaron 207 pacientes que presentaban alergia respiratoria (asma y rinitis), procedentes de la consulta de alergia del Hospital Infantil Universitario Lorencita Villegas de Santos, del consultorio del doctor Francisco Leal y de la consulta de Alergia de la Fundación Santa Fe de Bogotá (doctora Elizabeth García).
A todos los pacientes se les practicaron pruebas dérmicas para los inhalantes y los alimentos alergénicos más comunes, incluyéndose además los dos granos de polen en estudio. Como control positivo se utilizó una solución de histamina 1 mg/mL en glicerol al 50% y como control negativo, solución salina.
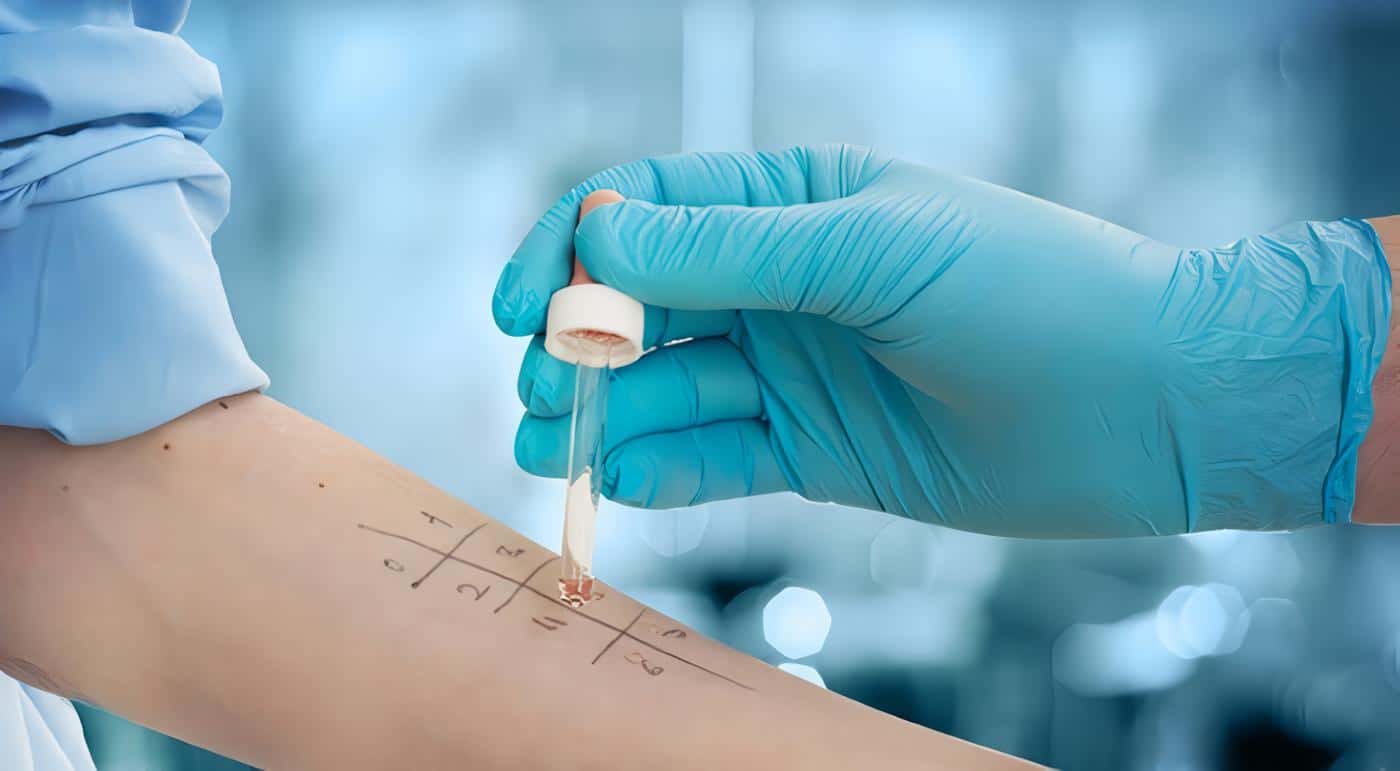
Las pruebas se realizaron por técnica epicutánea de puntura (prick test) y los resultados fueron registrados en una hoja diseñada para tal fin.
Las lecturas se hicieron por el sistema de cruces 0 a 4, según los milímetros de induración. Estas lecturas son netas y se obtienen restando la induración del control negativo. Se tomó el siguiente parámetro: de 1- 4 mm: 1 +; de 5 – 8: 2 +; de 9 – 12: 3 + y > 12: 4 + (19-20).
A los pacientes que mostraron algún grado de positividad al extracto de Fraxinus sinensis y Cecropia sp, se les solicitó muestra de suero para realizar determinación de IgE específica y SDS-PAGE, IEF/Western blot los cuales fueron denominados grupo 1.
Grupo 2: 8 individuos sin patología alérgica evidente con pruebas dérmicas negativas a todos los extractos utilizados.
(Lea También: Inhibición del RAST)
Separación electroforética
La SDS-PAGE de los extractos del polen de Fraxinus sinensis y de Cecropia sp, fue realizada en un gel de poliacrilamida en gradientes del 4-20% (Ready gels. BIO-RAD. California. USA), con el sistema buffer descrito por Laemmli (21), a 150 v constantes durante 1 hora, en una cámara de doble celda Mini protean II (BIO-RAD). Después del corrido electroforético, los geles fueron coloreados con azul brillante de Coomassie R-250 (BIO-RAD) (22).
Los geles que se usaron para la transferencia no fueron coloreados. Se utilizó un patrón de bajo rango de peso molecular para SDS-PAGE de 21.9 – 142.9 kD precoloreado (BIO-RAD, cat. No. 161-0305). Para marcar el inicio y fin de la corrida se utilizó pironina (Sigma P-6892).
Las proteínas separadas electroforéticamente fueron transferidas a papel de nitrocelulosa utilizando el método descrito por Towbin (23).
Los geles obtenidos del SDS-PAGE:
Se pusieron en contacto con membranas de nitrocelulosa (NC) 0.45 mm (BIO-RAD), entre varias capas de papel de filtro. La transferencia electroforética se realizó a 250 mA constantes por 2 horas en buffer tris 25 mM; glicina 129 mM; metanol 20%, en una celda para mini transferencia (BIO-RAD).
La eficiencia de la transferencia se controló por la evidencia de las bandas del patrón de peso molecular en el papel de NC. Las membranas de NC se bloquearon con leche descremada al 3% en buffer TTBS pH 7.5 (tris 10 mM- NaCl 150 mM-tween 20 0.1%) (24).
Las membranas de NC se cortaron en tiras de 0.5 cm de ancho y se incubaron con los sueros de los pacientes atópicos y el grupo control toda la noche a temperatura ambiente en agitación. Los sueros fueron diluidos 1:10 en TTBS.
Posterior a la incubación se lavaron tres veces con TTBS y se incubaron con un antisuero anti-IgE humana marcado con fosfatasa alcalina (Sigma Chemical CO. A-3525) en dilución 1:100 en TTBS por 1 1/2 horas. Se lavaron al igual que en la primera incubación y se revelaron por adición de BCI-p 0.015%-NBT 0.03% en una solución de buffer tris salino (tris 100 mM-NaCl 100 mM-MgCl2 5 mM) como substrato hasta la aparición de las bandas. La reacción se frenó con agua destilada.
El peso molecular aproximado de las bandas observadas, fue calculado realizando una curva de calibración, graficando el log del peso molecular contra la movilidad relativa de cada proteína (25-26).
Isoelectroenfoque
El IEF analítico fue realizado en geles de poliacrilamida prehechos pH 3.5-9.5 (Ampholine PAG plate, Pharmacia-LKB, Uppsla, Sweden). 41 mL del extracto que contenía 100 mg de proteína, fueron aplicados sobre el gel y corrido a 1.500 V, 50 mA, 30 W por una hora. Patrones de punto isoeléctrico de amplio rango (4.45-9.6) fueron corridos paralelamente (BIO-RAD).
Después de la electroforesis, los geles fueron fijados en ácido tricloroacético 11.6%-sulfosalicílico 3.4% por una hora y coloreados con azul de coomassie R-250 0.116% (Laboratorios BIO-RAD).
Los geles para transferencia a membranas de celulosa no fueron coloreados. La electrotransferencia fue realizada en buffer tris 48 mM-glicina 39 mM-SDS 0.037%-metanol 20% a 1200 V, 145 mA, 50 W por tres horas utilizando la cámara de transferencia semiseca Nova Blot. (Pharmacia-LKB). Una porción de NC que contenía los patrones de PI y los extractos alergénicos, fue coloreada con una solución de tinta china (pelikan) 1 mL/mL en PBS-T, toda la noche para controlar la eficiencia de la transferencia (27).
La inmunodetección de las bandas de proteínas reconocidas por IgE fue realizada como se describe para el SDS-PAGE.
Inmunoglobulina E específica
Placas para Elisa marca Costar, fueron cubiertas con una solución de los extractos en una concentración de 10 mg/mL en buffer carbonato/bicarbonato pH 9.6. Se incubó a 37o C por 3 horas y toda la noche a 4o C. Los lavados se realizaron con PBS 0.1 M-Tween 20 0.05% (PBS-T).
Los sitios libres de la fase sólida fueron bloqueados con una solución de leche descremada al 1% en PBS, por una hora a 37o C. Los sueros se utilizaron sin diluir, se incubaron durante una hora a 37o C en cámara húmeda y se lavaron con PBS-T.
Posterior a la adición de un antisuero anti-IgE conjugado con fosfatasa alcalina, en una dilución de 1:500 en PBS (Sigma A-3525) durante una hora a 37o C y de lavados con PBS-T, la reacción se evidenció utilizando como substrato p-nitrofenil fosfato (sigma 104) en buffer dietanolamina pH 9.8 a 1 mg/mL.
La absorbencia fue cuantificada en un lector para ELISA multiskan M/430 (Labsystem) a 405 nm. Para establecer el punto de corte, se utilizó la media de los valores de absorbencia de las muestras negativas y se le adicionó el valor de dos desviaciones estándar.