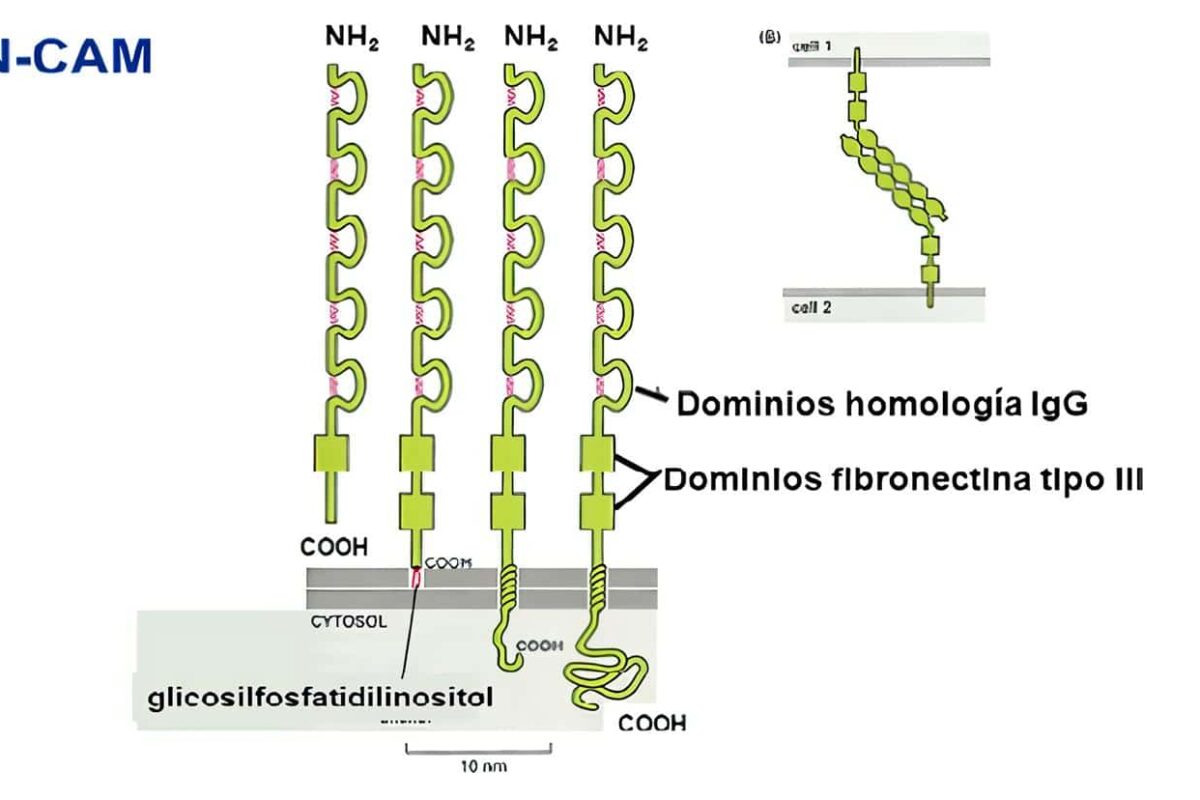
Esta superfamilia comprende aquellas proteínas que tienen uno o más dominios extracelulares homólogos a las inmunoglobulinas. Pueden subdividirse en:
·Tipo C1: involucradas en el reconocimiento de los antígenos; se incluyen aquí los receptores antigénicos de los linfocitos T y B, los anticuerpos, y las moléculas del complejo mayor de histocompatibilidad.
·Tipo C2: proteínas de adhesión celular y fijadoras del complemento (Tabla 3); incluye moléculas de acciones muy diversas, desde adhesión neuronal (NCAM), coestimulación celular (CD28, CD80, CD86, CTLA-4), y moléculas de adhesión que en algunos casos son ligandos para las integrinas (aunque en algunos casos realizan interacciones homofílicas, como el CD31).
Estas moléculas están involucradas en la circulación y tráfico de los leucocitos a los órganos linfoides y a los sitios de daño tisular por medio de interacciones célula-célula y célula-matriz extracelular.
Tabla 3. Superfamilia de las inmunoglobulinas
|
Las moléculas Tipo C2:
Incluyen un número variable de dominios extracelulares tipo inmunoglobulina, con secuencias de cisteínas conservadas que FORMANpuentes disulfuro para estabilizar la estructura terciaria de la molécula.
Cinco miembros de las superfamilia de las Igs están expresadas constitutivamente por las células endoteliales, y se encuentran involucradas en la adhesión firme de los leucocitos a ellas: ICAM-1, ICAM-2, VCAM-1, PECAM-1 y MAdCAM-1.
La expresión de la mayoría de estas moléculas es regulada positivamente por varias citoquinas, llevando a un incremento en la unión fuerte de los leucocitos al endotelio durante los procesos inflamatorios.
Esa adhesión fuerte se realiza por la interacción de las moléculas tipo C2 con las integrinas b1, b2 y b7 expresadas sobre los leucocitos.
Las interacciones del CD28 y CTLA-4 con CD80 (B7-1) y CD86 (B7-2) tienen un interés muy particular pues hacen parte fundamental del sistema de coestimulación desplegado durante la activación de los linfocitos T; las evidencias orientan a proponer un rol estimulador para el CD28, mientras que la señalización generada por CTLA-4 sería inhibidora para la célula T.
(Lea También: Las Quimioquinas: Citoquinas Reguladoras del Tráfico Celular)
Proteínas de la Matriz Extracelular
En este grupo encontramos proteínas como la fibronectina, la laminina y el colágeno. Estas moléculas intervienen en mecanismos de adhesión célula-matriz extracelular, estimulación de la movilidad hacia los sitios de inflamación y activación de los fagocitos.
Papel de las moléculas de adhesión en el
reclutamiento de los neutrófilos
Rodamiento y adhesión laxa
La interacción inicial de los neutrófilos (PMN) con el endotelio es un proceso aleatorio, pero se incrementa notablemente en los sitios de inflamación o trauma por una alteración en el flujo sanguíneo local.
Cuando los PMN hacen el rodamiento sobre la pared vascular, la primera interacción con el endotelio se hace a través de moléculas de la familia de las selectinas; la L-selectina se expresa constitutivamente en la membrana de los leucocitos; la P-selectina se encuentra almacenada en el interior de las células endoteliales y las plaquetas, y se expresa en la superficie celula luego de la activación; la E-selectina se sintetiza de novo y se expresa en la membrana de las células endoteliales también cuando éstas han sido activadas; dicha activación para la expresión de las selectinas P y E se debe a sustancias como el PAF, la trombina, la histamina, la IL-1, el TNF y otros mediadores.
Los ligandos de las selectinas son proteínas tipo mucinas que contienen carbohidratos sializados y fucosilados. El proceso de rodamiento de los fagocitos sirve para poner estas células en estrecho contacto con el endotelio y para disminuir la velocidad de su paso por las regiones de daño tisular e inflamación.
Cuando el PMN entra en contacto con el endotelio, la L-selectina interactúa por unos pocos milisegundos con sus ligandos expresados sobre el endotelio (CD34 y otras mucinas sializadas), mientras la P-selectina y la E-selectina hacen lo mismo con las lectinas expresadas por el PMN (Sialil Lewis-X); esta interacción transitoria se denomina adhesión laxa y permite el rodamiento del PMN sobre el endotelio; sin embargo, no es lo suficientemente fuerte para permitir una adhesión firme de los PMN al endotelio y la transmigración a través de sus células.
Activación del PMN y adhesión firme
El proceso de rodamiento del PMN permite el contacto de éste con sustancias activadoras secretadas por el endotelio y los tejidos subyacentes (citoquinas, derivados de la coagulación y el complemento) depositadas en el glicocálix de las células endoteliales.
Los PMN tienen en su superficie receptores de alta afinidad para estos factores activadores (en su mayoría receptores para agentes quimiotácticos, del tipo proteínas de siete pasos transmembrana acoplados a proteína G); como parte de las respuestas a esta activación, las cadenas de las Beta 2 integrinas leucocitarias que estaban dispersas en la membrana del PMN se agrupan el la zona de contacto con el endotelio y FORMAN dímeros funcionalmente activos.
La adhesión firme se origina por una uniones ligando-receptor fuertes y estables entre moléculas de la superfamilia de las inmunoglobulinas (ICAM-1, ICAM-2) expresadas en el endotelio activado y las Beta 2 integrinas (LAF-1, MAC-1 y p150,95); la LFA-1 y el MAC-1 permiten la adhesión firme de los PMN al endotelio, pero la MAC-1 está también involucrada en el proceso de transmigración endotelial y quimiotaxis por sus interacciones con moléculas del intersticio endotelial y la matriz extracelular.
Cuando las integrinas se unen a los ICAM-1 e ICAM-2 expresados en el endotelio, originan una adhesión firme del PMN y el paro completo de su movimiento; el ICAM-1 se expresa en el endotelio luego de su activación, mientras que el ICAM-2 es de expresión constitucional en estas células.
Transmigración endotelial y quimiotaxis
El paso del PMN a través de los espacios inter endoteliales también se lleva a cabo por interacciones entre integrinas y moléculas de la superfamilia de las inmunoglobulinas. El MAC-1 (CD11b/CD18) y el PECAM-1 (CD31) son las moléculas de adhesión más fuertemente involucradas en este proceso, a través de uniones heterofílicas y homofílicas (CD31: CD31).
Cuando el PMN alcanza la matriz extracelular, se inicia la quimiotaxis por medio de interacciones entre las integrinas de esta células y moléculas del tejido extracelular; en este proceso cumplen la función más destacada el MAC-1 y algunas moléculas de las Beta 1 integrinas.
La quimiotaxis de los PMN es un incremento en la polarización de su movimiento hacia los sitios de inflamación, regulado por un gradiente de factores quimiotácticos originados en el foco inflamatorio.
Los factores quimiotácticos más importantes son productos derivados de las bacterias (FMLP), algunas citoquinas proinflamatorias (como la IL-8, y el PAF), el leucotrieno B4 y péptidos originados por la activación del complemento (C5a y C3a); ellos interactúan con receptores específicos de membrana de la familia de receptores tipo rodopsina (serpinas, con siete porciones transmembrana) que se asocian en la porción intracelular con una proteína G, la cual al activarse inicia la transducción de señales activando proteínas de la familia de la fosfolipasa C.
Modelos Fisiopatológicos Relacionados con las Moléculas de Adhesión
El exceso, defecto o ausencia de las moléculas de adhesión se relaciona con eventos anormales que participan en el desarrollo de algunas enfermedades; por tanto, éstas son usadas como modelos para el ESTUDIO y análisis de la función y estructura de dichas moléculas. A continuación haremos referencia a algunos modelos de interés.
Deficiencia de adhesión leucocitaria Tipo I
Esta es una enfermedad autosómica recesiva, en la cual existe un defecto en las 3 integrinas leucocitarias CD11/CD18 por mutaciones en el gen que codifica para la cadena b2 común (CD18, cromosoma 21q22.3). Los defectos puede llevar a la ausencia total de la cadena CD18 o alteraciones que afectan su estructura o las interacciones con la subunidad alfa.
Se habla de un fenotipo severo cuando se expresan menos del 0.3% de la cantidad normal de las b2 integrinas, y de un fenotipo moderado cuando los niveles de dichas integrinas se encuentran entre el 2.5 y el 11% del valor normal.
Este desorden se caracteriza por anormalidades en las actividades dependientes de la adhesión leucocitaria, especialmente a nivel de la función del neutrófilo: alteraciones en la adhesión, quimiotaxis y la fagocitosis de los microorganismos opsonizados con C3bi (ligando del MAC-1). En los sitios de infección es característico la ausencia de respuesta inflamatoria franca.
Los pacientes que presentan esta afección se caracterizan por: retardo en la caída del cordón umbilical y onfalitis; infecciones bacterianas y micóticas recurrentes severas; úlceras necróticas sin presencia de pus; gingivitis y periodontitis; infecciones del tracto respiratorio superior e inferior; y abscesos cutáneos y celulitis.
Los agentes infecciosos más frecuentemente aislados son el Staphylococcus aureus, bacterias gram negativas, Candida albicans y Aspergillus spp.
En los ESTUDIOS de laboratorio se pueden encontrar: neutrofilia aun en ausencia de infección activa; quimiotaxis deficiente in vivo e in vitro; ausencia de adhesión al vidrio, plástico y al cultivo con células endoteliales.
El diagnóstico se confirma por medio de citometría de flujo, en la cual se evalúa la expresión del CD18 en la superficie de los leucocitos. También se puede hacer la caracterización molecular de los diferentes defectos implicados y el diagnóstico prenatal (en neutrófilos del cordón umbilical).
Deficiencia en la adhesión leucocitaria Tipo II
Se origina por un defecto en la adhesión mediada por las selectinas; la causa es una falla en el metabolismo de la fucosa, que lleva a una alteración en la adición de estos carbohidratos a las proteínas que son ligandos para las selectinas, como es el caso del Sialyl Lewis-X. Se asocia, además, con la ausencia del antígeno H en la superficie del glóbulo rojo, lo cual origina el fenotipo Bombay (hh).
Los pacientes presentan dismorfismo craneofacial, déficit neurológico, neutrofilia, deficiente respuesta inflamatoria ante las noxas, e infecciones recurrentes respiratorias. In vitro se encuentran defectos en quimiotaxis, la fagocitosis, y la agregación de las células fagocíticas.
En los afectados por esta entidad se ha observado disminución de la VIDA media de los neutrófilos circulantes, aproximadamente en un 50% con respecto al valor normal; se desconocen los defectos moleculares subyacentes.
Enfermedades inflamatorias crónicas
Observaciones de algunas enfermedades dermatológicas como la psoriasis, han llevado a postular que la distribución incorrecta de las moléculas de adhesión (por ejemplo: las integrinas) puede llevar a un fenotipo de tipo psoriásico. Se han realizado experimentos en ratones transgénicos que expresan específicamente las b1 integrinas en las capas suprabasales de la epidermis, encontrando manifestaciones clínicas y hallazgos histológicos compatibles con la psoriasis.
En un modelo de artritis se han llevado a cabo trabajos experimentales en los cuales la inyección intraarticular de un antígeno soluble se induce una inflamación aguda, que es seguida por una sinovitis crónica similar a la que se observa en la artritis reumatoidea.
La administración de anticuerpos monoclonales (anti E-selectina o anti ICAM-1) pre y post la inyección articular, inhibe la FORMACIÓN tanto del infiltrado agudo como del infiltrado crónico. Se ha demostrado que la utilización de diferentes fármacos en el tratamiento de la artritis reumatoidea modifica la expresión de las moléculas de adhesión; por ejemplo, en el caso de los corticosteroides, se ha observado que disminuyen la expresión de la E-selectina y del ICAM-1.
La expresión del ICAM-1 en la superficie de las células endoteliales:
Se aumenta por los estímulos inflamatorios de diverso origen, como los derivados de las infecciones o los presentes en las enfermedades alérgicas (asma, dermatitis atópica). En un modelo desarrollado en ratones, se aplicaron anticuerpos monoclonales anti-LFA-1 y anti-ICAM-1, los cuales suministrados previamente a la sensibilización con un hapteno evitaron la inducción de la hipersensibilidad por contacto.
Los eosinófilos, pero no los neutrófilos, expresan el VLA-4 que se une al VCAM-1, explicando el reclutamiento selectivo de los eosinófilos en la inflamación alérgica. La utilización en modelos animales de anticuerpos monoclonales anti-VCAM-1 ha mostrado utilidad terapéutica potencial para el manejo de enfermedades autoinmunes e inflamatorias, porque regula el tráfico de eosinófilos, monocitos y linfocitos.
Enfermedades infecciosas
En el modelo del resfriado común se observó que el rhinovirus infecta las células del epitelio nasal utilizando el ICAM-1 como receptor. En estados de inflamación crónica como los hallados en las enfermedades alérgicas. El aumento en la expresión del ICAM-1 sobre las células epiteliales favorece la colonización por este virus y desencadena los síntomas agudos de alergia. En estudios realizados en chimpancés, se demostró que una forma soluble del ICAM-1 prevenía la infección por el rhinovirus.
En la fisiopatología de otras enfermedades infecciosas y parasitarias, los microorganismos poseen ciertas proteínas en su superficie que pueden ser utilizadas como ligandos para las moléculas de adhesión celular y así invadir al hospedero.