El ojo y la nariz están comúnmente involucrados en las reacciones alérgicas, ya sea como órganos blanco o como órganos co-estimulados por la alergia respiratoria.
El epitelio de la mucosa nasal y conjuntival es clínicamente de fácil abordaje, y tolera bien los procedimientos de provocación tanto en los retos específicos como inespecíficos; además, el ojo (o la mucosa nasal) contralateral sirve de control negativo durante las pruebas de provocación.
La evaluación clínica se realiza generalmente con una escala arbitraria de síntomas; el estudio citológico de las muestras conjuntivales o nasales toman en cuenta el número de células inflamatorias; la expresión de ICAM-1 se analiza por tinción inmuno-enzimática, informada a través de una escala ordinaria (10).
Evaluación de resultados: conjuntiva y nariz
Los hallazgos patológicos ocurren luego de un reto antigénico específico e involucran el desarrollo de una reacción clínica de fase temprana (EPR: Early Phase Reaction); si el proceso inflamatorio es mantenido se denomina reacción de fase tardía (LPR: Late Phase Reaction).
La reacción de fase temprana se caracteriza por un infiltrado local (mayoritariamente por neutrófilos) y la expresión de ICAM-1 epitelial. La reacción de fase tardía empieza a aparecer a la hora del reto, con un pico entre las 6 a 8 horas y cede a las 24 horas, con un infiltrado inflamatorio predominantemente de eosinófilos.
Las manifestaciones clínicas y el tipo de infiltrado celular pueden variar de acuerdo con la dosis del alergeno: con altas dosis ambas reacciones ocurren frecuentemente, mientras con dosis bajas pueden no presentarse manifestaciones clínicas y solo un infiltrado celular es observado (10).
Los individuos alérgicos sensibles a los pólenes no muestran un infiltrado inflamatorio o expresión del ICAM-1 sobre la conjuntiva cuando están asintomáticos (y por fuera de la estación polínica que los sensibiliza); al contrario, si estos individuos son expuestos a los alergenos (que previamente los han sensibilizado), muestran infiltración conjuntival y expresión del ICAM-1 sobre las células epiteliales. Así, el infiltrado inflamatorio y la expresión del ICAM-1 en los individuos alérgicos están estrictamente relacionados con la exposición alergénica (11).
Esos hallazgos son consistentes con lo encontrado en el asma, en la que una inflamación modelas fases de latencia clínica de la enfermedad (12-15, 23).
El hecho de que la inflamación exista en ausencia de sintomatología es muy importante: este fenómeno ha sido llamado Inflamación mínima persistente (IMP). Figura 1. (3, 5-6, 10-11).
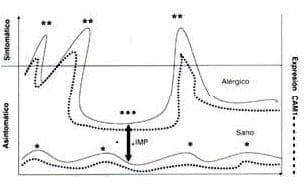
Figura 1. Inflamación mínima persistente en individuo alérgicos rspiratorios: representación esquemática Sujetos sanos expuestos a aeroalergeno no desarrollan sintomatología respiratorio o conjuntival, ni expresan ICAM-1 (*). Sujetos alérgicos y expuestos al alérgeno, que los ha sensibilizado, muestran síntomas que se correlacionan con la expresión de ICAM-1 (**). En periodos de baja exposición alergénica (***), los pacientes alérgicos están generalmente asintomáticos pero pueden expresar ICAM-1. (IMP: Inflamación mínima Persistente).
La presencia del ICAM-1 en los epitelios de los pacientes alérgicos podría revelar una susceptibilidad aumentada de las células epiteliales a sufrir daño por las células inflamatorias (por ejemplo, por los eosinófilos).
Esta hipótesis podría proveer una explicación fisiopatológica adicional del daño epitelial, el cual es uno de los marcadores de la inflamación alérgica.
La expresión del ICAM-1 sobre las células epiteliales puede definitivamente ser considerado como un marcador de inflamación desencadenado por el estímulo alérgico. Reportes recientes han creado perspectivas interesantes pues las moléculas de adhesión solubles, como el ICAM-1 soluble, han sido descritas (16-17).
De otro lado, es interesante anotar que las crisis asmáticas están frecuentemente precedidas por una infección respiratoria viral, principalmente en los niños, el 80% de ellas debidas a rinovirus; el primer dominio del ICAM-1 es el receptor para el 90% de los rinovirus humanos.
Hasta el presente, se había considerado la infección como el efecto primario para las exacerbaciones asmáticas; sin embargo la expresión del ICAM-1 en las células epiteliales puede, al menos en algunos casos, ser el efecto primario que desencadena la exacerbación asmática correlacionada con el virus.
La expresión del ICAM.-1 debe ser previamente inducida por el alergeno; todo lo anterior explicaría el efecto tan fuerte que tiene la infección por los rinovirus en los pacientes que sufren asma (5, 7, 18).
Implicaciones terapéuticas
La mayoría de los recientes antihistamínicos, además de los esteroides y de la inmunoterapia local, que usualmente son utilizados para el tratamiento de la enfermedad alérgica, han demostrado su capacidad para reducir la sintomatología, la inflamación y la expresión del ICAM-1 sobre las células epiteliales conjuntivales, nasales y pulmonares.
Los mecanismos por los cuales se produce reducción de la expresión del ICAM-1 no son bien conocidos, aunque parecen independientes del efecto antihistamínico.
Los nuevos estudios clínicos confirman el papel y la importancia de la modulación de las moléculas de adherencia como una nueva estrategia terapéutica para el tratamiento de las enfermedades alérgicas (5, 10, 19-22).
Algunos estudios han demostrado que el incremento en la expresión del ICAM-1 favorece las infecciones por rinovirus en virtud del aumento en el número de receptores para ellos; además, la inducción de citoquinas que sigue a la infección vírica, conlleva a una inflamación asociada a la IMP, y tendría un efecto sumatorio sobre la sintomatología del paciente.
Esta hipótesis adicional (infecciosa) ha sido sustentada epidemiológicamente y generado algunas estrategias de tratamiento dirigidas a la prevención de las infecciones respiratorias y la expresión del ICAM-1, para evitar la aparición de la alergia o disminuir el impacto de las infecciones.
Así, la formulación precoz y prolongada, durante la niñez, de bloqueadores del receptor H1 de la histamina podría ser muy útil en la prevención del asma o la rinitis alérgica, e incluso en la prevención de las infecciones por rinovirus.
En este sentido se han venido realizando varios estudios, entre ellos:
ETAC (Early Treatment of the Atopic Child) y PREVENTIA; hasta el momento solo se conocen resultados parciales.
La evidencia de que los rinovirus aumentan la reacción inflamatoria tardía en los asmáticos genera un argumento más para el uso de los esteroides, tratando de disminuir la severidad y persistencia de la sintomatología.
Sin embargo, los resultados son contradictorios y podrían explicarse por la variabilidad de los fármacos (Beclometasona, Budesonida) y las dosis empleadas, así como por la diferencia de edad de los pacientes.
Se ha descrito un aumento en la producción de cistenil leucotrienos en los preescolares con broncoespasmo ligado a infecciones vÍricas, abriéndose otra posibilidad de manejar terapéuticamente a estos pacientes con antileucotrienos.
Al nivel de la prevención también se han desarrollado otras estrategias, como evitar la infección teniendo en cuenta la vía de inoculación; recientes estudios enfatizan la importancia de evitar la autoinoculación derivada de tocarse la nariz y los ojos en aquellos pacientes que habían contactado con los virus.
Al mismo tiempo se aconseja evitar enviar a la guardería los pacientes que tengan una afectación importante (23).
Referencias bibliográficas
- 1. Barnes PJ. Pathophisiology of allergic inflammation. In: Middleton EJ, Reed CE, eds. Allergy. Principles and Practice. 5th ed. Philadelphia: Mosby INC, 1998:356-365.
- 2. Varini J, Ward PA. Biology of endothelial cell. In: Middleton EJ, Reed CE, eds. Allergy. Principles and Practice. 5th ed. Philadephia: Mosby INC, 1998:314-322.
- 3. Ciprandi G, Buscaglia S, Pesce G, Pronzato C. Minimal persistent inflammation is present at mucosal level in patients with asymptomatic rhinitis and mite allergy. J Allergy Clin Immunol 1995;96:971-979.
- 4. Hamid Q. Molecular pathology of allergic disease. J Allergy Clin Immunol 2000;105:211-223.
- 5. Canonica GW, Ciprandi G. Minimal persistent inflammation may be controlled by cetirizine. Ann Allergy Asthma Immunol 1999;83:445-448.
- 6. Canonica GW, Ciprandi G, Buscaglia S, Pesce GP. Adhesion molecules of allergic inflammation: recent insights into their functional roles. Allergy 1994;49:135-141.
- 7. Canonica GW, Ciprandi G, Pesce GP, Buscaglia S. ICAM-1 on epithelial cells in allergic subjects: a hallmark of allergic inflammation. Int Arch Allergy Immunol 1995;107:99-102.
- 8. Proud D. Biology of the epithelial cells. In: Middleton EJ, Reed CE, eds. Allergy. Principles and Practice. 5th ed. Philadelphia: Mosby INC, 1998:306-313.
- 9. Wagner CD, Gundel RH, Reilly P, Haynes N. Intercellular adhesion molecule-1 in the pathogenesis of asthma. Science 1990;247:456-460.
- 10. Canonica WC, Ciprandi G, Passalacqua G, Pesce G. Molecular events in allergy inflammation: experimental models and possible modulations. Allergy 1997;52 (Suppl 34):25-30.
- 11. Ricca V, Landi M, Ferrero P, Bairo A. Minimal persistent inflammation is also present in patients with seasonal allergic rhinitis. J Allergy Clin Immunol 1999;104:54-57.
Fuentes Bibliográficas
- 12. Jeffery PK, Wardlaw AJ, Fiona C, Nelson C. Bronchial biopsies in asthma. An ultrastructural, quantitative study and correlation with hyperreactivity. Am Rev Respir Dis 1989;140:1745-1753.
- 13. Djukanovic R, Roche WR, Wilson JW, Beasley CRW. Mucosal inflammation in asthma. Am Rev Respir Dis 1990;142:434-457.
- 14. Ciprandi G, Pronzato C, Ricca V, Prassalacqua G. Allergen-specific challenge induces intracellular adhesion molecule-1 (ICAM-1 or CD54) on nasal epithelial cells in allergic subjects. Relationships with early and late inflammatory phenomena. Am J Respir Crit Care Med 1994;150:1653-1659.
- 15. Ciprandi G, Pruzato C, Ricca V, Bragnasco M, Canonica GW. Evidence of intracellular adhesion molecule-1 expression on nasal epithelial cells in acute rhinoconjuntivitis caused by pollen exposure. J Allergy Clin Immunol 1994;94:738-746.
- 16. Gearing AJH, Newman W. Circulating adhesion molecules. Immunol Today 1993;14:506-512.
- 17. Tanaka G, Adams DH, Hubsches S. T-cell adhesion induced by proteoclican-immunobilized cytokine MIP-1b. Nature 1993;361:79-82.
- 18. Pattermore PK, Johnston SL, Barden TG. Viruses as precipitants of asthma symptoms: epidemiology. Clin Exp Allergy 1992;22:325-336.
- 19. Ciprandi G, Buscaglia S, Pesce G, Passalacqua G. Cetirizine reduces inflammatory cells recruitment and ICAM-1 (or CD54) expression on conjunctival epithelium in both early-and late- phase reactions after allergen-specific challenges. J Allergy Clin Immunol 1995;95:612-621.
- 20. Bagnasco M, Canonica GW. Influence of H1-receptor antagonists on adhesion molecules and cellular traffic. Allergy 1995;50:17-23.
Lecturas Recomendadas
- 21. Ciprandi G, Ricca V, Tosca M, Landi M. Continuous antihistamine treatment controls allergy inflammation and reduces respiratory morbility in children with mite allergy. Allergy 1999;54:358-365.
- 22. Canonica GW, Ciprandi G. Anti allergic drugs and the immune response. Interactions and possible clinical relevance. Allergy 1984;44:1-5.
- 23. Bosquete M. and Carballada F. “Asma, moléculas de adhesión e infección vírica: Interacciones y posibilidades terapéuticas”. Alerg Inmunol Clin 2000;15(2): 98-102.