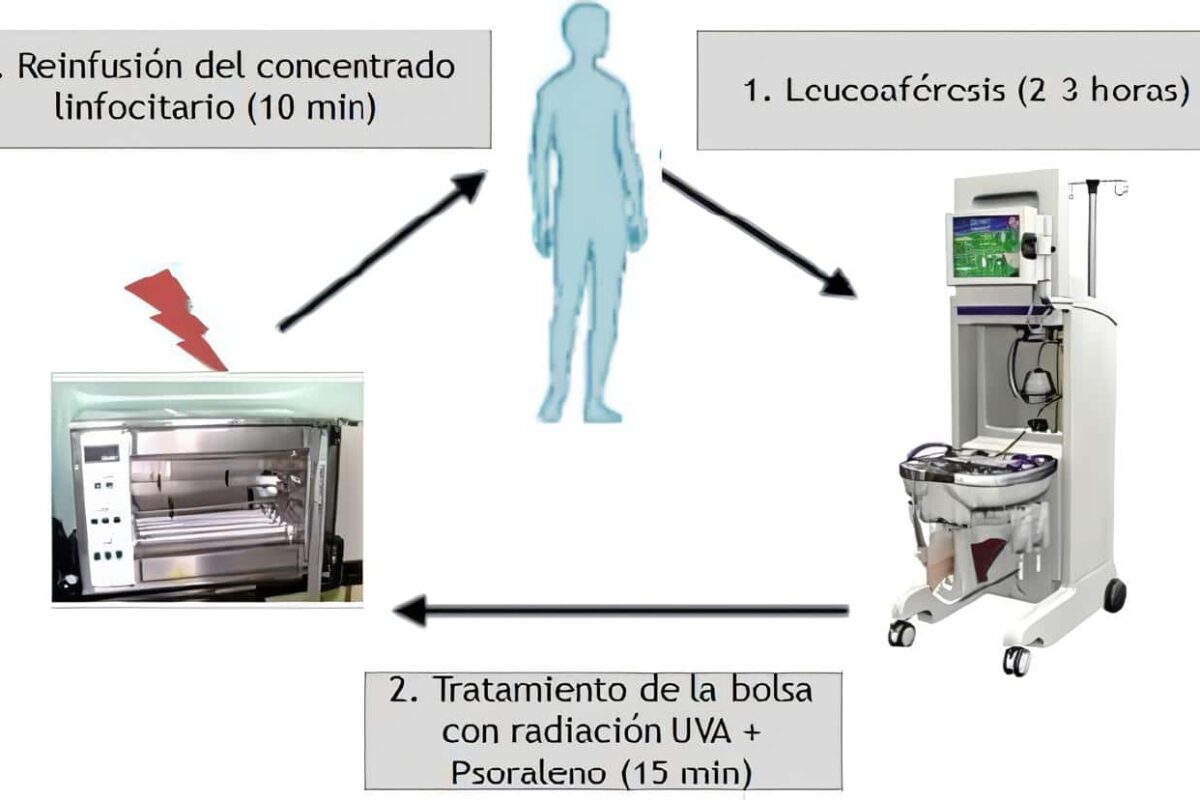
Como una terapia de inmunointervención alterna a la fotoféresis, el Grupo de Inmunointervención de la Universidad de Antioquia, de la Sección de Dermatología y el Laboratorio Central de Investigaciones, y el Grupo de Trasplantes de Sangre y Médula Osea, está desarrollando la técnica denominada radioféresis.
En esta línea de investigación se han tratado pacientes con LCCT, EicH aguda y crónica, y linfoma no Hodgkin, observando notable mejoría clínica de las lesiones.
Procedimiento
Las células mononucleares son separadas en la máquina de citaféresis del Banco de Sangre. Procesando un volumen de 5.000 cc de sangre se obtienen 300 cc, 80% linfocitos y 20% monocitos, los cuales se irradian a bajas dosis, 200 cGy de radiación ionizante, e inmediatamente son reinfundidos.
Efectos celulares de la irradiación
La radiación ionizante fue descubierta en 1895; su acción se basa en la producción de ionización. El agua es el componente celular más abundante, y al recibir dosis de radiación mayores a 33eV de energía su átomo de hidrógeno pierde un electrón y forma radicales libres hidroxilo, importantes para la inducción del daño celular. Las partículas cargadas y los radicales libres lesionan el DNA, inducen aberraciones cromosómicas que comprometen la capacidad de división y la célula muere. La letalidad se relaciona con la dosis de radiación y el número de rupturas de la doble cadena del DNA.
La irradiación de linfocitos a bajas dosis promueve la apoptosis y el aumento de complejos HLA-I, lo cual permite aumentar la capacidad antitumoral e inmunorregulatoria de las células T y las células dendríticas. Además, promueve el quimerismo y la tolerancia en los pacientes trasplantados. Los efectos celulares son diversos y dependen de la dosis de irradiación, la población celular y la fase del ciclo celular.
El principal efecto es la inducción de muerte celular por apoptosis debido a daños en el DNA, inhibición de la proliferación y alteración en la expresión de genes de diversas proteínas y marcadores de membrana; la apoptosis es mediada principalmente por p53.
La sensibilidad celular a la apoptosis se relaciona con factores como:
- La capacidad de reparación del DNA.
- La presencia y funcionalidad del inhibidor de la ciclina quinasa p21. Este es un mediador de la apoptosis que induce el paro del ciclo celular en G1. Se aumenta por el supresor tumoral p53.
- La expresión del gen c-fos aumenta la sensibilidad a la apoptosis en linfocitos T CD4+ y CD8+. Es inducido por la radiación.
- Otros efectos celulares de la radiación ionizante son:
- Daños citogenéticos subletales sin apoptosis.
- Inducción de la expresión de CD69 en linfocitos T y B, dependiente de la dosis y el tiempo. Es un marcador de la respuesta a la irradiación.
- Efecto antiproliferativo. Se ha demostrado disminución de la capacidad proliferativa de los linfocitos, conservando el número y capacidad fagocítica de los monocitos.
- Inducción de la activación celular con mayor expresión del factor de transcripción nuclear NFkB en las células T.
- Activación de mecanismos de reparación de los daños cromosómicos subletales.
- Cambio en la producción de citoquinas. Bajas dosis de radiación, 0.1 a 6 Gy, incrementan la producción de TNF por los macrófagos.
Usos terapéuticos de los linfocitos irradiados
La radioféresis es una transfusión de linfocitos autólogos irradiados. Esta técnica no ha sido descrita antes, mientras que el uso de linfocitos alogénicos irradiados (linfocitos del donante), es una terapia de amplio uso en los pacientes trasplantados con células hematopoyéticas en el período postrasplante.
El principal uso terapéutico de la infusión de linfocitos alogénicos es la optimización de la respuesta antitumoral, la toma del injerto y el quimerismo pos trasplante de médula, disminuyendo las recaídas de la enfermedad maligna de base. Si las recaídas se presentan, pueden ser también tratadas exitosamente con infusiones de linfocitos del donante, debido a que las células T conservan su efecto antitumoral.
Las infusiones de linfocitos pueden ser irradiadas o no irradiadas. La irradiación disminuye el riesgo de presentación de EicH, debido a que tiene efecto antiproliferativo sobre los linfocitos T, a la vez que preserva la capacidad de citotoxicidad específica que media el efecto antitumoral.
Con base en la literatura, se plantea que la radioféresis podría tener su efecto inmunomodulador de manera similar a la fotoféresis; así, los clones de linfocitos T patógenos se convierten en linfocitos apoptóticos por la irradiación a bajas dosis, y los monocitos son estimulados a convertirse en células dendríticas, lo que inicia la cascada de fagocitosis, procesamiento y presentación antigénica responsable de la activación de las respuestas citotóxicas específicas dirigidas a destruir los clones patógenos.
A la fecha han sido tratados cinco pacientes, dos con EicH crónica, dos con LCCT y uno con Linfoma no Hodgkin. Las observaciones clínicas muestran efectos positivos y resultados alentadores.
En la EicH, la radioféresis ha mostrado efectos excelentes en ambos pacientes.
El primero de ellos presentaba lesiones esclerodermiformes severas y progresivas que llevaron a incapacidad para deambular por dolor, disminución de los arcos de movimiento por la esclerosis y alteración de la gesticulación facial, sin respuesta a la terapia convencional; con la radioféresis la paciente ha recuperado la elasticidad de la piel y anexos cutáneos, y se ha estabilizado el compromiso sistémico, y aún permanece en tratamiento con radioféresis.
El segundo paciente presentaba concomitantemente EicH y recaída del linfoma, por lo que estaba contraindicado el tratamiento inmunosupresor por los riesgos de empeorar el linfoma; con la radioféresis se obtuvo el control de la EicH y la recaída tumoral.
En el caso del LCCT, una de las pacientes en estadio tumoral había recibido quimioterapia CHOP sin respuesta; luego del tercer ciclo de radioféresis presentó disminución del tamaño y el volumen de sus lesiones, cambio de coloración violácea a café y descamación en los tumores.
El estudio de los efectos inmunológicos de la radioféresis permitirá precisar sus mecanismos de acción y ampliar sus posibilidades terapéuticas a diferentes enfermedades. Actualmente se desarrolla un protocolo de investigación clínico e inmunológico al respecto.
Vacunación con células dendríticas
Los tumores humanos expresan numerosos antígenos que pueden ser reconocidos por las células T y son blancos potenciales para la inmunoterapia.
Las células dendríticas son leucocitos con capacidades únicas para la presentación antigénica a las células T; esta propiedad ha sido utilizada para el estudio y desarrollo de vacunas antitumorales.
La administración de células dendríticas pulsadas con antígenos tumorales, como una vacuna celular, ha demostrado la capacidad de inducir efecto protector y terapéutico antitumoral en modelos animales.
En estudios pilotos con vacunas de células dendríticas en linfoma no-Hodgkin y melanoma se han observado respuestas antitumorales efectivas con regresión del tumor.
Actualmente se realizan múltiples estudios con diferentes tumores y diferentes formas de administrar el antígeno a las células dendríticas, con resultados promisorios.
La explotación de las propiedades de presentación antigénica de las células dendríticas ofrece en el futuro el desarrollo de una inmunoterapia efectiva anticáncer.
Generalidades de las células dendríticas
Las células dendríticas fueron descritas por Steinman y colaboradores en 1973. Tienen dos orígenes, un precursor hematopoyético CD34+ y los monocitos periféricos. En circulación se encuentran en muy baja cantidad, representando alrededor del 0.5%; en los tejidos se encuentran a la entrada de los posibles retos antigénicos como los epitelios, la piel (donde se conocen como células de Langerhans), en el timo como células interdigitantes y los nódulos linfáticos.
Las células dendríticas inmaduras exhiben características fagocíticas de captura y procesamiento antigénico. Los antígenos son procesados intracelularmente y degradados en péptidos pequeños que se unen a las moléculas HLA clase I y clase II, que posteriormente serán expresados en la superficie celular.
Cuando las células dendríticas se estimulan con TNF-a o LPS:
sufren una serie de cambios fisiológicos que desencadenan su maduración. En estas circunstancias, la maquinaria de captura antigénica sufre regulación descendente, aumentan las moléculas de adhesión y coestimulatorias, y se estabilizan los complejos HLA-péptido en la superficie celular.
Las células dendríticas se movilizan a través de los linfáticos en busca de los linfocitos T de los nódulos linfáticos, y producen quimioquinas que los atraen.
La unión del CD40 de la superficie de las células dendríticas con el CD40L, expresado por las células T, promueve el incremento en la expresión de CD80 (B7.1) y CD86 (B7.2), y la secreción de IL-12 por las células dendríticas. La IL-12 estimula el desarrollo de linfocitos Th1 en las células T CD4+ y la maduración de los linfocitos T citotóxicos.
Estas acciones mediadas por las células dendríticas las convierten en centinelas del sistema inmune, capturando los antígenos en las puertas de entrada y presentándolos de manera inmunológicamente eficiente a las células T.
Las células dendríticas pueden ser estimuladas negativamente por sustancias inmunosupresoras derivadas del tumor; en modelos animales de cáncer, las células dendríticas tienen disminuidas sus funciones de presentación antigénica. La IL-10 y el factor de crecimiento endoletial vascular (VEGF) son secretados por diversos tumores e inhiben la maduración funcional de las células dendríticas in vitro.
Desarrollo de vacunas con células dendríticas
Las células dendríticas pueden ser pulsadas (co-cultivadas) con antígenos tumorales solubles en forma de proteínas completas o de péptidos pequeños.
Las proteínas deber ser captadas, procesadas y presentadas, mientras que los péptidos pequeños, entre 8 y 10 aminoácidos, se unen directamente a las moléculas HLA clase I en la superficie celular.
Las células dendríticas pulsadas con antígenos son células presentadoras de antígenos que estimulan tanto a las células ayudadoras como a las citotóxicas. Esta poderosa actividad ha sido demostrada in vivo en modelos animales y ha llevado al desarrollo y administración de células dendríticas pulsadas ex vivo con antígenos tumorales como vacunas para inmunointervención en cáncer.
Actualmente, múltiples investigaciones se conducen para esclarecer la forma más eficiente, desde el punto de vista inmunológico, para administrar los antígenos tumorales.
En la mayoría de tumores humanos no se conocen las secuencias de los péptidos antigénicos que son potenciales blancos de la respuesta inmune eficiente. Las investigaciones se dirigen al desarrollo de técnicas en las que no sea necesario el conocimiento exacto de los péptidos más relevantes en el tumor para lograr una vacuna antitumoral eficaz.
Es así como se han investigado vacunas con péptidos no fraccionados, péptidos de p53 mutante, genes que codifican antígenos tumorales inyectados directamente en la célula dendrítica, infección de las células dendríticas con virus recombinantes que introducen secuencias antigénicas tumorales, hibridomas, entre otras.
Generación de células dendríticas para vacunas
Se han desarrollado técnicas para generar grandes cantidades de células dendríticas in vitro, a partir de precursores de células dendríticas inmaduras en sangre periférica, mononucleares y progenitores CD34+ en cultivo con GM-CSF e IL-4.
Las células dendríticas obtenidas de cultivos de monocitos y células CD34+ presentan una morfología estrellada a los 5 – 7 días, asociada al aumento de mo
léculas coestimulatorias, pérdida del CD14 y adquisición de la capacidad de estimular a las células T. En este período las células tienen un fenotipo inestable y conservan su capacidad de capturar y procesar antígenos; si se suspenden el GM-CSF e IL-4 en los cultivos, estas células regresan a su estado de monocitos. La administración de TNF-a al cultivo, promueve la maduración de las células dendríticas, la expresión del CD83 y las capacidades aloestimulatorias y estimulatorias de la citotoxicidad.
Los progenitores hematopoyéticos CD34+ purificados de médula ósea, sangre de cordón umbilical, o movilizados a sangre periférica con G-CSF o GM-CSF, pueden servir también de fuente para obtener células dendríticas.
Estudios clínicos con vacunas de células dendríticas
Existen múltiples publicaciones acerca de la vacunación con células dendríticas, la mayoría en modelos animales.
Se han realizado estudios clínicos en humanos que demuestran que la vacunación es segura, produce pocos efectos adversos y tiene amplio potencial terapéutico a optimizar en el futuro.
Los principales estudios en humanos son en pacientes con linfoma no-Hodgkin, mieloma múltiple, melanoma y cáncer de próstata. En pacientes con linfoma no Hodgkin y melanoma se ha observado regresión del tumor y mejoría clínica.
En todos los tumores mencionados se han encontrado altas respuestas citotóxicas, pero no siempre acompañadas de mejoría clínica.
La caracterización de los antígenos del melanoma reconocidos por las células T ha promovido el desarrollo de vacunas; estos antígenos incluyen el gp100, MART-1, tirosinasa, MAGE-1 y MAGE-3.
Aunque la administración de estos péptidos solos o con inmunoterapia convencional puede inducir reactividad inmune in vitro, la respuesta clínica es poca, lo que motivó al uso de estos péptidos para pulsar células dendríticas y administrarlos como una vacuna.
Los primeros estudios se realizaron con células dendríticas pulsados con MAGE-1, obteniendo respuestas citotóxicas pero sin respuesta terapéutica. Posterior mente, en otros estudios se han usado los cuatro antígenos, logrando respuestas terapéuticas en cinco de 16 pacientes, resultados que son alentadores.
Se plantean nuevos interrogantes sobre cual es la forma de antígeno a utilizar, la mejor fuente de las células dendríticas y la ruta y esquema de administración de la vacuna. Esta técnica de inmunointervención permanece en investigación, y en el mundo actualmente se desarrollan numerosos protocolos clínicos.
Referencias bibliográficas
- 1. Edelson RL, Berger C, Gasparro F, et al. Treatment of cutaneous T-cell lymphoma by extracorporeal photochemotherapy. N England J Med 1987;316(6):297-303.
- 2. Yoo EK, Rook AH, Elenitsas R, et al. Apoptosis induction by ultraviolet light A and Photochemotherapy in cutaneous T-cell lymphoma: relevance to mechanism of therapeutic action. J Invest Dermatol 1996, 107(2):235-242.
- 3. Rook AH, Suchin R, Kao DMF, et al. Photopheresis: clinical applications and mechanism of action. J Invest Dermatol Symposium Proc 1999;4:85-90.
- 4. Zic JA, Stricklin GP, Greer JP, et al. Long-term follow-up of patients with cutaneous T-cell lymphoma treated with extracorporeal photochemotherapy. J Am Acad Dermatol, 1996, 35(6):935-945.
- 5. Greinix HT, Volc-Platzer B, Rabitsch W, et al. Successful use of extracorporeal photochemotherapy in the treatment of severe acute and chronic graft-versus-host disease. Blood 1998, 92(9):3098-3104.
- 6. Wollina U, Lange D, Looks A. Short time extracorporeal photochemotherapy inh the treatment of drug-resistant autoimmune bullous diseases. Dermatology 1999, 198:140-144.
- 7. Spitzer TR, McAffe S, Sackstein R, Colby C, Sykes M. Intentional induction of mixed chimerism and achievement of antitumor responses after nonmyelablative conditioning therapy and HLA-matched donor bone marrow transplantation for refractory hematological malignances. Biology Blood Marrow Transplant 2000, 6(3A):309-320.
- 8. Fotedar R, Brickner H, Saadatmandi N, Rousselle T, Diederich L, Munsgi A, Jung B, Reed JC, Fotedar A. Effect of p21wafl/cip1 trasnsgene on radiation induced apoptosis in T cells. Oncogene 1999; 18(24):3652-8.
- 9. Radford IR, Aldridge DR. Importance of DNA damage in the induction of apoptosis by ionizing radiation: effect of the scid mutation and DNA ploidy on the radiosensitivity of murine lymphoid cell lines. Internat J Rad Biol 1999;75(2):143-53.
Fuentes bibliográficas
- 10. Dai HY, Tsao N, Leung WC, Lei HY. Increase of intracellular pH in p53-dependent apoptosis of thymocytes induced by gamma irradiation. Radiation Research 1998;150(2):183-9.
- 11. Vuckovic-Dekic L, Susnjar S, Stanojevic-Bakic N, Radosavljevic D. Radio- and chemotherapy variably affect the general immunocompetence of lung cancer patients. Panminerva Medica 1999;41(2):129-33.
- 12. Albertini RJ, Clark LS, Nicklas JA, O’Neill JP, Hui TE, Jostes R. Radiation quality affects the efficiency of induction and tje molecular spectrum of HPRT mutations in human cells. Radiation Research 1997;148(suppl 5):S76-86.
- 13. Pruschy M, Shi YQ, Crompton NE, Steinbach J, Aguzzi A, Glanzmann C, Bodis S. The proto-oncogene c-fos mediates apoptosis in murine T-lymphocytes induced by ionizing radiation and dexamethasone. Biochemical and Biophysical Research Communications 1997;241(2):519-24.
- 14. Louagie H, Philippe J, Vral A, Cornelissen M, Thierens H, De Ridder L. Induction of micronulei and apoptosis in natural killer cells compared to T lymphocytes after gamma-irradiation. Internal J Rad Biol 1998;73(2):179-85.
- 15. Chen JC, Davis BH, Leon MA, Leong LC. Gamma radiation induces CD69 expression on lymphocytes. Cytometry 1997;30(6):304-12.
- 16. Halachmy S, Bern O, Schreiber L, Carmel M, Sharabi Y, Shoham J, Nir U. P94fer facilites cellular recovery of gamma irradiated pre-T cells. Oncogene 1997;14(24):2871-80.
- 17. Waller EK, Boyer M. New strategies in allogeneic stem cell transplantation: immunotherapy using irradiated allogeneic T cells. Bone Marrow Transplant 2000;25(suppl 2):S20-S24.
- 18. Novoselova EG, Makar VR, Semiletova NV, Kolaeva SG, Sadovnikov VB. Production of TNF by macrophages an T-lymphocytes of rodents as affected by acute gamma-irradiation. Radiatsionnaia Biologiia, Radioecologiia 1998;38(5):690-5.
Lecturas Recomendadas
- 19. Rosen NR, Weidner JG, Boldt HD, Rosen DS. Prevention of transfusion-associated graft-versus-host disease: selection of an adequate dose of gamma radiation. Transfusion 1993;33(2):125-7.
- 20. Lanzavecchia A. Dendritic cell maturation and generation of immune responses. Haematologica 1999;84(EHA-4):23-5.
- 21. Rescigno M, Granucci F, Ricciardi-castagnoli P. Dendritic cells at the end of the millenium. Immunol Cell Biol 1999;77:404-410.
- 22. Branchereau J, Steinman RM. Dendritic cells and the control of immunity. Nature 1998;392(6673):245-252.
- 23. Timmerman JM, Levy R. Dendritic cell vaccines for cancer immunotherapy. Annu Rev Med 1999;50:507-529.