Las complicaciones de la HIV en el prematuro están relacionadas con la localización y la severidad de la hemorragia. La localizada en la región subependimaria en general se resuelve sin efectos residuales.
La resolución de la hemorragia en la región parenquimatosa depende de la localización. En el curso de semanas, la hemorragia evoluciona hacia quistes posthemorrágicos o dilatación porencefálica del sistema ventricular.
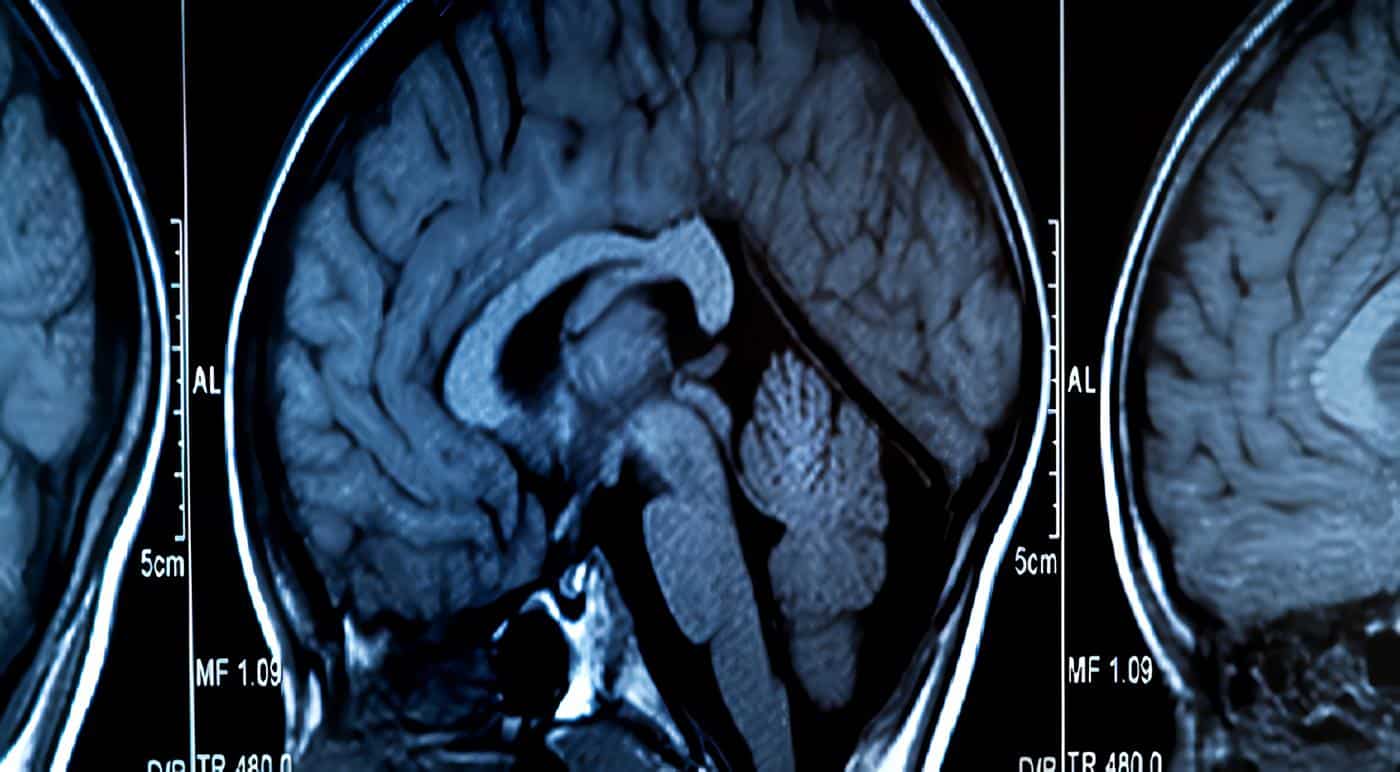
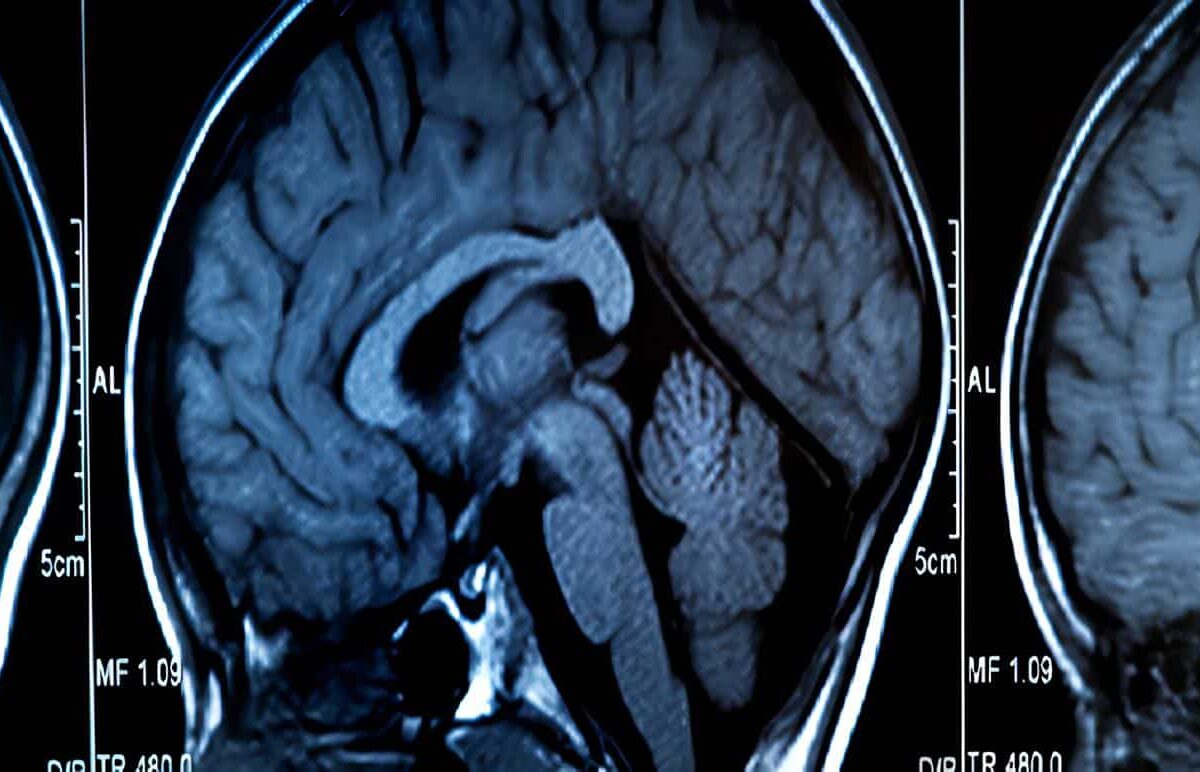
La dilatación ventricular posthemorrágica progresiva es la complicación mas seria y frecuente. El tamaño ventricular puede aumentar en la primera semana por la presencia de coágulos sanguíneos.
Aunque esta dilatación se puede resolver espontáneamente, 60 al 70% presentan aumento progresivo en el tamaño ventricular en las dos semanas siguientes a la ocurrencia de la hemorragia por acumulación del líquido cefalorraquídeo (LCR).
La ventrículomegalia posthemorrágica (VMPH) puede progresar en forma lenta o rápida. El 65% de las VMPH, que progresan lentamente pueden resolverse espontáneamente. En el restante 30 a 35% de los infantes afectados el tamaño ventricular aumenta rápidamente en un lapso de días a semanas.
Diagnóstico de la VMPH
Un aumento de la circunferencia craneal de más de 2 cmts por semana, una fontanela abombada, la inhabilidad de retirar la ventilación mecánica, o un aumento en el número de episodios de apnea y bradicardia, pueden sugerir la presencia de VM severa.
Puede haber un período de 2 a 4 semanas antes de que el perímetro cefálico aumente, por la presencia de espacios subaracnoideos amplios y suturas abiertas en los prematuros. La ecografía transfontanelar de seguimiento debe realizarse cada 5 a 7 días.
La VMPH progresiva se confirma con el aumento del tamaño ventricular en dos ecografías secuenciales. La VMPH debe diferenciarse de la leucomalasia periventricular (LMPV), la que está asociada con contornos ventriculares mal definidos, y regiones periventriculares radiolúcidas.
Prevención de la VMPH: Punciones Lumbares Repetidas
Mediante las punciones lumbares repetidas inmediatamente después de la ocurrencia de la HIV, se ha intentado disminuir la incidencia de la VMPH. Esto se lograría al remover la sangre y proteínas del espacio ventricular evitando el bloqueo de las vías del LCR, y reduciendo la reacción inflamatoria y fibrótica.
Aun cuando los estudios iniciales no controlados parecieron tener algún beneficio, un estudio aleatorizado y controlado, no mostró ningún efecto con la realización temprana de punciones lumbares repetidas para prevenir la evolución hacia la VMPH progresiva, por lo que no se recomienda actualmente.
Manejo de la VMPH Establecida
El manejo depende de la velocidad de progresión de la VM. La intervención definitiva es el drenaje permanente del LCR mediante la colocación de un shunt ventricular.
La edad óptima para su colocación es cuando el prematuro esté estable clínicamente, libre de enfermedad respiratoria e infección, y con adecuada ganancia de peso. Diferentes intervenciones se han utilizado mientras se espera estabilidad clínica.
Medicamentos para Disminuir la Producción de LCR
El estudio principal aleatorizado, multicéntrico y controlado que comparó manejo estándar versus acetazolamida asociada a furosemida, mostró luego de reclutar 177 infantes, mejor desenlace en el manejo estándar, con mayores efectos adversos en el grupo que recibió los fármacos, incluyendo acidosis, diarrea, falla en el crecimiento y nefrocalcinosis. Por esta razón no se recomienda su utilización (18).
Medicamentos para Promover la Fibrinólisis
Una revisión reciente de estudios aleatorizados para determinar si la estreptokinasa intraventricular luego de la HIV reduce el riesgo de dependencia permanente de shunt, déficit en el neurodesarrollo, o muerte, no mostró diferencias respecto al grupo control (19, 20).
Una nueva alternativa sería la administración intraventricular del activador del plasminógeno tisular recombinante, pues estudios iniciales no aleatorizados parecen demostrar buenas cifras de sobrevida y bajo requerimiento de cirugía de shunt (22).
Es necesario contar con estudios aleatorizados y controlados de buen tamaño de muestra para recomendar su uso rutinario. El riesgo de esta terapia es el potencial aumento de la HIV secundaria.
Punciones Lumbares Seriadas en la VMPH Establecida
En el principal estudio multicéntrico aleatorizado y controlado en la VMPH (“grupo de estudio de ventriculomegalia”) se redujo el incremento del tamaño ventricular y el aumento en el perímetro cefálico.
Sin embargo, no se encontraron diferencias en la prevalencia de alteración neuromotora, otras alteraciones, o alteraciones múltiples a los 30 meses de edad. Una clara desventaja encontrada fue el alto riesgo de infección del LCR (7%)(17).
Un metaanálisis de punciones lumbares repetidas o ventriculares sugiere que su uso rutinario no se puede recomendar.
Sin embargo, si el bebé que presenta VMPH tiene evidencia clínica de aumento de la presión intracraneana, medidas temporales que incluyan punciones lumbares para remover el LCR pueden adoptarse mientras se espera la colocación de un shunt definitivo (21).
Drenaje Ventricular Directo
Es usualmente la única forma efectiva de decomprimir el sistema ventricular en la VMPH rápidamente progresiva, mientras se esperan las condiciones óptimas para el drenaje permanente de LCR a través de un shunt.
El drenaje puede realizarse a través de punciones ventriculares directas (asociadas con mayor hemorragia ventricular), un dren ventricular externo a nivel de un túnel subcutáneo conectado a una bolsa de ventriculostomía externa (asociada con riesgo de infección luego de dos semanas), o mediante la colocación de un sistema de acceso ventricular (SAV).
El SAV consiste de un reservorio colocado a nivel subcutáneo craneal con el segmento terminal del tubo insertado a nivel ventricular. El reservorio del SAV puede ser puncionado por períodos más largos (hasta 6 semanas) sin riesgo de infección.
La frecuencia de remoción de LCR al puncionar el reservorio (10 ml/kg/día) puede ajustarse (diariamente o en forma interdiaria) mediante monitoreo del tamaño ventricular por ecografía transfontanelar (21).
Shunt Ventriculoperitoneal (SVP)
Neonatos con VMPH progresiva que no responden a las medidas temporales para detener la progresión de la ventriculomegalia, requieren de la inserción de un SVP, una medida necesaria en cerca del 70% de los infantes afectados.
Este procedimiento se puede realizar cuando el infante se encuentre clínicamente estable sin enfermedad respiratoria, enterocolitis necrotizante e infección. El SVP “agresivo temprano” (antes de la cuarta semana de edad) se ha asociado con obstrucción repetida del shunt, e infección. El número de revisiones puede variar entre 0 y 20 por infante en estudios a largo plazo.
Aproximadamente el 70% requieren de al menos una revisión y cerca del 50% tienen múltiples revisiones por infección. La mayoría permanecen dependientes del shunt (1).
En cuanto a la frecuencia de inserción del SVP, en el reporte del instituto nacional de salud de los EU el 7% de los menores de 1500 grs tenían VMPH persistente. De los 221 infantes que tenían VM, la condición se estabilizó en 141 (67%) y de los 70 que tenían VM progresiva, 53 (76%) requirieron SVP antes de la salida de la UCIN.
Pronóstico
Depende primordialmente de dos factores: la extensión de la hemorragia y el grado de dilatación ventricular. Aproximadamente el 50% de las HIV severas, el 15% de las moderadas y el 5% de las leves mueren.
Hemorragias Leves
Grado I o II. Aproximadamente el 10% de ambos grupos tendrán discapacidad. El hallazgo más común es la diplejía espástica.
Aunque en la edad preescolar tienen destreza comparable a los que no han tenido hemorragia, tienen score más bajo en las pruebas designadas para valorar integridad visual motora. También tienen problemas de aprendizaje cuando entran a la edad escolar.
Hemorragias Moderadas
Grado III. Aproximadamente el 40% de los pacientes tienen retardo severo del desarrollo. Las habilidades cognitiva y motora están comprometidas con frecuencia incluyendo cuadriplejía y diplejía. En la escuela primaria el 50% de los niños necesitan educación especial.
Hemorragia Severa
Grado IV. Por lo que la mortalidad es alta los datos en el desarrollo son escasos. Aproximadamente el 80% de los niños con hemorragia severa manifiestan una discapacidad mayor. La más común de las anormalidades es la hemiparesia del lado contralateral a la hemorragia.
Pronóstico de la VentrIculomegalia Posthemorrágica
El resultado neurológico y cognitivo luego de la VMPH es decepcionante. Sólo el 25% son normales al seguimiento; 50 al 75% tienen déficit neuromotor moderado a severo a los cinco años de vida. El determinante más importante del pronóstico es la severidad de la hemorragia.
Otros factores pronóstico son: la cantidad de proteína del LCR al momento del diagnóstico de VMPH, la persistencia de la VM luego de la intervención, el número de revisiones del shunt, la presencia de LPV, la presencia de convulsiones, y el menor peso y edad gestacional.
Estudios recientes han demostrado la presencia de déficits en las áreas visualmotora y visualespacial como secuelas de HIV, lo que podría explicarse por lesión del tracto óptico.
embarazo.
Eventos perinatales asociados
Referencias Bibliográficas
- 1. Shankaran S. Intracranial Hemorrhage In Very Low Birthweight Infants. Neoreviews 2000; 1:E43:1-7.
- 2. Chiswick Ml, Et Al: Protective Effect Of Vitamin E Against Intraventricular Hemorrhage In Prematures Babies. Bmj 1983; 287:81.
- 3. Donn Sm, Goldstein Gw, Roloff Dw: Prevention On Intraventicular Hemorrhage With Phenobarbital Therapy: Now What? Pediatrics 1986; 77:779.
- 4. Bada Hs. Prevention Of Intracraneal Hemorrhage. Neoreviews 2000; 1: E48-52.
- 5. Bada Hs. Routine Indomethacin Prophylaxis Has The Time Come? Pediatrics 1996; 98: 784-785.
- 6. Ethamsylate Trial Group: The Ec Randomized Controlled Trial Of Controlled Trial Of Profilactic Etamsylate For Very Preterm Neonates: Early Mortality And Morbidity. Arch Dis Child 1994; 70: F 20.
- 7. Kuban Kck Et Al: Neonatal Intracraneal Hemorrhage And Phenobarbital. Pediatrics 1986; 77:443.
- 8. Papile La, Et Al: Neonatal Intracraneal Hemorrhage: Periventricular, Intraventricular Hemorrhage. In Fanaroff A, Et Al: Neonatal-perinatal Medicine Fanaroff A, Martin R. 2002, P 879.
- 9. Poland Rl: Vitamin E For Prevention Of Perinatal Intracranial Hemorrhage. Pediatrics 1990; 85: 865.
- 10. Banks Ba, Canaan A, Morgan Ma, Et Al. Multiple Courses Of Antenatal Corticosteroids And Outcome Of Premature Neonates. Am J Obst Gynecol. 1999; 181: 709-717.
- 11. Ethamsylate Trial Group. The Ec Randomised Controlled Trial Of Prophylactic Ethamsylate For Very Preterm Neonates. Early Mortality And Morbidity. Arch Dis Child. 1994; 70:F201-f205.
- 12. Fish Wh, Cohen M, Franzek D, Williams Jm, Lemons Ja. Effect Of Intramuscular Vitamin E On Mortality And Intracranial Hemorrhage In Neonates Of 1000 Grams Or Less. Pediatrics. 1990; 85:578-584.
- 13. Fowlie Pw. Prophylactic Indomethacin: Systematic Review And Meta-analysis. Arch Dis Child. 1996;74:F81-f87.
- 14. Ment LR, Oh W, Ehrenkranz RA, et al. Antenatal steroides, delivery mode, and intraventricular hemorrhage in preterm infants. Am J Obst Gynecol. 1995; 172:795-800.
- 15. Rolbin SH, Cohen MM, et al. The premature infant: anesthesia for cesarean delivery. Anesth Analg. 1994; 78:012-917.
- 16. Thorp JA, Parriott J, et al. Antepartum vitamin K and Phenobarbital for preventing intraventricular hemorrhage in the premature newborn; a randomized double-blind placebo controlled trial. Obstet Gynecol. 1994; 83:70-76.
- 17. Ventriculomegaly Trial Group. Randomized trial of early tapping in neonatal posthaemorrhagic ventricular dilatation: results al 30 months. Arch Dis Child. 1994; 70:F129-F136.
- 18. International PHVD Drug Trial Group. International randomized controlled trial of acetazolamide and furosemide in posthaemorrhagic ventricular dilatation in infancy. Lancet. 1998; 352: 433-440.
- 19. Luciano R, Velardi F, et al. Failure of fibrinolytic endoventricular treatment to prevent neonatal post-haemorrhagic hydrocephalus. Child Nerv Syst. 1997; 13:73-76.
- 20. Whitelaw A. Inatraventricular streptokinase after intraventricular hemorrhage in newborn infants. In the Cochrane library, 1997. Cochrane Review.
- 21. Whitelaw A. Repeated lumbar or ventricular punctures in newborns with intraventricular hemorrhage. In the Cochrane library, 1998. Cochrane Review.
- 22. Whitelaw A, Saliba E, et al. Phase I study of intraventricular recombinant tissue plasminogen activator for treatment of posthaemorragic hydrocephalus. Arch Dis Child 1996; 75: F20-F26.