Muestras de líquido amniótico
Las muestras de LA se obtuvieron por amniocentesis transparieto-abdominal, tanto en el Departamento de Obstetricia y Ginecología de la Universidad Nacional de Colombia (en el Instituto Materno Infantil, IMI) como en las Instituciones remitentes. En todas las instituciones la amniocentesis se practicó bajo guía de ultrasonido, siguiendo estrictas medidas de asepsia y antisepsia y obteniendo previamente un consentimiento informado por escrito relacionado con los beneficios y los riesgos de la punción. En el IMI las muestras se dividieron en dos alícuotas, una para la determinación de los fosfolípidos del surfactante y otra para el recuento de CL; la primera se procesó el Laboratorio de Biología de la Procreación y la segunda en el Laboratorio Central.
Se excluyeron del análisis las muestras contaminadas con meconio y con sangre por su interferencia con la determinación de la relación L/E.
Determinación de la relación lecitina/ esfingomielina
La determinación de la relación L/E y de la presencia de los fosfolípidos del surfactante se llevó a cabo por cromatografía unidimensional en capa delgada siguiendo el método Helena Fetal-Tek 200 (Beaumont, Texas) (10), que se basa en los principios informados por Gluck y colaboradores (6). La placa de cromatografía del método utilizado –fase sólida- es una placa de capa fina acanalada de sílica gel que tiene dos áreas superficiales diferentes: una banda de 3 cm de ancho pre-adsorbente localizada en el extremo inferior y la capa analítica de sílica gel que constituye el resto de la placa.
El Helena Fetal-Tek 200 es un método semicuantitativo que permite determinar no solo la relación L/E, sino la presencia de otros fosfolípidos que son importantes para la actividad surfactante, tales como el FG y el FI, así como de fosfatidiletanolamina y fosfatidilserina. La interpretación clínica de la presencia de éstos fosfolípidos no se ha aclarado, lo cual constituye uno de los objetivos del presente estudio.
Para la extracción de los fosfolípidos se utilizaron 3 a 4 mL de LA que se centrifugaron a 1.000 RPM durante 3 minutos y el sobrenadante se separó para el procedimiento. Los fosfolípidos se extrajeron a partir de 2 mL del sobrenadante con una mezcla de 2 mL de metanol y 2 mL de cloroformo que se agregaron en dicho orden, mezclando durante 10 a 15 segundos después de agregar el metanol y durante 20 segundos después de agregar el cloroformo. Posteriormente se centrifugó la mezcla a 3.000 RPM durante 10 minutos hasta obtener separación completa de las tres fases: metanol en la parte superior, una capa central proteínica y una capa inferior de cloroformo. Posteriormente se obtuvo 1 mL de la capa de cloroformo (capa inferior del tubo colocado a 45 grados de inclinación) que se colocó en el plato de micropreparación.
Las muestras se dejaron evaporar para secado durante aproximadamente 30 minutos, posteriormente se les agregaron 40 μL de cloroformo en el plato de micropreparación, se giraron durante 10 segundos para disolver los fosfolípidos extraídos y se aplicaron sobre una línea horizontal, marcada previamente, a través de los canales en la parte inferior de la placa de cromatografía de capa fina. Se aplicaron también los tres controles que trae el método Fetal-Tek: maduro, “borderline” e inmaduro y 40 μL del marcador Fetal- Tek 200 de comparación. Dicho marcador contiene: 0.03 mg/mL de esfingomielina (de cerebro bovino), 0.32 mg/mL de lecitina (de yema de huevo), 0.08 mg/mL de FI (de soya), 0.07 mg/mL de fosfatidiletanolamina (de yema de huevo) y 0.15 mg/mL de FG (de yema de huevo). Posteriormente se dejó secar la placa durante 4 minutos y se colocó en la cámara reveladora dejando el área pre-adsorbente hacia la parte inferior.
Los lípidos se separaron en la cámara de revelado usando un sistema solvente -fase móvil- que contiene (para dos placas): 30 mL de cloroformo, 9 mL de metanol, 25 mL de 2-propanol, 25 mL de trietilamina y 7 mL de agua des-ionizada. El sistema solvente se preparó agregando en el orden mencionado los componentes y agitando permanentemente. Se permitió la migración de los fosfolípidos durante 70 minutos al cabo de los cuales se secó la placa. Los fosfolípidos se revelaron utilizando un reactivo diluido de acetato cúprico-ácido fosfórico que contenía 3% (peso/volumen) de acetato cúprico en 8% (volumen/volumen) de ácido fosfórico, el cual se agregó por aspersión a la placa hasta que se encontrara completamente húmeda. La placa se colocó a 180 grados centígrados durante 7 a 10 minutos. Posteriormente se identificaron los fosfolípidos por comparación con el marcador aplicado previamente en el primer canal de la placa.
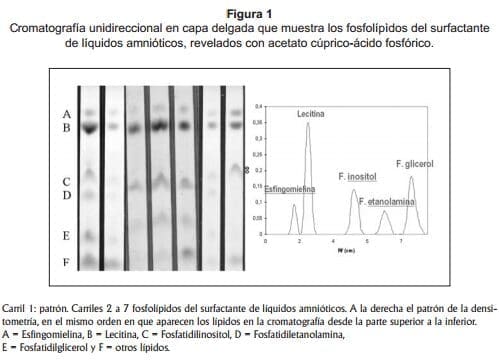
Las bandas de lecitina y esfingomielina se cuantificaron por densitometría con un filtro de 525 nm; la densitometría se hizo en el Laboratorio de Biología del Instituto Nacional de Cancerología, por amable cortesía de dicho laboratorio que facilitó el uso del equipo. Se expresó la intensidad de las dos bandas como la razón L/E. Los demás fosfolípidos se expresaron como presentes (positivos) o ausentes (negativos). La 1 ilustra en el lado izquierdo cromatografías unidireccionales en capa fina con los distintos fosfolípidos del surfactante y en el lado derecho un patrón dedensitometría de muestras obtenidas en nuestro laboratorio.
Determinación de la concentración de cuerpos lamelares
El recuento de CL se hizo en forma independiente y con cegamiento respecto a los resultados de la relación L/E. Para el recuento se tomó una alícuota de igual volumen que para la cromatografía en capa delgada. El LA se centrifugó inmediatamente en un tubo estéril a 3.000 RPM durante 10 minutos. El sobrenadante se decantó en un tubo estéril y se utilizaron 3 mL del mismo para la lectura de los CL. La muestra centrifugada se lavó con una solución electrolítica balanceada (Diluent/Sheath).
Posteriormente se colocó en un mezclador hematológico durante dos minutos; se aspiraron 120μL (modo abierto). El conteo de CLse llevó a cabo en un contador de células hematológicas CELL-DYN 3200 (Abbott, Illinois, USA) a través del canal de plaquetas. Esta canal mide el número y tamaño de partículas en un rango de 2 a 20 fL de volumen. El reactivo utilizado evita la interferencia entre los glóbulos rojos y las plaquetas, asegurando el conteo exacto por dispersión de luz LASER. La concentración de CL se informó como número/μL.

