La neuroendocrinología de la epilepsia es compleja y poco comprendida, en especial en su ciencia básica. La razón de ello es la existencia de múltiples modelos animales de epilepsia, la inherente variabilidad cíclica de las concentraciones plasmáticas de las hormonas –especialmente en las mujeres- y la interacción que existe entre las hormonas endógenas y las formuladas o exógenas. Los resultados obtenidos en un estudio sobre el efecto antiepiléptico de una hormona dada por ejemplo, pueden ser confusos por los efectos proconvulsivantes que puede tener el retiro de la misma hormona en el modelo animal elegido para esa investigación.
Por otra parte, se complica la investigación humana y animal sobre el tema porque la liberación hormonal se altera debido a las convulsiones, por los efectos de los fármacos antiepilépticos sobre los niveles hormonales y las secuelas neuroendocrinas de las convulsiones – por ejemplo la depresión- que tiene sus propios efectos sobre el hipotálamo-hipófisis-suprarrenales (26). Además, en caso de que la experimentación con animales sea realizada para apoyar el efecto “anticonvulsivo” de una hormona dada o de sus metabolitos, esto no se traduce necesariamente en un beneficio “antiepiléptico” crónico, cuando se administra en un consultorio a los pacientes. Dado que la terapia hormonal no está exenta de riesgos, hoy se trata de hacer énfasis en el diseño de análogos hormonales sintéticos que no tengan los efectos colaterales de los compuestos utilizados actualmente como AO o como TRH. La incidencia de epilepsia menstrual (catamenial) se ha calculado en el 40% (27).
La variación en el nivel hormonal durante la menopausia refleja los cambios en la frecuencia de las crisis ictales. En los Estados Unidos se ven afectadas por epilepsia entre setecientas mil y un millón doscientas mil mujeres en edad fértil. Aproximadamente el 50% de los embarazos no planificados se lleva a cabo en esta población, mientras que el 25% de los embarazos se basan en una falla de los AO (28). No hay ningún gran estudio prospectivo sobre los efectos de los AO o de la TRH sobre la frecuencia de las crisis convulsivas. Varios estudios antiguos llegaron a conclusiones opuestas sobre las consecuencias de los AO en la epilepsia (27). Una mejoría en el control de las crisis se informó en mujeres menopáusicas que recibían TRH (29).
Los datos obtenidos de animales y humanos sobre los efectos de los estrógenos en la epilepsia son controvertidos (27). Los siguientes factores contribuyen a estos datos conflictivos:
A. Las diferentes dosis de estrógenos pueden ser una explicación. Una dosis baja puede ser protectora mientras que una dosis alta puede pro-convulsivo.
B. La variabilidad en la cantidad de estrógenos endógenos y del umbral convulsivo durante el ciclo menstrual.
C. Los estrógenos tienen efectos específicos regionales, es decir, pueden ser pro-convulsivos sobre la amígdala mediana y anticonvulsivos sobre la amígdala lateral.
D. Los estrógenos ejercen una acción compleja compensatoria directa -y también una indirecta sobre los diferentes sistemas neuroquímicos cerebrales, ensombreciendo los resultados de los experimentos.
E. La utilización de diferentes modelos animales y de técnicas de investigación en epilepsia.
Los médicos están de acuerdo -en términos generales- que los estrógenos son pro-convulsivos y que la progesterona es anti-convulsiva (27, 30, 31). Los efectos benéficos de las progestinas se cree están mediados por receptores de GABA A enel hipocampo (32). Por el contrario, la suspensión enla administración de progesterona puede precipitar crisis por la disminución en la concentración de alopregnanolona, un metabolito de la progesterona con propiedades anti-convulsivas (33). La testosterona parece poseer características tanto pro-convulsivas como anti-convulsivas.
La aromatización de la testosterona conduce a la producción de estradiol, que tiene potencial epileptogénico. En cambio, la reducción de los metabolitos reducidos tipo 5-alfa testosterona (androsterona y etiocolanolona) tienen características antiepilépticas que actúan a través de receptores GABA A y por la inhibición de la excitación mediada por receptores NMDA (34, 35). El Letrozol, un inhibidor de la aromatasa que bloquea la conversión de la testosterona en estradiol, tiene propiedades anti-convulsivas a través de la normalización de la proporción testosterona/estrógenos cerebrales (36). La suspensión de la testosterona puede causar episodios convulsivos, como se puede ver en la práctica clínica.
Esto podría ocurrir por una marcada disminución de los niveles plasmáticos de metabolitos 5 alfa reducidos. De similar interés es la observación de que algunas de las propiedades antiepilépticas de la fenitoína pueden deberse a la potenciación del aumento de los receptores androgénicos en el hipocampo, mientras que disminuyen los niveles de testosterona en el hipocampo a través de la inducción de su metabolismo, un fenómeno mediado por isoformas del citocromo P450 (CYP) (37). Recordemos que las epilépticas pueden tener problemas de fertilidad debido a ciclos anovularios o a la presencia de ovarios poliquísticos (38).
No hay una neuropatología específica que pueda atribuirse a la epilepsia sensible a hormonas. Pueden estar presentes anomalías congénitas subyacentes (como una Disgenesia Cortical o una Esclerosis Mesial Temporal) que no sea directamente causadas por influencias -perinatales o del desarrollo- de las hormonas sobre el cerebro. Estas pueden actuar como focos irritativos e interactuar con las hormonas. Por el contrario, las lesiones del sistema nervioso central pueden estar asociadas a la disfunción neuroendocrina a causa de un efecto directo sobre el eje Hipotálamo- Hipófisis- Suprarrenales, o a causa de las convulsiones. La complejidad de las interacciones entre las hormonas y el cerebro se ilustran en los casos de ovarios poliquísticos y síndrome de Turner. Las convulsiones pueden ser focales o generalizadas. La epilepsia puede ser primaria (genética) o secundaria a lesiones congénitas o adquiridas. La frecuencia de las crisis estará condicionada por las diferentes fases del ciclo menstrual. Cambios simultáneos se pueden observar en la naturaleza de las auras, las manifestaciones de las convulsiones y síntomas asociados, por ejemplo la cefalea post-ictal o la depresión.
En la práctica clínica no hay necesidad de supervisar los niveles hormonales o de sus metabolitos durante el ciclo menstrual. El paciente -o su cuidadordebe llevar un diario de las convulsiones por lo menos durante varios ciclos. La convulsiones autoinformadas deben correlacionarse con el EEG para confirmar el diagnóstico, y para distinguir eventos psico-fisiológicos y verdaderas convulsiones de las convulsionesno epilépticas. Normalmente se pueden formular de manera segura AO, TRH o la terapia androgénica de suplencia reemplazo a las personas con epilepsia. Los niveles de drogas antiepilépticas deben controlarse. En las mujeres que reciben AO debe tenerse en cuenta lo siguiente:
1. Escoja el antiepiléptico más adecuado para el tipo de convulsión.
2. Si el anticonvulsivante elegido es inductor enzimático, se debe aumentar la dosis de estrógeno a por lo menos 50 microgramos en el AO, con el objetivo de evitar una falla en su efectividad.
3. Aconseje a la paciente sobre los riesgos de fracaso del anticonceptivo y de un embarazo no deseado (y sobre los efectos teratogénicos de los anti-epilépticos).
4. Se les debe prescribir a las embarazadas epilépticas un suplemento de ácido fólico (en realidad, todas las mujeres en edad fértil deben tomarlo), además de calcio y vitaminas.
Complicaciones de la Terapia Agonista de la Dopamina en Prolactinomas
La rinorrea y la otorrea provenientes del líquido céfalo-raquídeo (LCR) son complicaciones raras del tratamiento médico de los prolactinomas con bromocriptina y otros agonistas de la dopamina (DA).
Estas complicaciones normalmente se presentan en pacientes con tumores con gran extensión supraselar. La bromocriptina reduce los niveles de prolactina y disminuye el tamaño del tumor hipofisiario; los agonistas de la dopamina (neurotransmisor que actúa como inhibidor de la prolactina o PIF), son la primera línea de tratamiento de los prolactinomas (39). Según conocemos actualmente, la involución del tumor logrado por la bromocriptina puede originar una herniación del quiasma óptico en la silla turca, y un deterioro de la visión retardado (41-43). La hernia quiasmática también puede tener lugar en presencia de una silla vacía asociada a tumor (41). Chuman y colaboradores no aconsejan el uso de términos como síndrome de tracción quiasmática, síndrome de herniación quiasmática y síndromes ligados al quiasma, en la medida en que suponen patogénesis universal (40).
La rinorrea originada en el LCR después del tratamiento de tumores hipofisiarios con agonistas de la DA es, como decíamos, poco frecuente. Leona y colaboradores calcularon la incidencia de esta complicación en alrededor de 0,8%. La otorrea es aún menos frecuente, y cuando se presenta, por lo general implica la erosión de la base del cráneo (39).
La incidencia de retardo en el deterioro visual como complicación de este tratamiento de los prolactinomas, no se conoce por las siguientes razones:
1. El deterioro de la visión puede ser leve y transitorio. Por tanto, será sub-diagnosticado a menos que no practiquen campimetrías.
2. Deterioro visual puede ser secundario a un nuevo crecimiento tumoral o a hemorragia dentro del tumor.
3. No todos aceptan una fisiopatología universal que explique el deterioro visual progresivo.
Según algunos autores, el tratamiento con drogas dopaminérgicas puede tener sólo una relación periférica con la complicación visual, ya que algunos pacientes pueden presentar hernia quiasmática sin experimentar pérdida visual. Jones y colaboradores creen, sin embargo, que las complicaciones visuales del tratamiento dopaminérgico son sub-diagnosticadas (40). Basados en series cortas de casos, la incidencia de la pérdida visual en pacientes con prolactinomas tratados con fármacos dopaminérgicos fluctúa entre un 5 y un 10% (41). Los prolactinomas (macro y micro) son más frecuentes en las mujeres, y los microprolactinomas se conocen mejor como una causa tratable de la infertilidad en pacientes con galactorrea-amenorrea.
La rinorrea proveniente del LCR suele ser un signo de traumatismo craneoencefálico. También puede ser secundaria a la cirugía de senos paranasales y de la hipófisis (39). La rinorrea por LCR en los casos de prolactinomas tratados con agonistas de la DA son el resultado de la involución del tumor, y la posterior resolución de hipertensión intraselar.
La hipertensión intraselar sella las fístulas meníngeas, aunque estas originalmente son causadas por el tumor mismo, sólo que al crecer este en un espacio cerrado, la presión contra las paredes produce el sellamiento. Es más compleja la causa del deterioro visual debida al tratamiento con agentes dopaminérgicos. Como se mencionó anteriormente, los pacientes pueden mostrar cambios de neuro-radiográficos de herniación quiasmática intraselar declarada, aún en ausencia de síntomas. Por el contrario, los pacientes con retraso en la pérdida visual y sin cambios neuroradiológicos de hernia quiasmática, pueden mejorar de sus síntomas o experimentar una detención del deterioro, después de suspender la bromocriptina. Es concebible entonces, que los medicamentos dopaminérgicos sean tóxicos para las vías visuales en algunos casos. También es posible, que la hernia en algunos casos represente el efecto de la distorsión mecánica del quiasma, como consecuencia de la fibrosis intra y paraselar por la reducción tumoral inducida por el medicamento.
Por último, es posible que la pérdida visual en pacientes con prolactinomas tratados –que no muestren signos de hernia quiasmática sea debida tal vez a una “isquemia involutiva” de origen vasospástico, causada por la reducción del tamaño del tumor y el colapso de los vasos que nutren tanto el tumor como el quiasma.
En el paciente excepcional que muere por meningitis bacteriana secundaria a fístulas iatrogénicas o relacionadas con el tumor –cuando éste no se ha tratado precozmente- se encontrará un exudado inflamatorio purulento de las meninges y sobre la superficie del cerebro. La patología de las lesiones de la silla y de las regiones supraselar es diversa, varía entre adenomas pituitarios, sarcoidosis, hasta aneurismas de la arteria oftálmica (42). Identificar post-mortem las fístulas céfalo-raquídeas puede resultar imposible. La histología de los prolactinomas se define hoy con el empleo de técnicas inmuno-histoquímicas y citogenéticas sofisticadas. Los prolactinomas malignos (metastáticos) son muy raros (43).
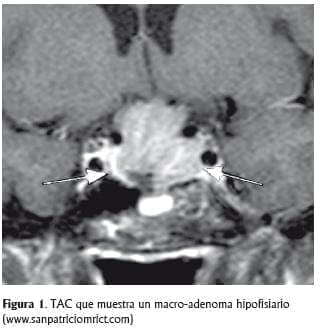 El clásico tumor de la hipófisis crece hacia arriba, comprimiendo el quiasma óptico y causando hemianopsia bitemporal (Fig.1). Otras manifestaciones incluyen dolor de cabeza, crisis parciales, atrofia del nervio óptico, papiledema, cambios pupilares, paresis de pares craneanos, rinorrea y otorrea (39-42). La pérdida visual inducida por drogas dopaminérgicas se retrasa incluso durante meses, pero es reversible después de su suspensión, a menos que un nuevo crecimiento del tumor dificulte la recuperación. En cambio, la rinorrea proveniente del LCR se desarrolla a los pocos días de iniciar el tratamiento con bromocriptina (39). La otorrea implica invasión tumoral de la base del cráneo. Una producción excesiva y sostenida de prolactina, genera hipogonadismo, amenorrea, galactorrea e infertilidad en las mujeres. En los hombres provoca pérdida de la líbido, impotencia, y excepcionalmente, galactorrea.
El clásico tumor de la hipófisis crece hacia arriba, comprimiendo el quiasma óptico y causando hemianopsia bitemporal (Fig.1). Otras manifestaciones incluyen dolor de cabeza, crisis parciales, atrofia del nervio óptico, papiledema, cambios pupilares, paresis de pares craneanos, rinorrea y otorrea (39-42). La pérdida visual inducida por drogas dopaminérgicas se retrasa incluso durante meses, pero es reversible después de su suspensión, a menos que un nuevo crecimiento del tumor dificulte la recuperación. En cambio, la rinorrea proveniente del LCR se desarrolla a los pocos días de iniciar el tratamiento con bromocriptina (39). La otorrea implica invasión tumoral de la base del cráneo. Una producción excesiva y sostenida de prolactina, genera hipogonadismo, amenorrea, galactorrea e infertilidad en las mujeres. En los hombres provoca pérdida de la líbido, impotencia, y excepcionalmente, galactorrea.
Los niveles de prolactina en sangre deben medirse en todos los pacientes con un tumor hipofisiario. Si son mayores de 200 mcg/ml en alguien con un macroadenoma de más de 10 mm de tamaño, esto es diagnóstico de prolactinoma. Una elevación aislada de la prolactinemia debe interpretarse con cautela, yaque puede deberse a problemas no tumorales, como por ejemplo, medicamentos como los neurolépticos, o incluso después de la manipulación de la glándula mamaria. Pruebas de diagnóstico adicionales son la resonancia magnética del cerebro y de la silla turca, con secciones multiplanares delgadas, examen neuro-oftalmológico y campimetría. A veces es necesario realizar –para un diagnóstico correcto tanto determinaciones de hormonas hipofisiarias en sangre como rara vez, obteniendo la muestra directamente de sangre venosa del seno petroso. Para localizar las fistulas es necesario hacer una resonancia con contraste y pruebas con isótopos radiactivos.
En macroprolactinomas está indicada una microcirugía trans-esfenoidal. El tratamiento con agonistas dopaminérgicos es eficaz en la reducción de los síntomas y para revertir la pérdida visual al reducir el tamaño del tumor. Las fístulas deben ser tratadas quirúrgicamente, a fin de evitar la meningitis bacteriana.
