Al comienzo de la Tercera Pandemia se observó una fuerte asociación entre mortalidad en humanos y presencia de ratas infectadas, concluyendo que las ratas estuvieron involucradas en la transmisión de la enfermedad.
Masanori Ogata, basado en sus experimentos, implicó a la pulga en la transmisión de la bacteria; hipótesis seguida por Paul-Louis Simond en 1898, durante la epidemia en la India, y posteriormente aceptada en 1902 gracias a los experimentos de Gauthier y Raybaud, quienes demostraron la transmisión de la enfermedad de una rata a otra por medio de la picadura de una pulga.
Especies de ratas
Hubo dos especies de ratas comensales presentes en Europa, la rata negra Rattus rattus, también llamada rata de barco o rata de techo y la rata marrón Rattus norvegicus, también llamada rata de aguas residuales. La rata negra tiene una historia en Europa que se remonta a la época medieval, pero nunca ha estado presente en grandes cantidades porque el clima en Europa es demasiado frío para poder vivir y reproducirse fuera de edificios con calefacción.
La rata marrón llegó a Europa desde Rusia durante la primera parte del siglo XVIII y abundaba en todas las ciudades europeas alrededor de 1900. Las dos especies son similares en apariencia, pero tienen un comportamiento muy diferente.
Se afirma que la rata negra es un escalador efi ciente, hace nidos en las paredes y techos de edificios, mientras que la rata marrón puede vivir al aire libre en el clima europeo, es buen nadador y hace nidos en el suelo, en bodegas o en tuberías de alcantarillado. Las dos especies de ratas “transportan” la misma especie de pulgas y son resistentes a la enfermedad.
Por su comportamiento diferente, las ratas negras viven más cerca de los humanos que las ratas marrones. Durante la Tercera Pandemia, la peste fue transportada alrededor del mundo por ratas negras en barcos, ratas que no abundaban en Europa, excepto en almacenes de puertos y en algunas ciudades.
Especies de pulgas pueden transmitir la peste
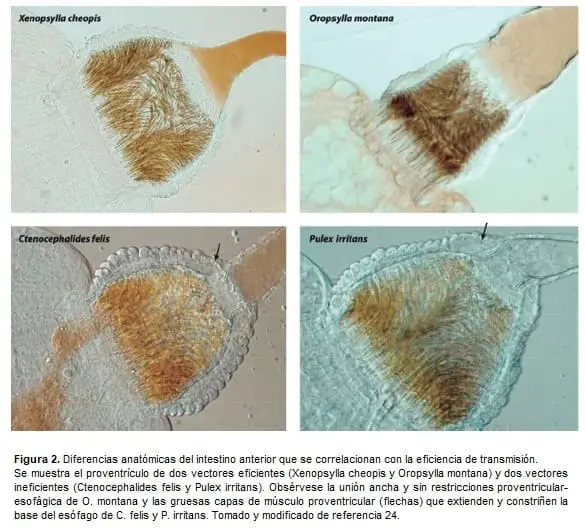
Diferentes especies de pulgas pueden transmitir la peste, como las que se encuentran comúnmente en ratas Xenopsylla cheopis vector biológico por excelencia, en gatos Ctenocephalides felis y en humanos Pulex irritans.
La Y. pestis adopta una forma de vida única en el tracto digestivo de este vector como “dispositivo” simple y neutral que la transporta como patógeno microbiano, formando una biopelícula envuelta en una sustancia polimérica extracelular compleja. La localización y adherencia de la biopelícula al intestino anterior de la pulga es esencial para su transmisión posterior a los humanos [24].
Los ectoparásitos eran tan abundantes en Europa que el Tercer Congreso Internacional sobre Higiene Escolar, celebrado en París en 1910, aconsejó luchar contra ellos, porque “uno de cada tres niños estaba infestado”.
En 1914, Charles Martín y Arthur Bacot describieron el mecanismo por el cual las bacterias, al multiplicarse en el proventrículo de la pulga – zona inmediatamente distal al esófago-, eran capaces de obstruir esta zona, impidiendo el paso del alimento (sangre) al estómago y perpetuar así pulgas hambrientas ávidas de sangre, que regurgitan microorganismos infecciosos durante la picadura.
Estos hallazgos sirvieron para que el mismo año, la Tercera Comisión India de la Peste, estableciera la importancia de la pulga tropical de la rata, Xenopsylla cheopis, en la transmisión de la enfermedad.
(Lea También: La Fiebre Amarilla: ¿De Dónde Venimos y Hacia Dónde Vamos? )
Las invasiones de alimañas en ese entonces, se asociaron con pobreza y condiciones de vida antihigiénicas (Figura 1 y Figura 2).

En los barrios más pobres de las ciudades, la mayoría de los casos fueron encontrados durante brotes como el de Oporto (1899), Glasgow (1900) y Marsella (1900 – 1921). Scheube a principios del siglo XX escribió: “El desarrollo y la propagación de la peste están influenciados en gran medida por las condiciones higiénicas desfavorables, esencialmente relacionadas con la miseria social” [48,49].
Hoy en pleno siglo XXI, la peste causa casos esporádicos e incluso algunos brotes anuales. Suramérica en la década del 2001 a 2011 fue uno de los territorios afectados durante la Tercera Pandemia de peste desatada en Hong Kong.
Países como Ecuador, Brasil, Bolivia y Perú, son regiones donde aún prevalece la enfermedad con brotes o casos esporádicos, cuyo posible origen reside en condiciones socioeconómicas adversas, convivencia con roedores y factores climáticos desfavorables.
En Colombia existen datos históricos sobre una “neumonía infecciosa” de alta mortalidad, que se presentó en los mismos meses durante tres años consecutivos (1913 a 1915) en los departamentos de Magdalena, Atlántico y Bolívar de la Costa Atlántica; este tipo de neumonía hizo pensar en la peste, sin que se hubiera podido demostrar con exactitud el agente infeccioso [50].
Conclusión
Las epidemias, pestes y pandemias durante la evolución natural del Planeta Tierra, nos mantienen alerta en el día a día de nuestro calendario vital y nos ponen de manifiesto la fragilidad de la vida humana, permitiéndonos recordar -sin ningún asomo de sutileza- que somos parte fundamental del equilibrio del Todo pero no el Todo.
Referencias
-
1. Cui Y, Yu C, Yan Y, Li D, Li Y, Jombart T, et al. Historical variations in mutation rate in an epidemic pathogen, Yersinia pestis. Proceedings of the National Academy of Sciences of the United States of America. 2013; 110(2):577–82. Epub 2012/12/29. 10.1073/pnas.1205750110.
-
2. Morelli G, Song Y, Mazzoni CJ, Eppinger M, Roumagnac P, Wagner DM, et al. Yersinia pestis genome sequencing identifies patterns of global phylogenetic diversity. Nat Genet. 2010; 42(12):1140– 3. Epub 2010/11/03. 10.1038/ ng.705 [pii] 10.1038/ng.705.
-
3. Wagner DM, Klunk J, Harbeck M, Devault A, Waglechner N, Sahl JW, et al. Yersinia pestis and the Plague of Justinian 541–543 AD: a genomic analysis. The Lancet In-fectious diseases. 2014; 14(4):319– 26. 10.1016/S1473- 3099(13)70323-2.
-
4. Perry RD, Fetherston JD. Yersinia pestis-etiologic agent of plague. Clin Microbiol Rev. 1997; 10(1):35–66. Epub 1997/01/01.
-
5. Raoult D, Mouffok N, Bitam I, Piarroux R, Drancourt M. 2013. Plague: history and contemporary analysis. J. Infect. 66, 18–26. (10.1016/j.jinf.2012.09.010).
-
6. Whittles LK, Didelot X. Epidemiological analysis of the Eyam plague outbreak of 1665– 1666. 2016. Proc. R. Soc. B 283, 20160618 (10.1098/rspb.2016.0618).
-
7. Xavier Didelot, Lilith K. Whittles, and Ian Hall. Model-based analysis of an outbreak of bubonic plague in Cairo in 1801. J R Soc Interface. 2017 Jun; 14(131): 20170160. PMCID: PMC5493801 Published online 2017 Jun 21. Doi: 10.1098/rsif.2017.0160 PMID: 28637916.
-
8. Rotz LD, Khan AS, Lillibridge SR, Ostroff SM, Hughes JM. Public health assessment of potential biological terrorism agents. Emerg Infect Dis. 2002; 8(2):225–30. Epub 2002/03/19. 10.3201/eid0802.010164.
-
9. Slack P. Plague: a very short introduction. Oxford, UK: Oxford University Press 2012. ISBN: 9780199589548.
-
10. Devaux CA. Small oversights that led to the Great Plague of Marseille (1720–1723): lessons from the past. Infect. Genet. Evol. 14, 169–185. (10.1016/j.mee-gid.2012.11.016). 2013.
-
11. Cummins N, Kelly M, Ó Gráda C. Living standards and plague in London, 1560–1665. Econ. Hist. Rev. 69, 3–34. (10.1111/ehr.12098). 2016.
-
12. Pryor EG. The great plague of Hong Kong. J. Hong Kong Branch R. Asiat. Soc. 1975; 15, 61–70.
-
13. Butler T. Plague history: Yersin’s discovery of the causative bacterium in 1894 enabled, in the subsequent century, scientific progress in understanding the disease and the development of treatments and vaccines. Clin. Microbiol. Infect. 20, 202–209. (10.1111/1469-0691.12540) 2014.
-
14. WHO. Plague-Madagascar, Disease outbreak news. 2017, http://www.who.int/csr/don/09-january-2017-plague-mdg/en/.
-
15. Dos Santos Grácio AJ, Grácio MA. Plague: A Millenary Infectious Disease Reemerging in the XXI Century. Biomed Res Int. 2017(33):1-8. Published online 2017 Aug 20. doi: 10.1155/2017/5696542.
-
16. Bertherat E. Plague around the world, 2010–2015. Wkly Epidemiol Rec. 2016; 91:89–104.
-
17. Respicio-Kingry LB, Yockey BM, Acayo S, Kaggwa J, Apangu T, Kugeler KJ, et al. Two distinct Yersinia pestis populations causing plague among humans in the West Nile region of Uganda. PLoS Negl Trop Dis. 2016; 10:e0004360.
-
18. Shi L, Yang G, Zhang Z, Xia L, Liang Y, Tan H, et al. Re-emergence of human plague in Yunnan, China in 2016. PLoS ONE. 2018; 13:e0198067.
-
19. Abedi AA, Shako J-C, Gaudart J, Sudre B, Ilunga BK, Sha- mamba SKB, et al. Ecologic features of plague outbreak areas, Democratic Republic of the Congo, 2004– 2014. Emerg Infect Dis. 2018; 24:210-20.
-
20. Andrianaivoarimanana V, Piola P, Wagner DM, Rakotomanana F, Maheriniaina V, Andrianalimanana S, et al. Trends of human plague, Madagascar, 1998–2016. Emerg Infect Dis. 2019; 25:220-8.
-
21. McNally A, Thomson NR, Reuter S, Wren BW. ‘Add, stir and reduce’: Yersinia spp. as model bacteria for pathogen evolution. Nat Rev Micro. 2016; 14:177-90.
-
22. Christian E. Demeure, Olivier Dussurget Guillem Mas Fiol, Anne-Sophie Le Guern, Cyril Savin, Javier Pizarro- Cerdá Yersinia pestis and plague: an updated view on evolution, virulence determinants, immune subversion, vaccination, and diagnostics. Genes and Immunity 2019; 20:357-370 https://doi.org/10.1038/s41435-019-0065-0.
-
23. Spinner JL, Winfree S, Starr T, Shannon JG, Nair V, Steele- Mortimer O, et al. Yersinia pestis survival and replication within human neutrophil phagosomes and uptake of infected neutrophils by macrophages. J Leukoc Biol. 2014; 95:389–98.
-
24. Hinnebusch BJ, Jarrett CO, Bland DM. ‘Fleaing’ the plague: adaptations of Yersinia pestisto its insect vector that lead to transmission. Annu Rev Microbiol. 2017; 71:215– 32.
-
25. Shannon JG, Hasenkrug AM, Dorward DW, Nair V, Carmody AB, Hinnebusch BJ. Yersinia pestis subverts the dermal neutrophil response in a mouse model of bubonic plague. MBio. 2013; 4:e00170-13-e00170-13.
-
26. Pujol C, Klein KA, Romanov GA, Palmer LE, Cirota C, Zhao Z, et al. Yersinia pestis can reside in autophagosomes and avoid xenophagy in murine macrophages by preventing vacuole acidification. Infect Immun. 2009; 77:2251–61.
-
27. Connor MG, Pulsifer AR, Price CT, Abu Kwaik Y, Lawrenz MB. Yersinia pestis requires host Rab1b for survival in macrophages. PLoS Pathog. 2015; 11:e1005241.
-
28. Connor MG, Pulsifer AR, Chung D, Rouchka EC, Ceresa BK, Lawrenz MB. Yersinia pestis targets the host endoso me recycling pathway during the biogenesis of the Yersinia-containing vacuole to avoid killing by macrophages. MBio. 2018;9:e01800-17
-
29. Merritt PM, Nero T, Bohman L, Felek S, Krukonis ES, Marketon MM. Yersinia pestis targets neutrophils via complement receptor 3. Cell Microbiol. 2014; 17:666-87.
-
30. Derbise A, Pierre F, Merchez M, Pradel E, Laouami S, Ricard I, et al. Inheritance of the lysozyme inhibitor Ivy was an important evolutionary step by Yersinia pestis to avoid the host innate immune response. J Infect Dis. 2013; 207:1535-43.
-
31. Reboul A, Lemaître N, Titecat M, Merchez M, Deloison G, Ricard I, et al. Yersinia pestis requires the 2-component regulatory system OmpR-EnvZ to resist innate immunity during the early and late stages of plague. J Infect Dis. 2014; 210:1367-75.
-
32. Arifuzzaman M, Ang WXG, Choi HW, Nilles ML, St John AL, Abraham SN. Necroptosis of infiltrated macrophages drives Yersinia pestis dispersal within buboes. JCI Insight. 2018; 3:35.
-
33. St. John AL, Ang WXG, Huang M-N, Kunder CA, Chan EW, Gunn MD, et al. S1P-dependent trafficking of intracellular Yersinia pestis through lymph nodes establishes buboes and systemic infection. Immunity. 2014; 41:440-50.
-
34. Littman DR, Rudensky AY. Th17 and regulatory T cells in mediating and restraining inflammation. Cell. 2010; 140:845-58.
-
35. Bi Y, Zhou J, Yang H, Wang X, Zhang X, Wang Q, et al. IL- 17A produced by neutrophils protects against pneumonic plague through orchestrating IFN-γ-activated macrophage programming. J Immunol. 2014; 192:704-13.
-
36. Lin JS, Kummer LW, Szaba FM, Smiley ST. IL-17 contributes to cell-mediated defense against pulmonary Yersinia pestis infection. J Immunol. 2011; 186:1675-84.
-
37. Comer JE, Sturdevant DE, Carmody AB, Virtaneva K, Gardner D, Long D, Rosenke R, Porcella SF, Hinnebusch BJ. 2010. Transcriptomic and innate immune responses to Yersinia pestis in the lymph node during bubonic plague. Infect. Immun. 78:5086-5098.
-
38. Sebbane F, Gardner D, Long D, Gowen BB, Hinnebusch BJ. 2005. Kinetics of disease progression and host response in a rat model of bubonic plague. Am. J. Pathol. 166:1427-1439.
-
39. Pechous RD, Sivaraman V, Price PA, Stasulli NM, Goldman WE. Early host cell targets of Yersinia pestis during primary pneumonic plague. PLoS Pathog. 2013; 9:e1003679.
-
40. Peters KN, Dhariwala MO, Hughes Hanks JM, Brown CR, Anderson DM. Early apoptosis of macrophages modulated by injection of Yersinia pestis YopK promotes progression of primary pneumonic plague. PLoS Pathog. 2013; 9:e1003324.
-
41. Stasulli NM, Eichelberger KR, Price PA, Pechous RD, Montgomery SA, Parker JS, et al. Spatially distinct neutrophil responses within the inflammatory lesions of pneumonic plague. MBio. 2015; 6:e01530-15.
-
42. WHO. How to safely collect sputum samples from patients suspected to be infected with pneumonic plague. 2016. Technical Guidance. www.who.int/csr/disease/plague/en.
-
43. Tourdjman M, Ibraheem M, Brett M, DeBess E, Progulske B, Ettestad P, et al. Misidentification of Yersinia pestis by automated systems, resulting in delayed diagnoses of human plague infections Oregon and New Mexico, 2010– 2011. Clin Infect Dis. 2012; 55:e58–e60.
-
44. Morelli G, et al. Yersinia pestis genome sequencing identifies patterns of global phylogenetic diversity. Nat Genet 2010; 42:1140–1143.
-
45. Achtman M, et al. Yersinia pestis, the cause of plague, is a recently emerged clone of Yersinia pseudotuberculosis. Proc Natl Acad Sci USA. 1999; 96:14043-14048.
-
46. Lei Xu, Leif C. Stige, Herwig Leirs, Simon Neerinckx, Kenneth L. Gage, Ruifu Yang, Qiyong Liu, Barbara Bramanti, Katharine R. Dean, Hui Tang, Zhe Sun, Nils Chr. Stenseth, and Zhibin Zhang. Historical and genomic data reveal the influencing factors on global transmission velocity of plague during the Third Pandemic. Proc Natl Acad Sci USA. 2019 Jun 11; 116(24): 11833-11838.
-
47. Bramanti B, Dean KR, Walløe L, Chr. Stenseth N. 2019 The Third Plague Pandemic in Europe. Proc. R. Soc. B 286: 20182429. http://dx.doi.org/10.1098/rspb.2018.2429.
-
48. Pollitzer R. Division of Epidemiology, World Health Organization. Plague Studies. A Summary of the History and a Survey of the Present Distribution of the Disease. Bull. Org. mond. Santé. Bull. World Hlth Org. 1951; 4:475-533.
-
49. Scheube B. The diseases of warm countries: A handbook for medical men. London, UK: Bale & Danielsson. 1908.
-
50. Faccini-Martínez A, Sotomayor HA. Reseña histórica de la peste en Suramérica: una enfermedad poco conocida en Colombia. Biomédica. 2013; 33(1): 8-27. https://doi.org/10.7705/biomedica.v33i1.814.
Recibido: 26 de mayo de 2020
Aceptado: 15 de junio de 2020
Correspondencia:
María Claudia Ortega López
mcol19@yahoo.com






