Vectores
La causa más aceptada en relación con la Plaga de Justiniano, es la de las ratas y pulgas como vectores, pero existe muy poca evidencia de ello. Algunos detractores de esta teoría, se basan en las observaciones de la pandemia de Glasgow en 1900 y la de Bombay a principios del siglo XX, en las que se observó un bajo número de ratas y una proporción muy baja de ratas infectadas y no infectadas. Los estudiosos de la Peste Negra han propuesto dos modelos alternativos, que podrían ajustarse a la Plaga de Justiniano, pero que, debido a la falta de evidencia de la antigüedad tardía, no es posible demostrar (16).
La primera alternativa:
Asocia las pandemias con la peste neumónica, y resalta la falta de evidencia textual y arqueológica acerca de la existencia de ratas como reservorio. Plantea la hipótesis de que los brotes en humanos se vuelven rápidamente neumónicos, lo que permite que se infecten entre sí de forma directa. La peste neumónica es atractiva para explicar las pandemias históricas, debido a sus características principales, como su rápida progresión (la muerte se produce 1-3 días después del inicio de los primeros síntomas) y su tasa de mortalidad (cerca del 100%). Los opositores al modelo de peste neumónica, señalan que hay poca evidencia histórica de brotes importantes de este tipo (16,17).
La segunda teoría:
Acepta que la peste era principalmente bubónica, pero en lugar de ratas y pulgas, afirma que los huéspedes y los vectores eran respectivamente humanos y ectoparásitos humanos (pulgas y piojos humanos). Si bien, esta es una explicación atractiva, ya que supera la falta de evidencia para el modelo de ratas y pulgas, no proporciona ninguna evidencia confirmada. Los opositores de este modelo, señalan que las pulgas humanas parecen ser vectores ineficientes de la peste (16).
En estudios realizados en asentamientos de la época romana, en diferentes sitios arqueológicos, se han identificado piojos (Pediculus humanus capitis, Pediculus humanus corporis, Phthirus pubis), pulgas (Pulex irritans) y chinches (Cimex lectularius), conservados en peines, textiles, tumbas y suelos anegados. De acuerdo con algunos investigadores, es muy probable que estos ectoparásitos fueron transmisores y propagadores de enfermedades infecciosas, como la Plaga de Justiniano (11,18).
La mayor mortalidad ocurrida en relación con el primer brote de la peste, puede deberse al hecho de haber sido un evento inesperado y desconocido. Las personas de mediados del siglo VI, no tenían experiencia inmunológica previa con Y. pestis. Sin embargo, algunos historiadores argumentan que la peste existía desde siglos atrás, en toda la región del sudeste del Mediterráneo. Al mismo tiempo, los biólogos evolucionistas han demostrado que Y. pestis, se dispersó ampliamente en el oeste de Eurasia, más de mil años antes del inicio de la Plaga de Justiniano. De ser cierto, esto podría significar que la peste era endémica o enzoótica en el mundo occidental de Eurasia (16).
Cambios Climáticos
El cambio climático se ha planteado como un factor causal, relacionado con el desarrollo de las pestes a lo largo de la historia de la humanidad. Con respecto a la Plaga de Justiniano, estos cambios solo tenían algún soporte histórico, hasta que investigadores alemanes, realizaron estudios paleo-climáticos basados en el análisis de los anillos de los árboles de la época y de sedimentos de lagos, lo que demostró su relación con una serie de erupciones volcánicas ocurridas entre los años 530 y 540.
Las erupciones causaron una transformación completa del clima en el hemisferio norte, período de enfriamiento denominado como “la pequeña edad de hielo”, en la que ocurrieron fenómenos como una grave crisis agrícola, mayor susceptibilidad a las enfermedades y mayor mortalidad epidémica (16). Otros investigadores definen este periodo como el “invierno volcánico”, ocurrido entre los años 535 y 536, en el que ocurrió un clima extremo, causado por la erupción de diversos volcanes, situados incluso en Centroamérica (2).
Es probable que la Plaga de Justiniano, e incluso la aparición de las tres pandemias de peste, hayan estado estrechamente relacionadas con la inestabilidad climática, pues todas fueron precedidas por períodos de lluvias excesivas, y terminaron durante períodos de estabilidad climática. Para el caso de la Plaga de Justiniano entre los años 700 y 1000 (19,20).
Agente Causal
El descubrimiento del agente causal de la peste bubónica, fue realizado de forma simultánea por el médico y bacteriólogo japonés Kitasato Shibasaburo, y por el también médico y bacteriólogo franco-suizo Alexander Yersin, al investigar la epidemia de peste de Hong Kong en 1894. En honor a este último investigador, desde 1970 se empezó a denominar la bacteria como Yersinia pestis (4, 21,22).
Después del aislamiento de Yersinia pestis, por estos dos investigadores, en la etapa inicial de la tercera pandemia, nadie dudó que fuera el agente causal de la peste de Hong Kong, pero los debates sobre los agentes biológicos que causaron las dos primeras pandemias persistieron por años (23,24) hasta que, en la actualidad, un número cada vez mayor de estudios de ADN antiguos, han demostrado que el agente causal de las dos primeras pandemias fue la Yersinia pestis (25).
La peste es una enfermedad zoonótica causada por Yersinia pestis (Figura 3), una bacteria cocobacilo gramnegativa, no móvil y no formadora de esporas.
El género Yersinia es un miembro de la familia Enterobacteriaceae, que incluye 11 especies, de las cuales Y. pestis, Y. pseudotuberculosis y Y. enterocolitica son patógenos humanos. Las pulgas, particularmente Xenopsylla spp, son el principal vector, pero durante los períodos epizoóticos también se pueden transmitir por otras especies de pulgas, piojos y artrópodos hematófagos como las garrapatas. Los mamíferos y roedores que sobreviven a la infección inicial, se convierten en los reservorios naturales de la enfermedad (26).
Se cree que la bacteria causante de las tres grandes pandemias:
Se originó en la antigua Unión Soviética, Asia Central, y de allí se extendió a todo el mundo. Según algunos investigadores, la cepa de la Plaga de Justiniano, fue el antepasado directo de las asociadas con la segunda y tercera pandemia. La pandemia de la Peste Negra fue el resultado de una variedad de Y. pestis de roedores, que se extendió a Europa y África, y probablemente regresó a China, y además, el agente causal resurgió como una nueva cepa que causó los brotes de peste que siguieron (27). La tercera pandemia de peste, probablemente comenzó en la provincia china de Yunnan (28), se extendió a Hong Kong y luego estableció nuevos focos en roedores de Asia, África y América del Norte, lo que dio lugar a una cepa aún existente de la bacteria (3).
En la investigación de la peste, han existido dos líneas divergentes de estudio: por un lado, están los especialistas en enfermedades infecciosas, con gran experiencia en el diagnóstico mediante el análisis de la Proteína C Reactiva (PCR), usada ampliamente en el mundo como método actual de diagnóstico de enfermedades infecciosas y, por otro lado, los científicos que analizan el ácido desoxirribonucleico (ADN) humano antiguo. Esta profunda diferencia en dos campos científicos con poco en común, dificultó inicialmente el estudio de la peste, según diversos autores (4).
En algunos estudios, se ha encontrado una concentración de ADN de Y. pestis amplificable más alta en los dientes (37%) que en los huesos (5,7%) (29), por lo que muchos investigadores han utilizado la pulpa dental como una muestra adecuada para basar sus estudios y diagnósticos.
La pulpa dental, es un tejido muy vascularizado que puede albergar restos de Y. pestis en casos de septicemia y peste mortal (4). Su estudio, desde diversos grupos de investigadores con experiencia en diagnóstico molecular, permitió: recuperar a partir de 1998 fragmentos de genomas; en 2011, genomas completos de Y. pestis en restos de nueve individuos de la época de la peste negra (4,30,31); en 2014, en dos individuos hallados en sitios de entierro contemporáneos a la Plaga de Justiniano (3); y en 2015, de siete genomas de varios sitios de entierro en Eurasia que datan del 3000 a.C. (32,33).
Las técnicas de laboratorio han evolucionado, así como la secuenciación de PCR, junto con la detección adicional de secuencias de ADN específicas por inmuno-PCR y las secuenciaciones con enriquecimiento del ADN, lo que ha favorecido, en gran medida, la realización de estos estudios (4).
La cepa de la Plaga de Justiniano, es distinta de las asociadas con las pandemias de peste humana posteriores, por lo que algunos investigadores consideran que Y, pestis, ha surgido de reservorios de roedores en diferentes momentos de la historia y ha causado las pandemias conocidas por muchos. Los componentes genómicos de la cepa relacionada con la Plaga de Justiniano, combinados con los factores ambientales y del huésped, pudieron haber contribuido a la alta mortalidad de hasta el 40% descrita en los textos históricos (3,34).
Mediante análisis genómico, se ha demostrado que las cepas de Y. pestis:
Involucradas en la Plaga de Justiniano, corresponden a una rama de la filogenia que no tiene representantes contemporáneos conocidos, y se considera que con muy poca probabilidad, pueda existir en reservorios de roedores salvajes, sin haber sido encontrada aún. Pero, muy seguramente, como lo menciona la hipótesis del “Callejón sin salida”, esta cepa desapareció debido a la escasez de hospedadores susceptibles en un contexto de inmunidad poblacional generalizada, o a un clima cambiante que perturbó la transmisión causada por los vectores. Sin embargo, la verdadera explicación de su extinción sigue siendo un misterio (8, 27,28).
La Peste Actual
La peste es una enfermedad que aún existe. En los últimos años se han informado pequeños brotes en India, Vietnam, Brasil, Perú y en Estados Unidos, pero hasta el 90% de los casos informados, corresponden a África oriental, central y Madagascar (35). Tras el análisis de estos brotes, diversos investigadores han identificado las características clínicas en relación con esta plaga.
La peste, debe sospecharse ante la presencia de adenitis manifestada como un bubón doloroso, rojo y no fluctuante, o de neumonía (las formas severas pueden ocurrir sin la aparición de bubones), en pacientes que residan en áreas endémicas. La Y. pestis puede sobrevivir y multiplicarse en los macrófagos de los bubones, los cuales pueden drenarse de forma espontánea como una adenitis supurativa.
Tras la invasión de los ganglios linfáticos, el bacilo puede causar bacteriemia y síntomas sistémicos como hipotensión, fiebre alta y un rápido deterioro clínico, lo que no ocurre en las adenitis de otra etiología. Al picar a un paciente infectado, las pulgas o piojos pueden infectarse y transmitir la bacteria a otras personas. El compromiso simultáneo de varios pacientes, debe hacer pensar en el probable surgimiento de un brote de peste (35).
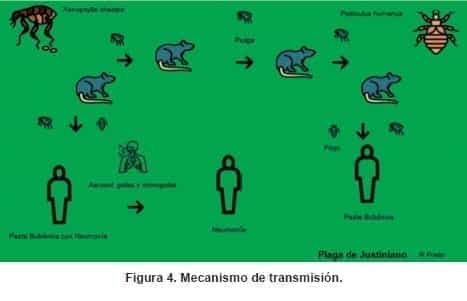
Mecanismo de Transmisión
Además de la picadura de pulga (Figura 4), se han documentado rutas de transmisión de la enfermedad a partir de inhalación de aerosoles de animales como gatos o perros infectados, así como de la manipulación o inhalación de aerosoles de cadáveres de personas o animales contaminados, o de muestras en laboratorios de investigación. También se han informado casos relacionados con la ingesta de carne o hígado de camello contaminado (35-38).
Manifestaciones Clínicas
Clínicamente, los pacientes pueden presentar, disnea, escalofríos, decaimiento y, en estados avanzados, tos, dolor torácico y hemoptisis; también se han documentado casos con presencia de síntomas similares a los causados por infecciones del tracto urinario o gastrointestinal. Al examen físico, se puede encontrar tensión arterial baja, fiebre alta, presencia de los típicos bubones, además de lesiones cutáneas como, escoriaciones, pústulas o escaras (35, 39,40).
Cuando el paciente presenta neumonía sin manifestaciones bubónicas, el diagnóstico se hace más difícil, y hasta un 10 a 20% de los casos pueden asociarse a falla orgánica múltiple, con una mortalidad de hasta el 33%, que puede deberse a la falta de diagnóstico, a la rápida evolución de la enfermedad y a falta del tratamiento, situación en la que la mortalidad puede ser hasta del 50% (41,42).
Estudios Clínicos
El hemograma es el examen que muestra las principales alteraciones, dadas por leucocitosis en la mayoría de los pacientes, con un recuento celular de hasta 20.000/mm3 en por lo menos la mitad de los casos. Paradójicamente, se encuentra trombocitopenia en por lo menos el 50% de los pacientes, pero la asociación de leucocitosis y trombocitopenia es rara y su hallazgo es un gran indicador de la presencia de la enfermedad. Durante la convalecencia, se puede observar eosinofilia en muchos pacientes. Salvo en los casos de neumonía, la radiografía de tórax no es de ayuda (33,35).
(Lea También: La Peste Negra: El Enemigo Incorpóreo)
Diagnóstico
La presencia de fiebre, después del contacto con roedores muertos en zonas endémicas o incluso donde se cree que la peste ha desaparecido, así como adenitis de causa no clara con fiebre e hipotensión y de neumonía con hemoptisis, deben hacer sospechar, en alto grado, la presencia de la enfermedad (35).
La bacteria se puede identificar de manera fácil, mediante la coloración de Giemsa en el frotis de material obtenido por punción o aspirado del bubón, su hallazgo debe llevar de forma inmediata al tratamiento. La identificación de bacterias gramnegativas, en el estudio del esputo con sangre de los pacientes con neumonía adquirida en la comunidad, especialmente si se asocia a las alteraciones hematológicas descritas, permiten el diagnóstico inmediato (43). La PCR, los métodos microbiológicos estándar, las pruebas de inmunodetección y el análisis del ADNr 16S en biopsias de ganglios linfáticos, pueden ser de utilidad (44-46).
Tratamiento
Para tener un mejor pronóstico, el tratamiento debe iniciarse lo antes posible, el medicamento más recomendado es la estreptomicina a dosis de 1 a 4 gr/día, teniendo mucha precaución con sus manifestaciones de toxicidad. De forma alternativa, se puede emplear la gentamicina a 3 mg/kg/día, o la doxiciclina con una dosis inicial de 200 mg/día, seguida de 100 mg/12 horas, este medicamento se recomienda además de forma profiláctica, en casos de sospecha de exposición a mecanismos de transmisión. Se ha empleado el trimetoprim/sulfametoxazol con menos eficacia y, de forma experimental, la ciprofloxacina (35,47-51).
Consideraciones finales
La Plaga de Justiniano, es una de las tres grandes pandemias causada por la bacteria gramnegativa Yersinia pestis. La revisión de textos como la biblia (libro de Samuel, capítulo 5, versículo 6-9), pasando por los libros de diversos historiadores, contemporáneos o no de Justiniano, y llegando a la revisión de la literatura científica actual, en la que se presentan estudios arqueológicos, paleo-antropológicos, genómicos y otros de diversa índole científica, permite considerar que la peste es una enfermedad tan antigua como la misma humanidad y que aún está presente en varios países de América, África y Asia.
Después de revisar la información relacionada con este manuscrito, se debe poner especial atención en las similitudes encontradas entre la época de la Plaga y la nuestra. Los cambios climáticos han precedido los brotes, como si la tierra estuviera reclamando aquello que en nuestra época el hombre ha alterado, el equilibrio medioambiental del planeta.
La aparición de la peste, ocurrió en momentos de resplandor de la civilización, en que los afanes formaban parte de la cotidianidad de la sociedad, la que cambió, para vivir de una manera más pausada después de haber logrado sobrevivir. Los médicos de la época, como muchas personas, enfermaron y murieron y en diversos sitios los cementerios no dieron abasto.
La humanidad, que frecuentemente se cree poseedora del conocimiento y de la vida, de repente se ha dado cuenta, como ocurrió en esa época, que no lo sabe todo, que falta mucho por descubrir y que cuando la naturaleza quiere cobrar su ofrenda en vidas, por lo menos en un principio, no se tiene cómo evitarlo. La estabilidad económica de esa época, dependía -como ahora-, de la clase obrera y de los campesinos, que además del trabajo aportaban el dinero de los impuestos.
Hace quince siglos, Procopio escribió:
“Incluso aquellos que antes se entregaban a acciones bajas y malvadas abandonaron, en la vida diaria, toda maldad para dedicarse con todo cuidado a la piedad, no porque hubieran aprendido sabiduría de repente ni porque se hubieran vuelto de repente amantes de la virtud, ya que todo lo que en los hombres está establecido por naturaleza o por una larga práctica es imposible que cambie tan fácilmente, a menos que sea por inspiración de Dios, sino porque, entonces, por decirlo así, todos estaban asustados por lo que pasaba, convencidos de que morirían de un momento a otro y, evidentemente, la necesidad imperiosa les hacía aprender en un instante lo que era la honradez.
Lo cierto es que, en cuanto se vieron libres de la enfermedad y se pensaron que ya estaban salvados y seguros porque que la plaga se había trasladado a otras regiones, volvieron a experimentar un cambio inmediato de voluntad hacia peor y, más aún que antes, dieron muestras de la volubilidad del comportamiento y se superaron a sí mismos en maldad y en cualquier otro tipo de delito”.
Permítanme soñar que, después de tanto tiempo, la humanidad ha cambiado tan solo un poquito y que, por lo menos en esto, no no pareceremos a los seres de aquella época.
Conflicto de interés
El autor declara no tener ningún conflicto de interés.
Agradecimientos
A Jordina Sales-Carbonell (IRCVM-Universitat de Barcelona), arqueóloga e historiadora, por su generosidad y apoyo bibliográfico. Correo electrónico: jordinasales@ub.edu
Referencias
-
1.Meier M. The “Justinianic Plague”: the economic consequences of the pandemic in the eastern Roman Empire and its cultural and religious effects. Early Medieval Europe [Internet]. 2016 Aug [cited 2020 Apr 2]. 2016;24:267
-
2. Dress A. Why, so far, have epidemics always eventually petered out? Quasispecies theory suggests a (testable!) answer. Eur Biophys J. 2018; 47:427-442. https://doi.org/10.1007/s00249-018-1306-2.
-
3. Wagner DM, Klunk J, Harbeck M, Devault A, Waglechner N, Sahl JW, et al. Yersinia pestis and the plague of Justinian 541–543 AD: a genomic analysis. Lancet Infect Dis. 2014; 14:319-26. https://doi.org/10.1016/S1473-3099 (13)70323-2.
-
4. Drancourt M, Raoult D. Molecular history of plague. Clin Microbiol Infect. 2016; 22:911-915. https://doi.org/10.1016/j.cmi.2016.08.031.
-
5. Harbeck M, Seifert L, Hansch S, Wagner DM, Birdsell D, Parise KL, et al. Yersinia pestis DNA from skeletal remains from the 6th century ad reveals insights into Justinianic plague. PLoS Pathog. 2013; 9:e1003349.
-
6. Cui Y, Song Y. Genome and Evolution of Yersinia pestis. Adv Exp Med Biol. 2016; 918:171-192.
-
7. Gage KL, Kosoy MY. Natural history of plague: perspectives from more than a century of research. Annu Rev Entomol. 2005; 50:505–28.
-
8. Little LK, ed. Plague and the end of antiquity: the pandemic of 541–750. Cambridge: Cambridge University Press, 2007.
-
9. Justiniano I. Fecha de consulta: 20 de abril de 2020. Disponible en: https://es.wikipedia.org/wiki/Justiniano_I
-
10. Sabbatani S, Manfredi R, Fiorino S. [The Justinian plague (part one)]. Infez Med. 2012; 20:125-39. PubMed PMID: 22767313.
-
11. 18. Mitchell PD. Human parasites in the Roman World: health consequences of conquering an empire. Parasitology. 2017; 144:48-58. https://doi.org/10.1017/S0031182015001651.
-
12. Mardones C. Medicina cristiana en los primeros siglos del imperio bizantino. Revista Electrónica Historias del Orbis Terrarum 2011(6). Fecha de consulta: 25 de abril de 2020. Disponible en: https://historiasdelorbisterrarum.files.wordpress.com/2011/05/06-camila-mardones-bizancio.pdf
-
13. Procopio de Cesarea, Sobre las guerras, libro II, capítulos 22-23 (traducción de Montserrat Camps Gaset disponible en: https://epidemiesedatmitjana.wordpress.com/2020/04/03/procopi-historia-de-les-guerres-ii-22-23/
-
14. Plaga de Justiniano. Fecha de consulta: 25 de abril de 2020. Disponible en: https://es.wikipedia.org/wiki/Plaga_de_Justiniano
-
15. Biraben J-N. Les hommes et la peste en France et dans les pays européens et méditerranéens. In: It. La Peste dans l’Histoire. Mouton. 1976 Paris-Le Haye.
-
16. Eisenberg M, Mordechai L. The Justinianic Plague: an interdisciplinary review. Byzantine & Modern Greek Studies [Internet]. 2019; 43:156.
-
17. Cohn S. The Black Death: End of a paradigm. American Historical Review. 2002; 107:703-38.
-
18. Bobrov AG, Kirillina O, Vadyvaloo V, Koestler BJ, Hinz AK, Mack D, et al. The Yersinia pestis HmsCDE regulatory system is essential for blockage of the oriental rat flea (Xenopsylla cheopis), a classic plague vector. Environmental Microbiology. 2015; 17:947-959.
-
19. Buntgen U, Tegel W, Nicolussi K, McCormick M, Frank D, Trouet V, et al. 2500 years of European climate variability and human susceptibility. Science. 2011; 331:578- 82. https://doi.org/10.1126/science.1197175.
-
20. Gage KL, Burkot TR, Eisen RJ, Hayes EB. Climate and vectorborne diseases. Am J Prevent Med. 2008; 35:436-50.
-
21. Yersin A. La peste bubonique à Hong Kong. Ann Inst Pasteur. 1894; 8:662-7.
-
22. Kitasato S. The bacillus of bubonic plague. Lancet. 1894;144(3704):428-30. https://doi.org/10.1016/s0140-6736(01)58670-5.
-
23. Altschuler EL, Kariuki YM. Was the Justinian Plague caused by the 1918 u virus? Med Hypotheses. 2009; 72:234.
-
24. Zietz BP, Dunkelberg H. The history of the plague and the research on the causative agent Yersinia pestis. Int J Hyg Environ Health. 2004; 207:165-78.
-
25. Tran TN, Signoli M, Fozzati L, Aboudharam G, Raoult D, Drancourt M. High throughput, multiplexed pathogen detection authenticates plague waves in medieval Venice, Italy. PLoS One. 2011; 6:e16735.
-
26. Nyirenda SS, Hang Ombe BM, Simulundu E, Mulenga E, Moonga L, Machang′u RS, et al. Molecular epidemiological investigations of plague in Eastern Province of Zambia. BMC Microbiol. 2018; 18:2. https://doi.org/10.1186/s12866-017-1146-8.
-
27. Cui Y, Yu C, Yan Y, Li D, Li Y, Jombart T, et al. Historical variations in mutation rate in an epidemic pathogen, Yersinia pestis. Proc Natl Acad Sci. 2013; 110:577-82.
-
28. Pollitzer R. Plague studies-a summary of history and a survey of the present distribution of the disease. Bull World Health Organ. 1951; 4:475-533.
-
29. Schuenemann VJ, Bos K, DeWitte S, Schmedes S, Jamieson J, Mittnik A, et al. Targeted enrichment of ancient pathogens yielding the pPCP1 plasmid of Yersinia pestis from victims of the Black Death. Proc Natl Acad Sci. 2011; 108:E746-52.
-
30. Bos KI, Schuenemann VJ, Golding GB, Burbano HA, Waglechner N, Coombes BK, et al. A draft genome of Yersinia pestis from victims of the Black Death. Nature. 2011;478:506-10.
-
31. Bos KI, Herbig A, Sahl J, Waglechner N, Fourment M, Forrest SA, et al. Eigh- teenth century Yersinia pestis genomes reveal the long-term persistence of an historical plague focus. Elife 2016;5:e12994.
-
32. Rasmussen S, Allentoft ME, Nielsen K, Orlando L, Sikora M, Sjogren KG, et al. Early divergent strains of Yersinia pestis in Eurasia 5,000 years ago. Cell. 2015; 163:571-82.
-
33. Nelson-Sathi S, Martin WF. The origin of a killer revealed by Bronze Age Yersinia genomes. Cell Host Microbe. 2015; 18:513-4.
-
34. Perry RD, Fetherston JD. Yersinia pestis– etiologic agent of plague. Clin Microbiol Rev. 1997; 10:35-66.
-
35. Raoult D, Mouffok N, Bitam I, Piarroux R, Drancourt M. Plague: history and contemporary analysis. J Infect. 2013; 66:18-26. https://doi.org/10.1016/j.jinf.2012.09.010.
-
36. Wong D, Wild MA, Walburger MA, Higgins CL, Callahan M, Czarnecki LA, et al. Primary pneumonic plague contracted from a mountain lion carcass. Clin Infect Dis. 2009; 49:33-8.
-
37. Wang H, Cui Y, Wang Z, Wang X, Guo Z, Yan Y, et al. A dog- associated primary pneumonic plague in Qinghai Province, China. Clin Infect Dis. 2011; 52:185-90.
-
38. Weniger BG, Warren AJ, Forseth V, Shipps GW, Creelman T, Gorton J, et al. Human bubonic plague transmitted by a domestic cat scratch. JAMA. 1984; 251:927-8.
-
39. Crook LD, Tempest B. Plague. A clinical review of 27 cases. Arch Intern Med. 1992; 152:1253-6.
-
40. Campbell GL, Hughes JM. Plague in India: a new warning from an old nemesis. Ann Intern Med. 1995; 122:151-3.
-
41. Butler T. Plague into the 21st century. Clin Infect Dis. 2009; 49:736-42.
-
42. Inglesby TV, Henderson DA, O’Toole T, Dennis DT. Safety pre- cautions to limit exposure from plague-infected patients. JAMA. 2000; 284:1648-9.
-
43. Rolain JM, Lepidi H, Zanaret M, Triglia JM, Michel G, Thomas PA, et al. Lymph node biopsy specimens and diagnosis of cat-scratch disease. Emerg Infect Dis. 2006; 12:1338-44.
-
44. Loiez C, Herwegh S, Wallet F, Armand S, Guinet F, Courcol RJ. Detection of Yersinia pestis in sputum by real-time PCR. J Clin Microbiol. 2003; 41:4873-5.
-
45. Ayyadurai S, Flaudrops C, Raoult D, Drancourt M. Rapid identification and typing of Yersinia pestis and other Yersinia species by matrix-assisted laser desorption/ionization time-of-flight (MALDI-TOF) mass spectrometry. BMC Microbiol. 2010; 10:285.
-
46. Bertherat E, Thullier P, Shako JC, England K, Kone ML, Arntzen L, et al. Lessons learned about pneumonic plague diagnosis from two outbreaks, Democratic Republic of the Congo. Emerg Infect Dis. 2011; 17:778-84.
-
47. Inglesby TV, Henderson DA, O’Toole T, Dennis DT. Safety pre- cautions to limit exposure from plague-infected patients. JAMA. 2000; 284:1648-9.
-
48. Mwengee W, Butler T, Mgema S, Mhina G, Almasi Y, Bradley C, et al. Treatment of plague with gentamicin or doxycycline in a randomized clinical trial in Tanzania. Clin Infect Dis. 2006; 42:614-21.
-
49. Peterson JW, Moen ST, Healy D, Pawlik JE, Taormina J, Hardcastle J, et al. Protection afforded by fluoroquinolones in animal models of respiratory infections with bacillus anthracis, Yersinia pestis, and Francisella tularensis. Open Microbiol J. 2010; 4:34-46.
-
50. Kuberski T, Robinson L, Schurgin A. A case of plague success- fully treated with ciprofloxacin and sympathetic blockade for treatment of gangrene. Clin Infect Dis. 2003;36:521-3.
-
51. Nguyen VA, Nguyen DH, Pham VD, Nguyen VL. Letter: co- trimoxazole in bubonic plague. Br Med J. 1973;4:108-9
Recibido: 12 de mayo de 2020
Aceptado: 12 de junio de 2020
Correspondencia:
Prieto RG.
rgprietoo@hotmail.com






