El 88% de los pacientes fue atendido en centro hospitalario de tercer nivel, el 7%, del segundo nivel y el 5%, de forma particular.
Los datos de síntomas neurológicos muestran que la cefalea registró el 38,5% y las convulsiones, 28,5%, y constituyeron los motivos de consulta más frecuentes para el ingreso de los pacientes en el estudio epidemiológico. Del total del grupo muestral, 108 pacientes no presentaron crisis epilépticas. Se realizaron TAC y RMN como técnicas de imagen como se señala en la Tabla 2. (Lea también: Articulo de investigación, Epidemiología de la Cisticercosis Humana en pacientes de consulta neurológica en Popayán, Cauca, Colombia)
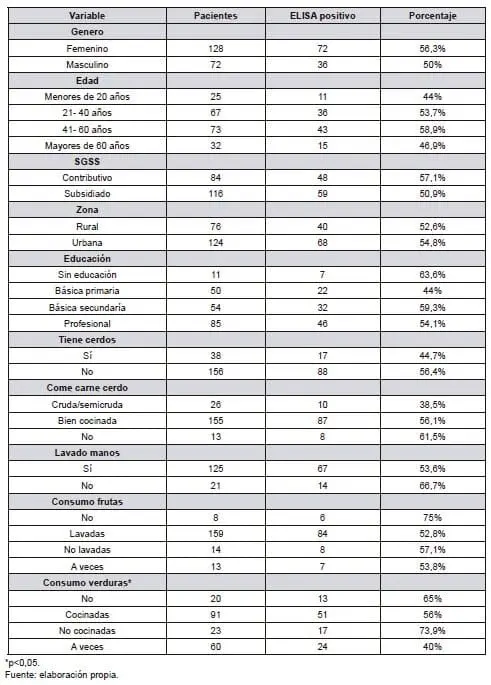
Tabla 2. Seropositividad de los anticuerpos anticisticerco en pacientes sintomáticos neurológicos en el Cauca de acuerdo con los hallazgos clínicos.

Seroprevalencia
La técnica ELISA permitió determinar la presencia de anticuerpos anticisticercos en los pacientes evaluados, fue positiva para 108 pacientes (54%) y, negativa para 92 (46%). Del total de pacientes positivos, el 56,3% pertenecían al género femenino (72/128) y el 50%, al masculino (36/72).
El mayor valor de positividad se observó en el rango de edad de 21 a 40 años, donde se desarrolla la actividad económica. También se observó una relación estadísticamente significativa con el consumo de verduras preparadas inadecuadamente (ver Tabla 1).
La Tabla 2 presenta el motivo de consulta, los tipos de crisis, las técnicas imagenológicas y la impresión diagnóstica, pero ninguna representó significancia estadística.
Discusión
De acuerdo con la Organización Mundial de la Salud (OMS), el complejo T/C constituye una infección zoonótica y hace parte de las 17 enfermedades tropicales desatendidas. Se estima que 2´500.000 de personas se encuentran infectadas, con el doble de individuos desarrollando el parásito a nivel tisular y anualmente se presentan 50.000 muertes asociadas con esta parasitosis (4, 7- 8).
Una de las formas más graves de esta parasitosis se presenta cuando el cisticerco se localiza en el SNC causando la NCC y se vincula en un 30% a un 60% con la epilepsia que se observa en las zonas endémicas.
La aparición clínica de la NCC es polimórfica y se presenta tanto en pacientes asintomáticos como en algunos con síntomas de: cefalea de aparición súbita durante la edad productiva, convulsiones, disminución de la capacidad visual, confusión mental, ataxia y, en casos extremos, parálisis y muerte del paciente (1, 2, 4, 6, 7).
En concordancia con lo anterior, la investigación realizada estableció que 108 (54%) pacientes sintomáticos neurológicos reportaron la presencia de anticuerpos anti-cisticercos, empleando como prueba diagnóstica el ELISA con la fracción de 53kDa.
La positividad en el estudio se relacionó estadísticamente con el consumo de verduras, así como ha se demostrado en diferentes investigaciones previas. De modo que, la inadecuada manipulación e higiene de los alimentos y aguas no tratadas expone potencialmente a adquirir el complejo T/C (10, 14- 19, 21- 24).
La prevalencia encontrada en este estudio constituye una de las más altas informadas para Colombia hasta el momento. En efecto, de acuerdo con las publicaciones existentes en el país, la prevalencia oscila entre 2%- 35,8% (10- 19) en la población general y los pacientes con epilepsia.
Sin embargo, en el 2003, se realizó un estudio en cuatro hospitales municipales de primer nivel de atención del Cauca (Piendamó, Bolívar, Mercaderes y La Vega) y se estableció que de 433 personas, el 55% resultaron seropositivas utilizando la misma fracción antigénica e igual metodología (28).
Aparentemente, las condiciones no han variado en el departamento del Cauca y siguen prevaleciendo las condiciones ecoepidemiológicas que favorecen la persistencia de la enfermedad parasitaria desde el control, la vigilancia y la intervención hallándose nuevamente valores serológicos porcentuales similares a los de once años atrás, cabe aclarar que éstos se reportan en diferentes niveles de atención.
El hallazgo tiene un registro mayor al presentado en otros países del cono sur como Perú, quienes realizaron un estudio en pacientes internados en centros hospitalarios y determinaron, mediante la prueba de Electro Inmuno Transferencia en Blot (EITB), una seropositividad del 18% (29) siendo este valor similar al encontrado en países africanos donde la seropositividad varió entre el 3,2% y el 46,7% (30).
Por su parte, los estudios en Colombia han arrojado porcentajes de prevalencias del 23% y el 35% para anticuerpos anti-cisticercos en pacientes con epilepsia (14- 19). En Perú, diferentes estudios realizados han asociado la neurocisticercosis con la crisis convulsiva de aparición tardía, una de las varias manifestaciones de epilepsia, reportando valores del 12% al 40% en pacientes epilépticos (31- 32). La seroprevalencia referida para México es la más elevada reportada para el complejo T/C en pacientes epilépticos, 50% (50/100) (33).
Por otra parte, la seropositividad para este estudio no demostró diferencias estadísticamente significativas entre géneros, pero sí se identificó que el grupo etáreo más afectado es el comprendido entre 21 y 60 años de edad, etapa de mayor productividad del ser humano, que al presentar esta patología podría conllevar la incapacidad para ejecutar las labores diarias similar a la observada en estudios mexicanos y peruanos (21- 24, 29).
Se comparte la importancia del uso de los criterios de Del Brutto, sin embargo, en Colombia, se presentan dificultades con el sistema de seguridad social y se han identificado algunas entidades prestadoras de salud que autorizan o no las técnicas de imagenología o serología ocasionando mora en la atención al paciente (34- 35).
LIMITACIONES DEL ESTUDIO
El estudio fue realizado únicamente en pacientes que acudieron a consulta neurológica en centros hospitalarios de segundo y tercer nivel de atención, por tal razón el hallazgo de esta seroprevalencia no es extrapolable a la población general.
La encuesta estructurada implementada en la investigación buscó determinar los factores de asociación, generando dependencia de la memoria retrospectiva de los pacientes que en algunas ocasiones puede carecer de precisión o que prefieren omitir información relevante.
CONCLUSIONES
Las técnicas serológicas conforman herramientas valiosas para apoyar el diagnóstico clínico y para determinar la epidemiología en zonas donde no se conocen informaciones relevantes sobre este complejo parasitario (36- 37). En concordancia con los resultados encontrados en el departamento del Cauca, es necesario seguir las recomendaciones de la OMS y de diversos autores, en aspectos como:
- Declarar este complejo parasitario como un problema de salud pública que requiere de gestión política para que se agilice su registro obligatorio.
- Ampliar las investigaciones para conocer el verdadero impacto en el departamento del Cauca y lograr así determinar el perfil epidemiológico.
- Contemplar acciones para el control y la erradicación de esta parasitosis (38).
No obstante, el complejo T/C no es referido con este nombre dentro de la política institucional (Plan Decenal de Salud Pública 2012- 2021) (39) hecho que puede dificultar las acciones a realizar. Como se trata de una zoonosis desatendida, podría ser abordada desde los municipios o departamentos endémicos identificados en el país (10- 19).
Valdría la pena tener en cuenta las recomendaciones sugeridas en la reunión de expertos realizada por la OMS en Bogotá en el año 2015 donde se insta la ejecución de una serie de actividades desde el Programa Nacional de Zoonosis y las entidades departamentales que, junto con la investigación, pueden contribuir a disminuir y a controlar la parasitosis causada por T. solium a futuro (40).
CONFLICTO DE INTERESES
Los autores manifiestan no presentar conflictos de intereses con respecto a los resultados obtenidos esta investigación.
FINANCIACIÓN
El proyecto de investigación fue financiado por la Vicerrectoría de Investigaciones de la Universidad del Cauca, código ID 4060 y se aunaron esfuerzos con El Hospital Universitario San José de Popayán, Cauca; la Clínica La Estancia; la Liga Colombiana contra la Epilepsia, capítulo del Cauca y el Grupo de investigación en Parasitología y Microbiología Tropical de la Universidad INCCA de Colombia.
AGRADECIMIENTOS
A la Vicerrectoría de Investigaciones de la Universidad del Cauca y a los pacientes que se vincularon al estudio.
Referencias
1. Flisser A, Sarti E, Lightowlers M, Schahtz P. Neuro¬cysticercosis: regional status epidemiology, impact and control measures in the Americans. Acta Trop. 2003 Jun; 87 (1): 43- 51. http://dx.doi.org/10.1016/ S0001-706X(03)00054-8
2. García HH, González AE, Evans CAW, Gilman RH, Cysticercosis Working Group in Peru. Taenia solium cisticercosis. Lancet. 2003 Ago; 362 (9383): 547- 56. http://dx.doi.org/10.1016/S0140-6736(03)14117-7
3. Del Brutto OH, García HH. Taenia solium Cysticerco¬sis-The lessons of history. J Neurological Sciences. 2015 Dic; 359 (1-2): 392- 5. http://dx.doi.org/10.1016/j. jns.2015.08.011
4. Welburn SC, Beange I, Ducrotoy MJ, Okello AL. The neglected zoonoses −the case for integrated control and advocacy. Clin Microbiol Infect. 2015 May; 21 (5): 433- 443. http://dx.doi.org/10.1016/j.cmi.2015.04.011
5. Hotez PJ, Bottazzi ME, Franco-Paredes C, Ault SK, Periago MR. The Neglected Tropical Diseases of Latin America and the Caribbean: A Review of Disease Burden and Distribution and a Roadmap for Control and Elimination. PLoS Negl Trop Dis. 2008 Sep; 2 (9): e300. http://dx.doi.org/10.1371/journal. pntd.0000300
6. White AC Jr. Neurocysticercosis: updates on epide¬miology, pathogenesis, diagnosis, and management. Annu Rev Med. 2000 Feb; 51: 187- 206. http://dx.doi. org/10.1146/annurev.med.51.1.187
7. World Health Organization. Preventable epilep¬sy: Taenia solium infection burdens economies, societies and individuals: a rationale for inves¬tment and action. 1ra Ed. Génova: WHO. 2016. Disponible en: http://apps.who.int/iris/bitstre am/10665/204716/1/9789241549486_eng.pdf
8. World Health Organization. Taenia Solium Tae¬niasis/cysticercosis diagnostic tools. Report of a stakeholder meeting, Geneva, 17- 18 December 2015. 1ra Ed. Génova: WHO y UNICEF. 2015. Disponible en: http://apps.who.int/iris/bitstre am/10665/206543/1/9789241510516_eng.pdf?ua=1
9. Schantz. PM, Cruz M, Sarti E, Pawlowski Z. Potential erradicability of taeniasis and cysticercosis. 1993; 27 (4): 397- 403.
10. Flórez AC, Pastrán SM, Vargas NE, Beltrán M, En¬riquez Y, Peña AP, et al. Cisticercosis en Colombia. Estudio de seroprevalencia 2008- 2010. Acta Neurol Colomb. 2013 Jun; 29 (2): 73- 86.
11. Pradilla G, Ramírez G, Cabrales CC, Vega BE, Jaramillo LF, Sanabria Cl, et al. Neurocisticercosis en el oriente de Colombia. Experiencia de 17 años (1981- 1998). Salud UIS. 1998; 27 (1): 27- 31.
12. Pradilla G, Pardo CA, Méndez LE, Zafra CI, Res¬trepo JA, Blanco S. Estudio Neuroepidemiológico en la comunidad del Hato Santander. Medicas UIS. 1991; 4: 181- 87.
13. Ramírez G, Pradilla G, Rodríguez M, González C. Cisticercosis: estudio de 80 casos. Acta Médica Col. 1986 Abr; 11 (2): 62- 73.
14. Agudelo PM, Palacio LG. Prevalencia de anticuerpos para Taenia solium en habitantes y cerdos de Ituango, Antioquia 1998. Rev Epidemiología de Antioquia. 1999; 24 (1-2): 75- 95.
15. Bonelo A, Carvajal H. Cisticercosis en pacientes con cuadro neurológico en Cali. Biomédica. 1992; 17 (5): 388- 394.
16. Sanzón F, Morales MB, Delgado BL, Martínez C. Prevalencia de anticuerpos contra cisticercosis en pacientes epilépticos. Colombia Médica. 1991; 22 (3): 98- 101.
17. Palacios LG, Jiménez C, García HH, Jiménez ME, Sánchez JC, Noh J, et al. Neurocysticercosis in Persons with Epilepsy in Medellín, Colombia. The Neuroepidemiological Research Group of Antioquia. Epilepsia. 1998 Dic; 39 (12): 1334- 9.
18. Sanzón F, Osorio AM, Morales JP, Isaza R, Cardo¬na E, Moncayo LC, et al. Serological screening for cysticercosis in mentally altered individuals. Trop Med Int Health. 2002 Jun; 7 (6): 532- 8.
19. Franco CA, Giraldo JC, Vásquez LR. Detección de anticuerpos anticisticerco en pacientes que asistieron a consulta médica durante el periodo 2009- 2010 a la Liga Contra la Epilepsia Capítulo Cauca. Revista científica, UNINCCA. 2013 Jun; 18 (1): 79- 93. Disponible en: https://www.unincca.edu.co/images/ stories/pfd/revista-cientifica-v18-1.pdf
20. Giraldo JC, Medina G, Vásquez R, Zamora T. Valo¬ración de la inmunodominancia de cuatro fracciones proteicas (61, 50, 55, 53 kDA) obtenidas a partir de un extracto crudo de metacestodo de T. solium con sueros humanos. Rev Asociación Colombiana de Ciencias Biológicas. 2003; 15 (2): 67.
21. Aranda-Álvarez JG, Tapia R, Alcantara A, Meza A, Mata O, Celis E, et al. Human Cysticercosis: risk factors associated with circulating serum antigens in an open community of San Luis Potosí, México. Ann. Trop. Med. Parasitol. 1995 Dic; 89 (6): 689- 92.
22. Sarti E, Schantz PM, Plancarte A, Wilson M, Gutiérrez IO, López AS, et al. Prevalence and risk factors for Taenia solium taeniosis & cisticercosis in humans and pigs in village Morelos, México. Am J Trop Med Hyg. 1992 Jun; 46 (6): 677- 85.
23. Sarti E, Schantz PM, Plancarte A, Wilson M, Gutiérrez IO, Aguilera J, et al. Epidemiological investigation of Taenia solium taeniosis & cisticercosis in rural village of Michoacán state Mexico. Trans R Soc Trop Med Hyg. 1994 Feb; 88 (1): 49- 52.
24. García HH, Araoz R, Gilman RH, Valdez J, González AE, Gavidia C, et al. Increased prevalence of cys¬ticercosis and taeniosis among professional fried pork vendors and general population of a village in the peruvian highlands. Am J Trop Med Hyg. 1998 Dic; 59 (6): 902- 5.
25. Bachiller NM, Girardo JC, Piragauta MA. Estanda¬rización de una prueba inmunodiagnóstica ELISA para la detección de anticuerpos humanos contra el metacéstodo de T. solium, en extracto crudo y fracciones proteicas de 53Kda. [Tesis de grado]. Bogotá (Colombia): Universidad INCCA; 2001.
26. Giraldo JC. Valoración de la inmunológica con sue¬ros de porcinos delos polipéptidos 64, 53 y 32 kDA del metacéstodo Taenia solium porcinos. [Tesis de maestría]. Bogotá (Colombia): Universidad de los Andes, 1999.
27. Giraldo JC, Marinkelle CJ, Piragauta MA, Castañeda H, Burgos J. Valoración de la inmunodominancia de tres fracciones proteicas (64, 53 y 32 kDA) obtenidas a partir de un extracto crudo del metacéstodo de Taenia solium con sueros porcinos. Revista científica UNINCCA. 2000; 6 (1): 19- 34.
28. Torres H MF, Vásquez-A LR, González C FE, Vergara C D, Alvarado LL BE, Giraldo JC, et al. Cisticercosis en el departamento del Cauca, 2003. Biomédica. 2005; 25 (supl. 1): 186- 7.
29. García HH, Gilman RH, Tovar M A, Flórez E, Jo R, Tsang VC, et al. Factors associated with Taenia solium Cysticercosis: analysis of nine hundred forty six peruvian neurologic patients. Am J Trop Med Hyg. 1995 Feb; 52 (2): 145- 8.
30. Phiri I K, Ngowi H, Alonso S, Matenga E, Boa M, Mukaratirwa S, et al. The emergence of Taenia so-lium cysticercosis in Eastern and Southern Africa as a serious agricultural public and public health risk. Acta Trop. 2003 Jun; 87 (1): 13- 23.
31. García HH, Gilman R, Martínez M, Tsang V, Pilcher JB, Herrera G, et al. Cysticercosis as a major cause of epilepsy in Peru. Lancet. 1993 Ene; 341 (8839): 197- 200.
32. Moyano LM, Saito M, Montano SM, González G, Olaya S, Ayvar V, et al. Neurocysticercosis as a Cause of Epilepsy and Seizures in Two Community- Based Studies in a Cysticercosis-Endemic Region in Peru. PLoS Negl Trop Dis. 2014 Feb; 8 (2): e2692. DOI:10.1371/journal.pntd.0002692
33. Pal DK, Carpio A, Sander JW. Neurocysticercosis and epilepsy in developing countries. J Neurol Neurosurg Psychiatry. 2002; 68 (2): 137- 43.
34. Del Brutto OH, Rajshekhar V, White AC Jr, Tsang VCW, Nash TE, Takayanaqui OM, et al. Proposed diagnostic criteria for neurocisticercosis. Neurology. 2001 Jul; 57: 177- 83.
35. Kumar R. Diagnostic criteria for neurocysticercosis: Some modifications are needed for Indian patients. Neurology India. 2004 Jun, 52 (2): 171- 7.
36. Díaz SC, Candil AR, Uribe MB, Willms K. Serology as an indicator of Taenia solium infections in a rural community in Mexico. Trans R Soc Trop Med Hyg. 1990 Ago; 84 (4): 563- 6.
37. Dorny P, Brandt J, Zoli A, Geerts S. Immunodiagnostic tools for human and porcine cysticercosis. Acta Trop. 2003 Jun; 87 (1): 79- 86.
38. Roman G, Sotelo J, Del Brutto O, Flisser A, Dumas M, Wadia N, et al. A proposal to declare neurocysti¬cercosis an international reportable diseases. Bulletin WHO. 2000 Mar; 78 (3): 399- 406.
39. Ministerio de Salud y Protección Social. Plan Decenal de Salud Pública 2012-2021: La salud en Colombia la construyes tú; 2015.
40. Organización Panamericana de la Salud. Organiza¬ción Mundial de la Salud. Informe Primera Reunión Regional sobre control de Taenia solium en América Latina; 2015.
Recibido: 25 de noviembre de 2016.
Aceptado: 9 de diciembre de 2016.
Correspondencia:
Luis Reinel Vásquez Arteaga
lreinel@unicauca.edu.co

