Este método es ideal para evaluar todos los márgenes quirúrgicos de corte, con el cual los dermatólogos se han familiarizado más que los patólogos generales, en razón a que no se han introducido estas técnicas en los programas de residencia.
Con está técnica, tanto los márgenes laterales como los profundos de cada segmento quirúrgico son evaluados en una sección de corte patológico. El tejido a evaluar con este método debe haber sido cortado por el cirujano, inclinando el bisturí 450 aproximadamente en el plano cutáneo, de tal forma que la epidermis permanezca sobre el mismo nivel del tejido subcutáneo para ser cortado horizontalmente con el micrótomo.
Los cortes que son examinados antes de cortarlos y teñirlos para el examen histológico, son seccionados en subunidades con el fin de crear segmentos o secciones de apropiado tamaño para ser montadas en las bases de congelación del críostato y las láminas histológicas.
De esta forma, se constituyen segmentos horizontales en donde los márgenes laterales y profundos se encuentran en el mismo plano. Estas consideraciones son críticas en la producción de un espécimen microscópico con márgenes completos de corte.
El método de Mohs implica congelamiento de los segmentos y los problemas de interpretación son los mismos de la evaluación de corte por congelación, tales como dificultades en lograr bajas temperaturas en el micrótomo optimizando la calidad de los cortes, cortes incompletos especialmente en el tejido adiposo, cortes gruesos y detalles celulares alargados.
El grado de esas dificultades e impedimentos depende del conocimiento y experiencia de los técnicos involucrados en el equipo de patología. Muy a pesar de estas limitaciones, el método de sección de Mohs alcanza tasas de curación entre el 95% y 99%, superando ampliamente las tasas de curación ofrecidas por otras técnicas.(1-7).
Desde que en 1941 el método fue introducido por Frederic Mohs y a partir de 1970 cuando la técnica fue establecida, se han creado varias modificaciones de la misma. Sin embargo, esas modificaciones no son sustitutas del verdadero método de Mohs y ni a los médicos, ni a los pacientes se les debe distraer su atención indicándoles que esos métodos son equivalentes (9).
Una de las erróneas modificaciones a la técnica de Mohs es enviar la pieza quirúrgica al laboratorio de patología para evaluación convencional por congelación, mientras el paciente y el cirujano esperan en la sala quirúrgica, creyendo falsamente el cirujano que tal proceso es el mismo que el realizado por el método de Mohs, cuando en realidad los patólogos usan cortes en cruz sobre las secciones de congelación rutinarias.
No obstante, como anteriormente se mencionó, los cortes en cruz no evalúan la totalidad de los márgenes quirúrgicos. En un estudio de 100 casos de carcinoma basocelular y escamocelular resecados por dermatólogos usando escisiones de rasurado delgado y examinado por patólogos, se encontró que estos no acertaron en hallar o descartar tumor en el 19% de los casos.
Esos estudios sugieren que los cortes por congelación son mejor interpretados por personas con más experiencias en ese método, bien sean cirujanos de Mohs o patólogos (10).
La realización de la técnica de congelación de cortes quirúrgicos periféricos y cortes horizontales a través de la base de la pieza quirúrgica, no es sustituta de la técnica de Mohs. Este método requiere buena comunicación y estrecha cooperación entre el cirujano y el patólogo.
Debe darse especial atención a la orientación del tejido, teniendo en cuenta que el cirujano y el patólogo son diferentes personas, a diferencia de la verdadera cirugía de Mohs. Los principales problemas con los cortes periféricos, son la limitación en el tamaño de la pieza quirúrgica y el número de secciones por congelación requeridas, además de la dificultad en el proceso del margen horizontal profundo por la abundancia de tejido graso.
Por donde se mire, el desgaste que produce el diseño de una versión modificada de la auténtica técnica de Mohs, no se espera que duplique la evaluación completa de los márgenes quirúrgicos que causan el método de Mohs. (Vea también: Artículo de Revisión: Cirugía micrográfica de Mohs)
Interpretación
La interpretación del informe histopatológico es parte integral de la atención del paciente, de tal forma que el cirujano debe determinar qué paciente ha sido tratado adecuadamente o si requiere otra terapia complementaria.
La lectura crítica del informe de patología, conclusivo de márgenes negativos o libres de tumor, debe ser observada objetivamente interrogando con cautela las siguientes afirmaciones en la evaluación de todos los márgenes quirúrgicos: ¿Cuál método de evaluación patológica de márgenes ha sido empleado?, densidad del infiltrado inflamatorio que puede ocultar el tumor, desgarros o fragmentaciones de la pieza quirúrgica y orientación de la pieza quirúrgica.
Todas las anteriores inquietudes indican posibles causas de márgenes falsos negativos que conducen a la recurrencia tumoral.
Contrariamente, un informe de márgenes patológicos con compromiso tumoral, implica la persistencia de tumor residual en el margen patológico del tejido resecado; sin embargo, las células tumorales detectadas microscópicamente pueden no estar en el lado externo de la pieza quirúrgica y el paciente realmente debe estar libre de tumor.
Un margen falso positivo puede también haber sido producido cuando la pieza quirúrgica haya sido procesada y el corte patológico ha sido efectuado muy grueso, al interior del bloque, lejano al verdadero corte del margen quirúrgico el cual podría ser negativo de células tumorales.
Este escenario aporta una posible explicación de márgenes negativos con la técnica de congelación en la evaluación intraoperatoria y hallazgos de márgenes positivos comparados con los cortes de parafina cuando son evaluados posteriormente.
El uso de términos poco lacónicos por los patólogos en los informes puede crear un dilema. El empleo de frases como se observa la presencia de células tumorales cerca al margen es relativo y hay poco consenso sobre su definición entre los patólogos, especialmente cuando se utilizan objetivos microscópicos de diferente poder y si el patólogo define la distancia microscópica empleando un objetivo de alto poder o se orienta comparando con el diámetro de las células vecinas.
Tampoco existe uniformidad en la dirección de las acciones cuando un cirujano recibe el reporte informando que el tumor es detectado cerca de los márgenes.
En un estudio sobre recurrencias se demostró que estas eran tres veces más frecuentes cuando los márgenes fueron pequeños que cuando fueron positivos; aunque el autor no pudo explicar convincentemente esta discrepancia, esos hallazgos pueden reflejar la tendencia de los cirujanos a realizar rescisiones cuando los márgenes son positivos y no intervenir cuando son “cerca a los márgenes” (1).
Un punto importante a tratar es que la positividad de los márgenes por sí solos no traslada una absoluta recurrencia. Importantes estudios demuestran que las recurrencias ocurren en cerca de un tercio de los carcinomas basocelulares incompletamente resecados; la tasa de recurrencias del carcinoma escamocelular incompletamente extirpado es alta (9).
Varias hipótesis especulan sobre por qué los pacientes con márgenes positivos no experimentan recurrencias, estas incluyen: respuesta inmune local, reacción inflamatoria, crecimiento tumoral lento y artificios de fijación (9).
Un grupo de investigadores concluyó que el tipo histopatológico de carcinoma basocelular es predictor de recurrencias en pacientes con márgenes positivos, como son: carcinoma basocelular morfeiforme, micronodular, basoescamoso, infiltrante.
Se concluyó que las recurrencias ocurrieron durante los cinco años de seguimiento en el 93% de los pacientes con márgenes positivos y proyecciones tumorales que histológicamente contienen una gran cantidad de “irregularidades” en empalizada periférica; sin embargo, cuando esas irregularidades son mínimas no ocurren recurrencias (9).
Los resultados de ese estudio sugieren que el tipo histopatológico ayuda a predecir la probabilidad de recurrencias del carcinoma basocelular cuando el reporte de patología informa que los márgenes son positivos (9).
En la atención del paciente con cáncer de la piel, el cirujano y el patólogo deben trabajar como un equipo y entender la importancia del papel de cada uno. Si el clínico conoce cómo el espécimen fue correctamente orientado, cómo el tejido fue cortado, fijado, seccionado por el micrótomo y posteriormente teñido, puede sacar ventaja de los hallazgos histológicos y entender cómo las posibles alteraciones de las preparaciones pueden afectar esos hallazgos.
Desde esta perspectiva, un clínico puede derivar una inteligente interpretación del reporte de patología y elegir el mejor tratamiento para su paciente.
Conceptos técnicos
Hoy en día la técnica por congelación es la más empleada. En un reciente censo, el 72% de los cirujanos usan la técnica micrográfica de Mohs por congelación exclusivamente, el resto usa la técnica de fijación in situ en el tratamiento de menos del 5% de los pacientes (2-6).
La elección de la técnica de fijación in situ es seleccionada en algunas circunstancias como la hemostasia. Con la técnica de fijación in situ pueden ofrecerse ventajas para el tratamiento de tumores vasculares y tumores originados en áreas vasculares.
Esta técnica también es empleada en el tratamiento de osteomielitis y en tumores que invaden el hueso. La equivalente alta tasa de curación que resulta de ambos métodos, se deriva del común denominador de superior control de los márgenes quirúrgicos, más que de la fijación in situ.
Técnica de fijación por congelación (figuras 1– 9)
1. Después de tener el consentimiento informado, el paciente es preparado asépticamente para la intervención. El área a ser resecada es delimitada usando un lápiz dermográfico o violeta de genciana delineando los márgenes clínicos del tumor y el margen quirúrgico periférico.
El área se anestesia localmente, el anestésico más empleado es la lidocaina al 2% o 1% con o sin epinefrina al 1 x 200.000 (si está, o no indicado el uso de la epinefrina para lograr una mejor vasoconstricción), ya que la infiltración anestésica distorsiona los márgenes quirúrgicos y las área anatómicas, es preferible delimitar el margen oncológico como antes se mencionó.
El empleo de bloqueos tronculares en la cara de los nervios supraorbitarios, supratrocleares, infraorbitarios, mentonianos, entre otros, es útil en la prolongación del tiempo anestésico y en la disminución del dolor.
La anestesia general se utiliza en un mínimo de los casos, no así es el trabajo interdisciplinario con el anestesiólogo en la anestesia local controlada o asistida de valuable beneficio en la seguridad y comodidad del paciente y el cirujano.
2. Luego de un tiempo de espera entre tres y diez minutos para permitir la vasoconstricción local, se inicia la resección oncológica del tumor en bloque clínicamente visible usando el bisturí o la cureta. Este espécimen o pieza quirúrgica es enviada directamente al laboratorio de patología para el estudio convencional.
El empleo del curetaje está justificado por la sensación “gelatinosa” del tumor y la mayor resistencia del tejido aparentemente sano. Actualmente esta técnica de curetaje es poco empleada en razón a la remoción de tejido aparentemente sano con la resultante de mayores defectos quirúrgicos (11).
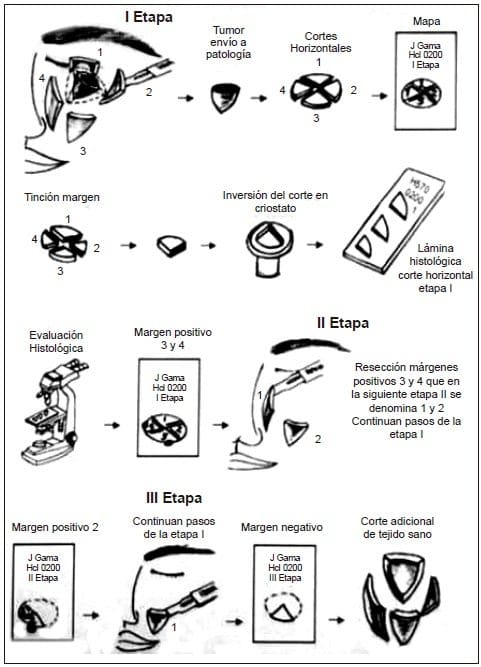
Figura 1. Representación esquemática de la cirugía micrográfica de Mohs
3. La escisión planeada es delineada sobre la piel, con márgenes pequeños (2 y 3 mm) tomados desde el defecto quirúrgico dejado por el curetaje o resección tumoral en bloque. Se debe precisar la orientación rotacional; las marcas asimétricas de identificación correspondientes a las áreas del borde del defecto quirúrgico y el borde de la pieza quirúrgica deben hacerse usando suturas, violeta de genciana, lápiz dermográfico o fotografía digital.
4. La escisión se inicia angulando el bisturí 450, se continúa completamente alrededor de la superficie del defecto quirúrgico (remanente tumoral a estudiar) en ángulo de 450 y se prolonga en profundidad abajo de la piel y paralela a la superficie interna del defecto, asimilando al de una cúpula.
Este método de escisión permite al histotecnólogo aplanar la superficie del espécimen más fácilmente en un plano horizontal. Se debe diseñar un mapa o gráfico escala 1:1 del defecto quirúrgico, el cual se emplea como referencia y orientación.
5. El tejido resecado debe tener un tamaño que quepa en una lámina histológica de vidrio; si esto no ocurre debe ser subdividido guardando una correcta orientación, manteniéndola con relación al área de escisión; cada segmento es enumerado con cifras arábigas (27).
Los bordes de corte de cada segmento deben ser tinturados de diferentes colores para su orientación durante el examen histológico; el mapa o gráfico debe ser marcado de una forma similar al espécimen con colores o líneas sólidas o punteadas. Las tintas más comúnmente utilizadas son merbromina (rojo), ferrocianito ferroso (azul), tinta india (negro).
Siguiendo la orientación del reloj, numerado en arábigo, marcando con negro (tinta india) el borde próximal a la numeración siguiente, es suficiente orientación en la mayoría de las ocasiones. El autor pinta tenuemente con la tinta china la cara ventral del corte horizontal del lado contrario a la superficie próxima del tumor.
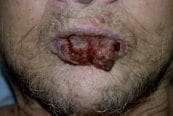 Figura 2. Paciente con carcinoma escamocelular agresivo del labio inferior. La evaluación no demostró compromiso metastásico ganglionar o sistémico
Figura 2. Paciente con carcinoma escamocelular agresivo del labio inferior. La evaluación no demostró compromiso metastásico ganglionar o sistémico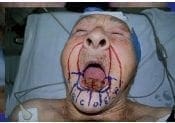 Figura 3. Diseño de la resección oncológica, cirugía micrográfica de Mohs y proyección de la reconstrucción quirúrgica empleando colgajos de rotación bilateral por la técnica de “vons-bruns -gate-flap”
Figura 3. Diseño de la resección oncológica, cirugía micrográfica de Mohs y proyección de la reconstrucción quirúrgica empleando colgajos de rotación bilateral por la técnica de “vons-bruns -gate-flap”6. La ventaja de la cirugía micrográfica de Mohs radica en la evaluación en un plano los márgenes laterales y profundos del tumor bajo una visión horizontal.
La intención es evaluar si el tumor se extiende o infiltra tejidos vecinos de tal forma que la observación de los cortes horizontales deben ser aquellos segmentos próximos en lateralidad (epidermis-dermis) y profundidad (tejido celular subcutáneo) que están más lejanos de la cara interior del defecto quirúrgico primario o remanente oncológico.
El espécimen o segmento es orientado con el lado interno (próximo al tumor) hacia abajo y colocado en la cajilla de congelación agregándole una gota de o.c.t. (optimum cutting temperature) que es una sustancia que impide el plegamiento del segmento del tumor a evaluar y la formación de cristales de hielo que dificultan la interpretación (4).
El tejido debe mantenerse permanentemente plano para lograr una excelente superficie de corte en el críostato. Respecto a este instrumento debe estar a una temperatura de -20oC en promedio; la epidermis y dermis se logran cortar con buena calidad a -20 oC y el tejido graso a -40 oC. Volviendo sobre el espécimen a congelar y cortar, este debe permanecer permanentemente aplanado, lo cual se puede lograr usando las siguientes técnicas:
a. Rociado de nitrógeno líquido.
b. Aplanado del tejido entre unas pinzas de Adson para asepsia e introducirlo en un tanque de nitrógeno líquido; en especímenes muy pequeños es preferible usar la técnica de o.c.t congelado, que consiste en congelar o.c.t a -20 oC dejándolo sobre una lámina de vidrio con un hoyuelo central sin congelar, lo cual se consigue dejando la punta de un borrador de lápiz.
Allí se deposita el espécimen de tejido a estudiar con el margen interno en contacto con la lámina de vidrio cubierto adicionalmente con o.c.t. y congelado, el espécimen es retirado de la lámina de vidrio y montado sobre una cajilla para corte.
c. Otra técnica comúnmente usada para aplanar el tejido es el extractor de calor, el cual es un bloque de metal pesado precongelado sobre el cual se monta el tejido. Otra forma es aplanar el tejido manualmente con un instrumento metálico delgado.
La cuchilla de críostato debe iniciar el corte sobre el espécimen en posición horizontal y paralelo partiendo por la superficie externa del espécimen (más alejado de la cara interna del defecto quirúrgico oncológico) con el fin de evaluar primero la extensión o infiltración en la periferia y profundidad.
Los cortes horizontales son realizados entre 5 y 7 micras de grosor, pero en el tejido subcutáneo que no es fácil cortar se prefieren más gruesos. Los cortes preparados por congelación son teñidos para su observación microscópica, la tinción más utilizada es la hematoxilina eosina (2-6).
Las láminas estudiadas por el patólogo y el cirujano micrográfico de Mohs son observadas buscando la presencia de tumor residual o persistencia oncológica, la cual es marcada en la gráfica o mapa con una señal de positivo o negativo para tumor o simplemente con un punto rojo. Esta evaluación le permite al cirujano retornar a la exacta localización del tumor residual en el defecto quirúrgico del paciente y resecarlo.
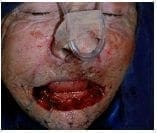 Figura 4. Resección oncológica del tumor labial, los planos quirúrgicos incluyeron los segmentos cutáneo, subcutáneo, muscular y mucoso; es decir espesor total transcutáneo-músculo-mucoso. Los cortes de Mohs estudiados patológicamente por congelación demostró la ausencia de neoplasia.
Figura 4. Resección oncológica del tumor labial, los planos quirúrgicos incluyeron los segmentos cutáneo, subcutáneo, muscular y mucoso; es decir espesor total transcutáneo-músculo-mucoso. Los cortes de Mohs estudiados patológicamente por congelación demostró la ausencia de neoplasia.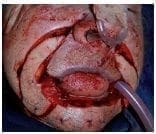 Figura 5. Inicio de la reconstrucción quirúrgica por la técnica de “vons bruns gate flap”. Colgajos de rotación bilaterales orientados sobre los pliegues nasolabiales transcutáneo muscular mucoso.
Figura 5. Inicio de la reconstrucción quirúrgica por la técnica de “vons bruns gate flap”. Colgajos de rotación bilaterales orientados sobre los pliegues nasolabiales transcutáneo muscular mucoso.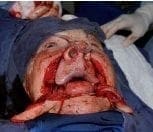
Figura 6. Disección de los colgajos. Obsérvese la complejidad de los colgajos en su espesor total.
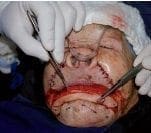 Figura 7. Rotación de los colgajos y sobreposición sobre el defecto quirúrgica primario (labial inferior).
Figura 7. Rotación de los colgajos y sobreposición sobre el defecto quirúrgica primario (labial inferior).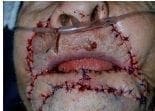 Figura 8. Sutura de los colgajos sobre defecto quirúrgico primario lográndose la completa reconstrucción.
Figura 8. Sutura de los colgajos sobre defecto quirúrgico primario lográndose la completa reconstrucción.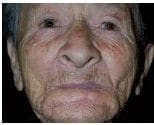 Figura 9. Estado posoperatorio tardío un (1) mes después de la intervención. Reconstitución funcional.
Figura 9. Estado posoperatorio tardío un (1) mes después de la intervención. Reconstitución funcional.Los detalles histológicos de las preparaciones por congelación no son tan claros como los de parafina y el corte transversal de las crestas interpapilares y estructuras anexiales, pueden semejarse a estructuras malignas.
Con experiencia esos tejidos neoplásicos son usualmente reconocibles. Colateralmente, el intenso infiltrado inflamatorio puede enmascarar células neoplásica individuales o en grupo; en esas circunstancias algunas inmunotinciones han reportado detectar el cáncer que no ha sido visualizado con tinciones de rutina.
Las técnicas de inmunohistoquímica han sido utilizadas exitosamente en carcinoma basocelular, carcinoma escamocelular, enfermedad de Paget extramamaria, lentigo maligno, carcinoma linfoepiteliomatoso cutáneo, dermatofibrosarcoma protuberans (2-6).
Una alternativa en situaciones difíciles para la interpretación es someter los cortes a la parafinización, postergando la reconstrucción; igualmente este recurso técnico es usado en laboratorios de patología que no cuentan con tinciones de inmunohistoquímica.
7. El tumor residual es removido en sucesivas etapas (convencionalmente se designan con números romanos) en los segmentos comprometidos hasta que los márgenes quirúrgicos estén libres de tumor. Cada segmento removido se designa en números arábigos y se denomina pasos.
De esta manera el tejido no comprometido es preservado así como el tumor es secuencialmente removido. La graficación previa de cada etapa sirve como un documento en la historia clínica.
Técnica de fijación in situ
La técnica de fijación in situ y la congelación son similares en todos los pasos, excepto que la primera implica fijación antes de la escisión, eliminando la necesidad de anestesia y preservando un campo quirúrgico exsangüe.
En breve se fundamenta en etapas secuenciales de fijación de los tejidos. El tejido a resecar se prepara similarmente a la técnica de fijación, infiltrando un anillo de anestesia peritumoralmente, luego se inicia la etapa de resección tumoral en bloque, la cual está supeditada al volumen del tumor.
Sea cual fuere la decisión sobre el defecto quirúrgico o sobre la neoplasia previamente anestesiada, se aplica ácido tricloacético al 90% como hemostático y facilitador para la penetración de la pasta de Mohs.
Cuando la superficie se blanquea la pasta de cloruro de zinc es aplicada en una delgada capa, el grosor de la aplicación depende de la profundidad de la piel y la profundidad de penetración deseada. Después, la lesión es perimétricamente delimitada colocando un vendaje adhesivo y cubriéndola con una gasa, previniendo así la extensión de la pasta sobre los tejidos sanos.
La composición de la pasta es: 34,5 ml de cloruro de zinc en solución saturada, 40 g de estigmita y 10 g de sanguinaria canadensis en polvo (2).
Esta pasta causa fijación lenta del tejido en un período superior a las 18 horas, el cloruro de zinc se hidroliza en agua y forma ácido hidroclórico el cual es el agente fijador activo provocando necrosis por coagulación.
La penetración del fijador depende de la cantidad aplicada y del tiempo de duración o permanencia del fijador. La localización anatómica dicta la necesidad de penetración, quiere decir que menor penetración es preferible en áreas de mayor preservación tisular como la punta nasal o el hélix del oído.
Es necesario administrar analgésicos, ya que es un proceso doloroso. Después de la fijación, la gasa se retira, se limpia el tejido y se continúa la misma técnica empleada por congelación, excepto que no es necesario aplicar anestesia adicional y no ocurre sangrado dentro del tejido fijado.
La escisión se inicia angulando el bisturí 45o dentro del tejido fijado cerca al borde del tejido no fijado; la escisión continúa bordeando el defecto quirúrgico en un ángulo de 45o bajo la piel paralela a la superficie.
El tejido resecado es orientado y subdividido en tamaños que permitan ser procesados para el examen microscópico, los bordes son marcados y el gráfico se diseña de manera análoga a los cortes por congelación.
En razón a que los tejidos fijados con la pasta de cloruro de zinc son friables, la epidermis y la dermis son generalmente cortados entre 12 μm y 16 μm y el tejido graso entre 25 μm y 30 μm, tres veces más grueso que la técnica de congelación y seis veces mayores que los cortes en parafina, haciendo probablemente más difícil la interpretación histológica (5,6).
Si el análisis histológico es positivo para tumor residual, se procede a realizar los mismos pasos hasta la escisión; cada etapa de escisión con esta técnica in situ requiere usualmente un día. El defecto quirúrgico se repara por segunda intención o por reconstrucción inmediata.
La clave del éxito de escisión de los tejidos fijados in situ es su resección a tiempo. Tejidos fijados por más de 24 horas son friables y difícilmente se pueden realizar cortes delgados. La fijación in situ acarrea marcada reacción inflamatoria en los tejidos y puede adicionar un beneficio al procedimiento.
La infiltración de linfocitos ha sido investigada en melanomas no fijados con la pasta de cloruro de zinc y se demostró incremento en la sobrevida (2-4). La intensa reacción inflamatoria desencadenada por la fijación in situ podría estimular la respuesta inmune específica y no específica contra las células tumorales, aunque esta hipótesis no ha sido estudiada en los tejidos fijados con cloruro de zinc.
Las ventajas de la técnica por congelación sobre la técnica de fijación in situ incluyen: eliminación del dolor preoperatorio causado por el fijador, facilidad de realizar múltiples etapas de escisión en el mismo día, cortes histológicos más delgados mejorando la calidad y precisión de la interpretación, reconstrucción inmediata del defecto quirúrgico obviando la necesidad de esperar el ablandamiento del tejido fijado.
Entre las desventajas encontramos: mayor sangrado, el empleo de anestesia local incrementa la toxicidad, potencial y especialmente cuando se intervienen tumores grandes o se emplean múltiples etapas quirúrgicas.
La técnica de fijación in situ está indicada en neoplasias vasculares, neoplasias ubicadas en áreas vascularizadas como el pene, neoplasias en espacios profundos y estrechos como el canal auditivo externo, neoplasias que invadan el hueso y neoplasias con alto riesgo de metástasis como el melanoma.
Técnica del procesamiento en parafina
Está técnica describe las mismas secuencias quirúrgicas empleadas en la técnica por congelación, diferenciándose en que los tejidos resecados son marcados, fijados en formol buferizado neutralizado y procesado en bloque de parafina y cortados entre 4 y 6 micras más delgado que las anteriores técnicas, facilitando la interpretación y mejorando la observación de los detalles histológicos (12).
Está técnica se indica en aquellas neoplasias de difícil interpretación histológica por congelación como son el melanoma o el dermatofibrosarcoma protuberans. Se emplea en centros quirúrgicos que carecen de refinamientos tecnológicos en la disponibilidad del criostato. La desventaja radica en el empleo de un mayor tiempo quirúrgico en la resección tumoral.


