Doctores Mario Sánchez
(Académico de Número)
D. Castillo, O. López
Introducción
La hemoglobina Ale es una de las 4 glicohemoglobinas y constituye el 5 % de la hemoglobina total del adulto normal. Centenares de estudios se han realizado en el mundo sobre su elevación en el diabético; frente a la total, la hemoglobina glicosilada sube hasta un 15 %.
Técnicas diversas han avanzado hasta poner a disposición del laboratorio convencional que usa el médico, métodos que permiten su dosificación global en forma simple y económica. La HbAlc se forma por condensación no enzimática, post-transduccional con los residuos aminoácidos de las cadenas de valina y con los residuos de lisina de las cadenas alpha y beta en posiciones no terminales.
La glicosilación de la hemoglobina está en relación directa con la concentración de la glucosa sanguínea y por ello se postula que es un índice de control glicémico del diabético. Es posible que diversos factores influyan en la glicosilación de la Hb, tales serían la tensión del oxígeno, la concentración del 2, 3-DPG y otros que están en estudio (1).
En razón de los cambios del 2, 3-DPG frente a la deoxihemoglobina, se decidió con base en el estudio sobre cifras normales de hemoglobina Al a diferentes alturas de Colombia (2, 3) diseñar un proyecto de casos y con troles para estudiar los niveles de HbA 1c al nivel del mar y a la altura de Bogotá, tanto en diabéticos como en normales.
Al mismo tiempo se proyectó la determinación del 2, 3 DPG contenido en la sangre siguiendo los trabajos pioneros sobre el tema de Ditzel y colaboradores, de los cuales los más relevantes fueron publicados en su obra Diabetic Micro- Angiopathy (33). (Puede interesarle también: Inteligencia Artificial y Neurología: I Parte)
Material y Métodos
Se tomaron 25 diabéticos no insulina-dependientes, localizados al nivel del mar (O m.) y 25 en Bogotá a 2.675 m sobre el nivel del mar. Se estudiaron personas normales de las mismas edades de los diabéticos, 120 residentes a 2.675 m y 60 residentes a O m.
Los criterios de inclusión fueron: para los diabéticos no insulino dependientes, edad entre 35 y 55 años, mujeres y hombres estrictamente controlados, en seguimiento de un año, con controles mensuales y residencia permanente en el sitio elegido.
Fueron requisitos indispensables la ausencia de hipertensión arterial, de nefropatía evidente identificable por mínima proteinuria en el seguimiento de orina de 24 horas, de elevaciones de la creatinina, colesterol y triglicéridos y de modificaciones del BUN por encima de las cifras normales establecidas.
No se aceptaron individuos con retinopatía proliferativa ni con alteraciones vasculares comprobadas, tales como microangiopatía diabética de los miembros inferiores o mixtas, como sucede en el caso de la neuropatía diabética, que dá lugar al pié diabético neuroangiopático, a las trofopatías y a las alteraciones vasculares periféricas relacionadas con esta noxa.
Se excluyeron hiperlipidemias, cardiopatías de cualquier grado, macroangiopatías, infecciones sistémicas localizadas de cualquier orden, hepatopatías, hemopatías, anemias, insuficiencia pulmonar crónica restrictiva o constrictiva, enfermedades del sistema nervioso central o periférico no diabéticas, alcoholismo y tabaquismo crónicos, cáncer de cualquier tipo i todo diabético que estuviera en riesgo de hacerse insulino-dependiente.
La razón ‘para excluir del estudio a la diabetes insulina- dependiente (DID) es obvia, por las grandes variaciones que tiene la Hb Alc en períodos de descontrol de la enfermedad, de infecciones intercurrentes, de traumatismo y de otros factores que convencionalmente modifican rápida y frecuentemente los niveles de glicemia en este tipo de enfermos, siempre de muy difícil estabilidad.
La elección de los sitios en donde se tomaran tanto los casos como los controles, tuvo como objetivos la localización fácil del individuo, el cumplimiento en el tratamiento, la factibilidad de su control, la adhesión del paciente al médico y al laboratorio que los solicitaba, la voluntad misma de cooperar del enfermo y la posibilidad de actuar médicamente en forma inmediata, ante cualquier enfermedad intercurrente.
Con base en nuestro trabajo anterior (3) se eligió como lugar de mayor altura a Bogotá, D.E., capital de Colombia, que está a 2.675 metros sobre el nivel del mar, en donde las normales de hemoglobina Alc equivalieron estadísticamente con las que se trajeron y determinaron en sitios colombianos de mayor altura, 3.600 m sobre el nivel del mar, en Guicán y Cocuy en el Departamento de Boyacá.
Como sitios denominados al nivel del mar (O m de altura) se eligieron tres ciudades de la Costa Atlántica, Barranquilla, Cartagena y Santa Marta; y Girardot, próxima a Bogotá, que está localizada a 500 m sobre el nivel del mar.
El estudio se planeó para una observación de 12 meses consecutivos con seguimiento de los diabéticos no insulina-dependientes (NID) y de sus controles en las 5 ciudades seleccionadas.
A cada paciente se le asignó un número y se le abrió una historia clínica convencional para seguimiento, a fin de cubrir integralmente toda la patología que permitiera tratar al enfermo en cualquier complicación y sacarlo del estudio de acuerdo con los criterios de exclusión.
Las consultas médicas se hicieron por el investigador principal y se efectuaron al mismo tiempo las determinaciones de 2, 3-DPG. En el caso de los diabéticos seleccionados al nivel del mar, la evaluación clínica periódica se hizo mensualmente de acuerdo con el criterio del protocolo.
A todos los pacientes antes y al final del estudio se les cuantificaron colesterol, triglicéridos, lipoproteínas de baja densidad, creatinina, B U N, ácido úrico, transaminasas pirúvica y oxalacética, fosfatasa alcalina, cuadro hemático y sedimento urinario. El promedio de determinaciones de glicemia, por el método de la glucosa oxidasa (autoanalizador ABA 100), fue de dós mensuales, considerando que el paciente se encontraba correctamente controlado.
Las hemoglobinas Ala Alb Alc se separaron por columna cromatográfica con Bio Rex 70 (Bio Rad Laboratories, Richmond, Calif), con 200 a 400 mallas. Una alícuota de 75 microlitros del hemolizado se colocó directamente en la resina y las columnas se diluyeron a la temperatura ambiental del cuarto. Las hemoglobinas Al y AIB se eluyeron en 15 mI, mientras que la hemoglobina Alc se eludió entre 30 y 50 mI.
La separación de la hemoglobina Al c se hizo por lavado de las columnas con buffer y se corrió por gravedad. Las determinaciones de 2, 3-DPG se hicieron utilizando el kit de Sigma 665-Pa (Sigma Chemical Ca., St. Louis, MO).
Resultados Obtenidos
Los patrones normales de la HbA 1c, (Tabla No.1) muestran una frecuencia de distribución al nivel del mar que tiene las cifras mayores del 2%al 4 %. El número de controles normales hechos a 500 m/snm, muestra más o menos las mismas frecuencias del 6% y 7% como está expresado en la Tabla No. 1
Tabla No. 1 DISTRIBUCION DE FRECUENCIA
GLICOHEMOGlOBINA Ale A DIFERENTES ALTURAS

A 2.800 m las cifras de glicohemoglobinas Alc normales están entre el 8 y el 9%en el50%de los individuos, cifras que coinciden exactamente, 7 a 8 %en 45 % de los individuos en las alturas de 3.500 m/snm, Guicán y Cocuy frente al 27% de los individuos quienes tienen 5 a 6%de HbAlc como está claro en la gráfica.
Estos datos llevan a la presunción de que no hay diferencia en las cifras comparadas entre 2.650 m/spm y 3.500 m/snm en donde comienza la zona denominada de “handicap” o de riesgo.
La comparación entre distintas alturas muestra claramente cuál es la tendencia en la frecuencia
de distribución a distintas alturas y cómo en realidad sí se van incrementando desde luego, dentro de las cifras establecidas como normales en los distintos estudios hechos en el mundo, a medida que se eleva la altura sobre el nivel del mar, en individuos que permanentemente viven a este nivel y tienen una adaptación fisiológica a las condiciones de altura, de vida, de ejercicio, alimentación, etc.
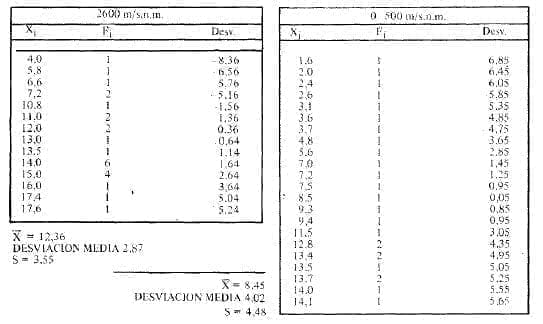
En cambio al estudiar los diabéticos no insulina dependientes Tipo II seguidos durante un año, como 10 establecía el protocolo y que estuviera satisfactoriamente controlados, las cifras son un poco diferentes. La Tabla No. 2 establece y señala las cifras halladas en el curso de un año, promedio de 10 determinaciones y la desviación standard correspondiente. La tabla No. 3 señala las distribuciones de frecuencia.
Tabla 2: Promedio de Glicohemoglobina ALc por diabético no insulino dependiente en un año

Los pacientes estuvieron siempre dentro de límites de glicemia mínimo de 70 mg/dl y máximo de 180 mg/dl, una hora después de haber comido y en ayunas. Estos valores se consideraron como criterios de una aceptable compensación.
El comportamiento de las cifras de glicohemoglobina Alc fue en los diabéticos estudiados al nivel del mar la mínima de 1.6% y la máxima de 14.1 % . En la altura la mínima cantidad de hemoglobina hallada fue de 4.0%y la máxima fue de 17.4%.
Para ajustarse más a la realidad se tomaron los 28 diabéticos mejor controlados en el grupo de los ubicados en cada uno de los lugares al nivel del mar y altura, esto es quienes no tuvieron nunca una glicemia superior a 140 mg/dl de glucosa en ayunas o una hora después de comer y se compararon con los controles, se ve claramente cómo a medida que se eleva la altura suben así mismo las hemoglobinas.
Curiosamente individuos con glicohemoglobinas bajas, es decir aquellos a quienes estimábamos mejor controlados por tener estas cifras de HbA1c, frente a las normales más bajas, fueron quienes tuvieron glicemias superiores a 145 mg.
Esto no quiere decir que el mejor control no tenga una glicemia y una hemoglobina más bajas porque estas dos variables en ningún momento miden, ni el control de la diabetes, ni la adhesión del diabético al tratamiento, sino un hecho biométrico o una cifra que indica un cambio, que solamente si es muy elevado está correlacionado con un pobre manejo de la diabetes, o mucho mejor de su glicemia.
Así pues individuos que tienen una glicemia de fluctuaciones entre 120 y 145, frente a individuos que manejan cifras entre 120 y 180, quienes siempre muestran glicohemoglobinas Al c permanentemente elevadas, sea que vivan al nivel del mar o que residan a 2.560 m/snm.
Este hecho lleva a la consideración de que no solamente hay factores relacionados con la misma glicemia o su fluctuación constante en cifras elevadas, para la elevación de las hemoglobinas glicosiladas, en particular de la Al c, sino también otros como la residencia por encima de los 2.650 m/snm.
Los resultados de las determinaciones de 2, 3-DPG tanto a O m/snm como a 3.500 m s/snm fueron similares en los individuos normales a las cifras establecidas como rangos normales en la literatura in ternacional: 1.6 a 2.6 )JMoles/ml en sangre total con una desviación standard tanto en hombres como en mujeres (5). La Tabla 3 señala los valores obtenidos.
Tabla 3: Distribución de Frecuencia
Las cifras halladas a O m/snm, de 2,3-DPG en diabéticos tipo 11 están descritas en la Tabla No. 4 y se obtuvieron por determinación hecha cada dos meses, en un total de 6. Tampoco se alejan de los patrones normales tanto internacionales como locales.
Tabla No. 4

Los diabéticos dieron cifras un poco más elevadas, cuando se estudiaron por encima de 2.650 m de altura s.n.m., tal como está señalado en la Tabla No. 5.
Tabla No. 5

Estos resultados preliminares pueden plantear la hipótesis de que la captación por la deoxihemoglobina del glóbulo rojo, es un hecho que puede explicar la razón de la elevación de la hemoglobina Al c, que es de por sí una expresión del fenómeno de mayor glicosilación a medida que exista la posibilidad de menor disponibilidad de oxígeno.
En ninguno de los pacientes diabéticos Tipo 11 observados en el curso del año se presentaron cambios significativos estadísticamente en el colesterol, triglicéridos, lipoproteínas de baja densidad, creatinina, BUN, ácido úrico, transaminasa pirúvica y oxalacética, fosfatasa alcalina, cuadro hemático y sedimento urinario. Las modificaciones de la glicemia frente a las glicohemoglobinas estuvieron correlacionadas y corresponden a las variaciones normales que pueden tener los diabéticos en sus HbA 1c cuando elevan la glicemia.
Discusión
El pigmento rojo del eritrocito es la proteína conjugada, la hemoglobina, que está en cantidad de 14 a 16 gm por di de sangre y se estima que hay 750 gm de hemoglobina en la sangre de un hombre de 70 kilos y que un promedio de 6.25 gm se producen y se destruyen diariamente.
El clorhidrato de heme llamado hemina se separa en forma cristalina y es una porfirina de hierro. La globina es una proteína de 4 sub-unidades que tiene estructura de tetrámero. Cada subunidad consiste en cadenas de polipéptidos.
Dos cadenas tiene idéntica composición de amino-ácidos y se designan como cadenas alpha. Las otras dos son diferentes, pero idénticas en las dos cadenas denominadas beta. La hemoglobina del hombre tiene dos cadenas alpha y dos cadenas beta unida cada una de ellas a un grupo heme.
La valina tiene el nitrógeno terminal y la arginina tiene el carbono del aminoácido terminal. La cadena ex tiene 146 aminoácidos con la valina como nitrógeno terminal y con la histidina como carbono terminal Se sugiere que uno de los puentes imidazólicos, posiblemen te la histidina 58 en la cadena alpha y la histidina 63 en la cadena beta, son desplazados reversiblemente por el oxígeno cuando se oxigena la hemoglobina.
La carga positiva catiónica del nitrógeno terminal del grupo amonio de la cadena alpha está íntimamente unida con la carga negativa catiónica del carbono terminal de la segunda cadena alpha. Esta relación existe igualmente entre las dos cadenas beta, lo cual resulta en una atracción electrostática muy importante en el mantenimiento cuaternario de la estructura proteica.
La propiedad más importante de hemoglobina es su capacidad para transportar oxígeno en forma de oxihemoglobina y esta combinación se lleva a cabo por incremento en las tensiones del oxígeno. El efecto del C02, sobre la combinación del oxígeno con la hemoglobina hace tiempo se conoce como efecto Bohr, el cual se debe a cambios en el pH en el medio que rodea a los eritrocitos.
La combinación del oxígeno con la hemoglobina es reversible, por exposición de la oxihemoglobina a tensiones de oxígeno más bajas. A tensiones de oxígeno de 100 mm de mercurio o más, la hemoglobina está virtualmente concentrada en un 100% y aproximadamente 1.34 mI de oxígeno se combina con cada g de hemoglobina. El monóxido de carbono se combina con la hemoglobina mucho más fácilmente de lo que sucede con el oxígeno.
Además de los compuestos enumerados, otro producto, el eritrocito, ejerce efecto importante en el transporte del oxígeno por la hemoglobina del glóbulo rojo, es el ácido 2,3 difosglicéricos (DPG) denominado también difosfoglicerato.
Su papel en el transporte del oxígeno por la hemoglobina es parecido al del C02. La cantidad de 2,3 DPG en el glóbulo rojo es equivalente, en cuantificación molar a la concentración de la hemoglobina. Variaciones en los niveles de 2,3 DPG en las cantidades de hemoglobina y en la unidad por el oxígeno de la misma son normales en la población normal, sin embargo la correlación negativa entre los niveles de hemoglobina y la concentración de 2,3 DPG junto con el P50, es siempre negativa.
Esto es bajan el 2,3 DPG el H+ y el C02 (5) el efecto del 2,3-DPG sobre la afinidad de la hemoglobina para el oxígeno (19,20). En cuanto baje el pH y descienda el fosfato inorgánico, se produce una inhibición de la glicolísis del eritrocito y en consecuencia la disminución de la producción de 2,3-DPG, el descenso del pH y la reducción del fosfato inorgánico son determinantes para comprometer el proceso de resíntesis del 2,3- DPG Y la normalización de la hemoglobina para el oxígeno.
El concepto preconizado en los importantes trabajos de Ditzel (15) se basa en el hecho de que la célula requiere un óptimo suministro de oxígeno el cual debe ser constante y a su vez depende de enzimas que son muy sensibles a cualquier variación de la tensión de oxígeno (21), que debe mantenerse siempre igual e invariable, con el objeto de mantener estables los mecanismos compensadores que la regulan. Uno de ellos es el 2,3DPG el más efectivo.
Es la razón por la cual una disociación de la hemoglobina, no afecta la microcirculación, tal como ocurriría en la respuesta a la hipoxia de ciertos tejidos que responden con vasodilatación y con un aumento en el débito cardíaco. Está demostrado que siendo la diabetes una enfermedad crónica, también lleva a cambios contínuos y agudos en el metabolismo para los cuales hay dificultades orgánicas de adaptación (22). Las variaciones en el consumo de oxígeno y en la capacidad para su liberación a los tejidos tienen tasas de consumo más o menos establecidas (22).
Por tal razón la modulación del oxígeno, está ajustada al 2,3-DPG ,y parece que el único mecanismo para mantener un consumo óptimo importante de oxígeno sería este factor. Las razones por las cuales hay un hiperconsumo de oxígeno en la diabetes se desconocen hasta el momento.
El informe de que hay aumento en el contenido de Hb Alc con mayor capacidad para la afinidad de oxígeno que la que dispone la hemoglobina A (23), permite algunas especulaciones, sobre las cuales posiblemente la disponibilidad de oxígeno de los tejidos en el lado venoso de la microcirculación, pueda estar disminuído, especialmente en áreas de alta demanda metabólica. (24)
Las investigaciones de Ditzel (17) presuponen que para compensar la disminución en la relación disponibilidad sobre demanda de oxígeno, hay tres factores de regulación en la diabetes temprana: un aumento en el flujo local casi inmediato; un aumento en el 2,3-DPG de la célula que lleva a la disociación de la curva de oxigenación hacia la derecha, relacionada directamente con el mecanismo regulatorio metabólico de la diabetes; y, finalmente, un aumento en la capacidad para la captación del oxígeno por la hemoglobina, proceso que requiere semanas para ser efectivo.
Este fue uno de los motivos para la investigación nuestra anterior publicación (2,3) y que trató de analizar la posible hipoxia en la altura y su relación con el incremento de la captación de oxígeno por la hemoglobina Al c que de por sí es más ávida de oxígeno que sus congéneres.
En esta investigación se estableció la hipótesis de que las glicohemoglobinas totales (HbA 1) se elevan gradualmente en los individuos no diabéticos que se estudiaron como controles, a medida que sube la altura en su residencia. De todas maneras las HcAl más elevadas se encontraron en diabéticos insulino-dependientes, obviamente bien controlados pero que viven en Bogotá. En virtud de este hallazgo se diseñó el proyecto de casos y controles, separando las 3 hemoglobinas glicosiladas y determinando específicamente las HbAlc.
Para entender mejor la hipótesis de la función del 2,3-DPG frente a la deoxihemoglobina es importante recordar sumariamente el concepto de Perutz (6), que no ha tenido hasta el presente modificaciones sobre el posible mecanismo que explique el transporte del oxígeno y los efectos del C02 y del 2,3-DPG en la sucesión de eventos que ocurren en el mencionado proceso.
En la forma deoxigenada, las cuatro sub-unidades, esto es las cadenas alpha y las beta de la hemoglobina están unidas por una serie de lazos no covalentes que conectan entre sí las distintas porciones de las cadenas.
Las dos cadenas alpha forman puentes salinos con cada una de las porciones del grupo ex amino de la valina alpha 2, a saber el nitrogeno terminal del amino ácido de la cadena alpha, se une al grupo carboxilico- C terminal de la arginina ex 1, esto es al aminoácido que está en posición 141; así también se une al grupo guanidina ex 1 de la arginina 141 con el ácido aspártico 126. Las uniones de la valina ex 1 a la arginina ex 2 son constantes.
Igualmente hay puentes entre el COOH de la histidina alpha (Beta 1) con el aminoácido epsilon de la lisina 40 (ex 2) y el imidazol de histidina 146 (Beta 1) con el ácido aspartico 94 (Beta1). Igualmente hay unioues entre la histidina 146 de la cadena beta 2 con lisina 40 alpha 1.
El resto de los últimos aminoácidos en estas 4 cadenas de hemoglobina corresponden a residuos de tirosina. Están ubicados en unos bolsillos hidrofóbicos en la estructura helicoidal de las cadenas peptídicas de la globina.
Es importante destacar que una molécula de 2,3- DPQ forma 4 puentes salinos con grupos catiónicos de las cadenas beta, lo cual dá lugar a una estrecha unión de la molécula. Y aquí es importante señalar que en el adulto normal el 2-3 DPG de la hemoglobina deoxigenada está unido en forma denominada mol a mol.
Por otra parte tiene suma importancia recordar que la hemoglobina oxigenada tiene muy baja afinidad para el 2,3-DPG. Este compuesto ofrece la posibilidad de una estrecha unión de las cadenas beta entre sí. Tal hecho interfiere con el transporte de oxígeno y en consecuencia la deoxigenación, es decir la liberación del oxígeno de la hemoglobina, se facilita porque la afinidad de la hemoglobina por el oxígeno está francamente disminuída por el 2,3-DPG.
La hemoglobina deoxigenada tiene sus puentes salinos intactos y un mol de 2, 3-DPG se localiza entre las dos cadenas beta de la hemoglobina.
Al contrario en la forma oxigenada todos los puentes salinos de hemoglobina se rompen y el 2, 3-DPG se libera así como también lo hacen los 4 residuos de tirosina contenidos en los bolsillos configuracionales antes mencionados.
Todos estos casos son en cierta forma hipotéticos en su secuencia pero ciertos en su ocurrencia, explicándose en esta forma el carácter sigmoidal de la curva de oxigenación por aumento de la afinidad de la hemoglobina por el oxígeno. A su vez el efecto de Bohr puede explicarse en virtud de los cambios de ionización constante de los grupos que forman los puentes salinos de la hemoglobina, que están completamente libres en la oxihemoglobina.
De acuerdo con todos estos hechos fisiológicos, si la descomposición o rompimiento de los puentes de 2, 3-DPG es amplio, entonces la glicosilación no enzimática de la hemoglobina se realiza u ocurre a una mayor tasa. Entonces a mayor altura lógicamente debe haber un aumento en la deoxihemoglobina. Esto lleva en forma lógica a una elevación de los niveles de 2,3-DPG y por esta razón la glicosilación se lleva a cabo en una mayor tasa dosificable.
In-vitro hay estudios (25) sobre eritrocitos intactos a temperaturas fisiológicas en donde se ha estudiado la formación de hemoglobina Alc, la cual se ha limitado a un lapso de 24 a 48 hrs. debido a la hemolisis extensa. Estos mismos autores agregando una solución balanceada salina con albúmina bovina 10%, logran la incubación de los eritrocitos previamente lavados a 37°C, y el que se mantengan con una mínima hemólisis por más de 8 días.
Este modelo experimental sirvió a los investigadores para estudiar la glicosilación, por cuanto la hemoglobina se mantiene en su estado nativo y la formación hemoglobina Al c se lleva a cabo a una tasa similar de lo que sucede in vitro. Bajo tales condiciones los mismos investigadores observan una línea de regresión lineal que tiene relación estricta entre la formación de hemoglobina A1c y la concentración de glucosa en el medio.
No fue posible estudiar la glicosilación hemoglobínica con concen traciones inferiores a 40 mg/ dI de glucosa debido a la excesiva hemólisis. Concluyen por este lado los autores, que extrapolando los datos a mayores concentraciones de glucosa hay una tasa límite de hemoglobina aún en ausencia de glucosa en el medio.
Esto podría deberse a 3 factores, el primero la mayor captación de glucosa por los eritrocitos a menor concentración de la misma, por un sistema que podría ser considerado de mayor eficacia. En segundo lugar, podría ocurrir una secuestración de la glucosa en los sitios de ligaduras de la hemoglobina y por último, puede existir una heterogeneidad en el pico de la hemoglobina Alc.
Se presume hasta el presente que la glicosilación no enzimática de la hemoglobina depende solamente de la concentración de glucosa y por consiguiente, los niveles están determinados por el promedio de glucosa plasmática y de la vida media del eritrocito (26).
Sin embargo al estudiar eritrocitos intactos (l) in vitro, se ha probado que existen otros factores fisiológicos que tienen influencia poderosa en la tasa de la formación de hemoglobina Al c. Ante concentraciones constantes de glucosa, la deoxihemoglobina se glicosila en una tasa doble a lo que sucede con la oxihemoglobina. (27)
Todo esto lleva a que haya una sobreestimación de los niveles de glucosa en pacientes, con niveles de glicohemoglobina elevados y que al mismo tiempo tienen una enfermedad pulmonar con hipoxia sistémica o una enfermedad vascular con áreas extensas de estasis venosa e hipoxia eritrocitaria local. ¿Cuál es el mecanismo que-promueve la glicosilación de la oxihemoglobina?
Es una pregunta que aún no se puede responder, pero tiene implicaciones de orden fisiológico y patológico.
Se conoce el aumento de la reactividad de los radicales aminoterminales de la deoxihemoglobina (28, 29) porque la ligadura del C02 y del cianato están incrementados en el estado deoxi de la hemoglobina.
La tasa de formación de hemoglobina Alc, como ya se ha dicho (25, 26, 27) está influenciada por los niveles de 2, 3-DPG. En cuanto este producto se eleva la hemoglobina glicosilada aumenta. También está dicho que ante niveles altos de 2, 3 DPG la deoxihemagia bina se glicosila en cantidades 3 veces mayores en que lo hace la oxihemoglobina en presencia de cantidades fisiológicas de 2, 3DPG.
La explicación de este hecho no es clara, es posible que el 2, 3-DPG disminuya la carga positiva de los radicales amino-terminales y por ello aumente la reactivación de la glucosa o dé lugar a un cambio conformacional que dé lugar a una condición mejor de los factores denominados “steric” .
Por otra parte es posible que no se esté midiendo la auténtica formación de hemoglobina Al c, pero este hecho no es muy probable por cuanto la medida de los factores intermedios de los eritrocitos, tratados con inosina (30), como son el piruvato y el fosfato no presentan cambios en la concentración de compuestos que potencialmente contienen grupos carbonílicos.
También es muy poco probable que el piruvato mismo reaccione con la hemoglobina A porque al agregar 2.5 mM de piruvato de sodio sólo al medio de incubación no hay un aumento en la formación de hemoglobina Alc (27).
Es preciso hacer hincapié que Smith y colaboradores (1) no han determinado que el 2-3 DPG Y el estado anaeróbico aumenten la tasa de reacción entre glucosa y la beta-l valina de la hemoglobina. Estos autores han medido el producto quetoamínico estable y ellos estiman que se incrementa en la experiencia la tasa del fenómeno o reagrupación Amadori que convierte la base de Schiff a una quetoamina.
Entonces de acuerdo con ellos el efecto 02 y 2,3-DPG sobre la glicosilación de la hemoglobina, puede explicar la variabilidad de los niveles de hemoglobina observados en pacientes diabéticos, con nive1es casi iguales de glucosa sanguínea o en el mismo paciente en diferentes momentos del día o del tiempo seleccionado. El concepto de modificación de glicosilación no enzimática como ya está demostrado en diversos estudios (31, 32) puede ocurrir en otras proteínas en sus radicales aminoterminales o en los grupos epsilon delisina.
De todo esto se concluye que in-vitro la glicosilación no enzimática de la hemoglobina está influenciada por factores diferentes a las concentraciones de glucosa tales como son la tensión de oxígeno y las cantidades de 2, 3-DPG.
Resumen y Conclusiones
l. En un estudio de casos y controles de diabéticos no insulina-dependientes y sus controles se estudian las variaciones de la hemoglobina Al c al nivel del mar y a 2.600 m/snm. Se obtienen resultados preliminares, en los que se confirman los hallazgos de un trabajo anterior, en el cual se presume que las cantidades de glicohemoglobina en diabéticos no insulina-dependientes y regularmente controlados, esto es seguidos en su control en el tiempo y en las modificaciones de sus constantes biométricas, tales pacientes elevan la hemoglobina Al c, a medida que suben de altura sobre el nivel del mar.
2. Se estudian al mismo tiempo las variaciones del 2,3-difosfoglicerato y se obtienen elevaciones estadísticamente significativas en los diabéticos residentes a mayor altura. No hubo variaciones de este compuesto en los individuos controles tanto al nivel del mar como en la altura.
3. De acuerdo con estos hallazgos se especula sobre el hecho de que el desdoblamiento del 2,3-DPG es mayor y entonces la glicosilación no enzimática de la hemoglobina es a su vez más alta; por esa razón se piensa que tanto en un individuo normal como en el diabético en la altura existe un aumento en la deoxihemoglobina, hecho que a su vez lleva a una mayor elevación de las cantidades de 2,3 DPG. Esta sería la razón para una mayor glicosilación hemoglobínica.
4. Esta hipótesis de un hallazgo, es una información preliminar que requiere comprobación ulterior, a fin de establecer y reproducir los hallazgos y a su vez establecer el hecho de que al regresar de la altura al nivel del mar diabéticos no insulino-dependientes bien controlados tienen hemoglobinas Al c iguales a los diabéticos residentes al nivel del mar.
Bibliografía
l. Smíth. RJ .. Roeníng. RJ., Llinnerls A., Soeldner J .S .. ami Aoki T. T.’ Regulatíon of lIemoglobín A Ic Formation in human crytroeytes in vitro. J. Clin. Invest. 69: 1164-1167. 1982.
2. Sanchez-Medina. M.; Posibles factores de riesgo de la retinopatía diabética en Colombia en diferentes zonas etnogeográficas y alturas sobre el nivel del mar. Medicina, 7: 5-13,1983.
3. Sanches-Medina, M.; Orjuela, C., Castillo, D. and López, C: Possible risk factors of diabetic retinopathy in Colombia at different ethnogeographic and altitude zones aboye sea leveol. Poster Sission 11 th. Congress of the IDF p. 116, Nairobi, Kenya, November 10-17,1982.
4. Grisolia S, Moorek, Luque J, Grady 11: Automatic proeedure for the mieroestiamtion of 2.3-diphosphoglyeerate. Anal Bioehem 31: 235, 1969.
5. Eaton JW, Brewer CJ: The relationship between red cell 2,3-diphosphoglycerate and levels of hemoglobin in the human. Proe Natl Aead Sei USA 61: 756, 1968.
6. Perutz MF: Stereoehemistry of cooperative effects ín hemoglobin. Nature 228: 726, 1970.
7. De Verdier Cll, Carby L Hjelm M: lntra-erytroeytic reguIation of tissue oxígen tension. Acta Soc. Med. upsa!. 72: 209.1969.
8. Dítzel J: Lffeet of plasma inorganic phosphate on tíssue oxygenatíon during reeovery from diabetic ketoaeídosis. Adv. Exp. Med. 37A: 163,1973.
9. Dítzel J, Standl E: Erytroeyte 2.3-diphosphoglyeerate concentratíon ín rclation to the oxygen affinity of whole blood ín non-acídotíc diabetíes ín various conditions of metabolie control. In Diabetie Microangíopathy 59-68, 1975 A lindgren & Soner A13, Molndal.
10. Hjelm M: The content of 2,3-díphosphoglycrate and sonie other phosphocompounds in human erythroeytes from healthy adults ami subjects wíth dífferent types of anaemia. Forsvarsmedícin 5: 219. 1969.
11. Chanutin A, Curnish RR: Effect of organíc and inorganic phosphates on the oxygen equilíbríum of’ human crytroeytes. Areh Bíoehcm Bíophys 121: 96,1967.
12. Dítzel J. Andcrsen 11, Daugaard Peters N: Oxygen affinity of haemoglobín and red cell 2,3-díphosphoglycerate in childhood diabetes. Acta Paediatr Seand 64: 355, 1975.
13. Rose Z: Enzymes controlling 2,3-diphosphoglueerate in human crytroeytes. Fed. Proc 29: 1105,1970.
14. Rapoport S. Cuest GM: Distribution of’ acid-soluble phrosphorus in the blood cells of various vertebrates. J Biol Chem 138: 269, 1941.
15. Ditzcl J: Impaíred oxygen telease caused by alterations of the metabolism in the erythrocytes ín diabetes, Lancet l: 721,1972.
16. Dítzel J: Effeet of plasma inorganic phosphate on tissue oxigenatíon during reeovery from diabetic ketoacidosis. Advane Exp Med Biol 37 A: 163, 1973.
17. Ditzel J, Standl E: The problem of tissue oxygenation in diabetes mellitus. 11. Evidence of disordered oxygen release from the erythrocytes of diabetics in various conditions of metabolic control. Acta Med Scand Suppl 578: 59, 1975.
18. Ditzel J, S tandl E: The oxigen transport system of red bloods cells during díabetic ketoacidosis and recovery. Diabetologia 11: 1975.
19. Duhm J: 2.3-DPC-índuced displacement of the oxyhemoglobín dissociation curve of blood: Mechanisms and consequences. In: Oxygen transport to tissue (eds 11.J.Bieher & D.F. Bruley) p. 179. New York Plcnum Publíshing Corporatíon 1972.
20. Keitt AS. Pyruvate kínase dcficíeney and related disorders of red cell glyeolysis. Am J Med 41: 762, 1966.
21. Rose Z• En/lymes controllíng 2.3-díphosphoglycerate in human crythrocytes. Fed Proc 29: 1105.1970.
22 Rapopon S. Maretzí D. Schcwe C: Control of glycolysis in the crythrocyte on the level of 1,3-DPG Oxygen affiníly of hacmoglobin and red cell acíd base status (ed M. Rorth and P. Astrup), p 527. Copenhagen. Munksgaard. Acad Press New York. 1972.
23 Lefant C. lorrance J. Inghsh F. . l-Funch CA. Reynalaje C. Ramos .J. Effect of .I• 1•lket of altitude on oxigen bínding by hemoglobm and on organic phosphate levels, .J Clin Invest- 47: 2652.1968
24 Lenfant C.lorrnce J.. Rey nafarje C. Shift of the 02-llb Dissociation curve at altitude. Mechanism and effect J Appl Physiol 30: 625.1971
25. Spieer KM. Allen RC. Hallet D. Buse MG:Synthesis of hemoglobin A1e and related minor hemoglobins by enthrocytes. In vtro study of regulatíon. J Clín Invest 64: 40.48. 1979
26. Bunn HF. Gabbay KII. Gallop PM: -The glycosylatíon of hemoglobín: Relevance to diabetes mellítus. Science 200:21-27,1978.
27. Bunn HF, Haney DN. Kamin S, Gabbay KIl, Gallop PM. The biosynthesis of human hemoglobín A lc. Slow glycosylation of hemoglobin ín vivo. J Clin Invest 57: 1652-1659, 1976
28. Matthew JB. Morrow JS, Wíttebort RJ. Gurd FRN Quantítatíve determínatíon of carbamo adducts of alpha y betha chaíns ín homan adult hemoglohín ín presence and absence of carbon monoxíde and 2.3-diphosphoglycerate J Bíol Chem 252: 2234-2244, 1977
29. Lec C, Manníng JM The kinctics of the carbamylation of the amino groups of síckle cell hemoglobin . .J Bíol Chem 248 5861-5865, 1973.
30. Dulm J: Studies of 2.3-díphosphoglycerate J:ffecls on hemoglobin, glycolysls. and on buffering propertlcs of human crythrocyte. In I: rytbrocyte Structure and Funetion. GJ. Brewer. edítor. Alan R. Liss. Inc .. New York. 167-197.
31. Fluckíger R. Watererhalter K.II.: In vítro synthesis of hemoglobin A 1c. Fed Eur Bíoehem Soc I.elt 71 356- 360. 1976.
32. Stevens VJ. Vlassara II. Abati A. Ceranc A Nopen/yme glycosylation of Hemoglobin J Bíol Chem 252 2998-3002. 1977
33. Ditzel J. and Poulsen. J.F. (Edítors): Díabetíc Micro Angíopathy. A Lindgren & Soner AB, Molndal 1975
(*) Asociación Colombiana de Diabetes. Trabajo patrocinado por COLCIENCIAS.

