CAMILO HERNÁNDEZ DE ALBA, M.D.
1. Tamizaje Bioquímico de cromosopatías
A.Triple Marcador
Alfa Feto Proteína.
Gonadotrofina Coriónica Humana.
Estriol no conjugado.
B. Marcadores de Primer Trimestre:
- SP- 1
- Free Beta HCG
- PAPP-A
- Inhibina A
UGP ( Péptido gonadotrófico urinario )
2. Tamizaje ecográfico de cromosopatías y defectos estructurales
A. Ecografía 10-14 semanas
Determinación de la Translucencia Nucal.
Valoración anatómica fetal. ( Defectos mayores )
B. Ecografía 18-22 semanas
Marcadores ecográficos de cromosomopatía.
Detalle anatómico fetal.
C. Ecografía Tridimensional
- Evaluación de la superficie fetal (macizo facial, extremidades, genitales).
- Evaluación del esqueleto fetal.
- Mediación de volumen (peso fetal, líquido amniótico y placenta).
- Confirmación de la presencia de anomalías.
- Evaluación de la extensión y severidad de la malformación presente.
3. Diagnóstico Prenatal en células fetales circulantes en sangre materna
B. invasivas
1. BIOPSIA DE VELLOSIDAD CORIAL.
2. EMBRIOFETOSCOPIA.
3. AMNIOCENTESIS PRECOZ CON AMNIOFILTRACION.
4. AMNIOCENTESIS CLASICA.
5. CORDOCENTESIS.
6. CARDIOCENTESIS.
7. BIOPSIA FETAL.
8. CELOCENTESIS.
9. LAVADO TRANSCERVICAL.
10. DIAGNOSTICO PREIMPLANTACION.
A. Técnicas no invasivas de diagnóstico Prenatal
1. Tamizaje Bioquímico de Cromosopatías
Hasta hace pocos años el criterio fundamental para establecer el riesgo de anomalía cromosómica fetal en una determinada gestación, era la edad de la madre ; con base en la relación existente entre la edad materna y el riesgo de Síndrome de Down y otras trisomías.
Se estableció entonces la ” edad mágica ” de los 35 años para ofrecer técnicas invasivas debido a que a esta edad se equilibra el riesgo de pérdida fetal secundario al procedimiento y el riesgo de alteración cromosómica, y el otro factor que influyó en establecer la edad de los 35 años fué el resultado de los estudios costo-beneficio, que establecían esta como la edad por debajo de la cual el ” beneficio ” es inferior al costo (81,82) .Con esta política de acción se logran identificar el 30 % de los fetos con Síndrome de Down con una tasa de falsos positivos del 10 %. Este bajo índice de detección estimuló el estudio de otras alternativas de tamizaje.
La utilización de la alfa fetoproteína en suero materno ( AFPSM ), fué el primer intento que se realizó para incrementar los índices de detección de la trisomía 21, basándose en la observación de que los niveles en sangre materna de mujeres portadoras de fetos con síndrome de Down eran más bajos si se comparaban con las mujeres portadoras de fetos cromosómicamente normales (83).
La idea de encontrar criterios adicionales para dar una mayor precisión a la estimación de ” riesgo ” se hizo inmediatamente atractiva, dada la escasa eficacia obtenida con la aplicación de la edad como único criterio de ” screening “.
Los estudios prospectivos combinando AFSM y edad materna (84), una vez demostrado que ambas se comportaban como variables independientes en gestantes menores de 35 años y utilizando un ” cut – off ” de riesgo de 1:270, mostraron índices de detección comparables a los obtenidos utilizando sólo el criterio de la edad.
A partir de este hallazgo se investigaron otros “marcadores” séricos maternos, entre ellos la gonadotrofina coriónica (HCGSM) que mostraba niveles más elevados (85) y el estriol no conjugado (uE3SM) niveles más bajos (8) con capacidad discriminativa en presencia de fetos con síndrome de Down en segundo trimestre.
La no dependencia de las variables ( edad,AFPSM,HCGSM y uE3SM ) era importante dado que, de lo contrario, en la práctica se detectarían los mismos casos de síndrome de Down utilizando distintos marcadores. Esto permitió su integración en un análisis de regresión multivariado que se difundió como “triple screening o triple marcador ” para la estimación del riesgo individual para el síndrome de Down.
La estimación del riesgo en una determinada gestante se hace multiplicando el riesgo asociado a su edad para la edad gestacional específica ( conocido por estudios epidemiológicos ) (87,88), por el índice de probabilidad derivado de los niveles séricos de cada marcador. Con esta estrategia aplicable a cualquier edad, se logró incrementar el índice de detección al 60 % asumiendo un 5 % de falsos positivos ( amniocentesis realizadas en fetos no afectos de síndrome de Down ) y utilizando un “cut off ” de 1:270.
La experiencia acumulada para el segundo trimestre demuestra que la adición de la HCGSM aumenta la sensibilidad del screening para el síndrome de Down cuando se combina con la edad materna. Aunque estudios recientes sugieren (89), que la utilización de la fracción libre de la B-HCG tendría mayor capacidad discriminativa dados los valores medios de los Múltiplos de la Mediana (MoM ) para esta fracción en presencia de síndrome de Down, comparados a la de la HCG total.
Otros estudios indican menor índice de falsos positivos y mayor detección de otras anomalías cromosómicas con la utilización de la HCG intacta (90).
El papel del uE3SM ha sido puesto en duda en estudios más recientes (91,92) indicando que no añade sensibilidad y aumenta el costo y los falsos positivos, por lo que se ha tendido a abandonar su utilización.
Las bases fisiológicas (96) que motivaron su utilización son las siguientes:
Alfa Fetoproteina ( AFP ) es una glicoproteína de PM 70.000 D, cuya secuencia de aminoácidos presenta una homología del 40 % con la albúmina. Se sintetiza inicialmente en el saco vitelino y posteriormente en el hígado fetal. Su concentración en sangre fetal aumenta hasta alcanzar un máximo de 300 mg/100ml a las 10-13 semanas de embarazo. A partir de este momento, disminuye progresivamente a menos de 100 mg/100ml a término y sigue disminuyendo hasta los 5 mg/100ml a los 2 años de edad, permaneciendo en estos niveles hasta la vida adulta.
La AFP puede migrar de la circulación fetal a la materna a través de dos mecanismos:
1. Difusión transplacentaria
2. Difusión transamniótica desde la orina fetal.
La concentración en sangre materna es cinco veces inferior a la fetal y va aumentando durante el segundo trimestre debido al incremento de la permeabilidad placentaria. Podemos encontrar por lo tanto aumento de la AFP sérica materna por defectos de la barrera feto-amniótica ( Defectos abiertos del tubo neural , defectos abiertos de la pared abdominal , higroma quístico , teratoma fetal , amputaciones fetales , muerte fetal , síndrome nefrótico fetal ) o por defectos de la barrera placentaria ( Hemorragia feto-materna , tumores o infartos placentarios, placentas hipertróficas o quísticas ). Cualquier mínimo compromiso de la integridad placentaria produce repercuciones importantes en los niveles maternos de AFP, debido al gran gradiente de concentración existente entre el suero materno y el fetal.
La causa menos frecuente de elevación de la AFP en suero materno, es la secundaria a la disminución de la eliminación renal fetal por patología obstructiva o displásica.
Los valores de AFP en suero materno están disminuidos en pacientes portadoras de fetos con Síndrome de Down. Existen diversas etiologías acerca de la causa de esta disminución siendo la más aceptada la propuesta por Cukcle y colaboradores quienes abogan por una disminución de la síntesis hepática fetal.
La concentración de AFP en el suero de fetos con trisomía 13, 18 y monosomía X , es más baja que la de fetos cromosómicamente normales. Los valores bajos de AFP en suero materno no son exclusivos por tanto del Síndrome de Down.
La Gonadotrofina coriónica humana ( hCG ):
Es una glicoproteina compuesta por dos subunidades alfa y beta, que pueden circular libres o unidas.La alfa-hCG se sintetiza en el citotrofoblasto y su concentración aumenta desde las semanas 8-10 de embarazon hasta el final . La síntesis de beta-hCG se produce en el sincitiotrofoblasto alcanzando un pico entre las 8-12 semanas de embarazo para disminuir progresivamente hasta alcanzar un valor estable a las 18 semanas.
Se ha visto que los niveles de hCG en madres portadoras de fetos con Síndrome de Down son significativamente más altos. Probablemente estos fetos sufren un retoceso en su desarrollo entre las 7-8 semanas de embarazo, con un retraso de crecimiento de la placenta con lo que produce hCG equivalente a la síntesis de una placenta de un embarazo normal tres semanas más joven.
Los métodos biológicos para reconocer la hCG fueron diseñados para identificar partes de la molécula. Parece ser que la detección es mayor cuando se emplea beta-hCG libre o hCG intacta que cuando se emplea hCG total.
El estriol no conjugado ( uE3 ):
Es una hormona esteroidea sintetizada por el sincitiotrofoblasto a partir de precursores fetales. Todo el contenido de uE3 en suero materno procede de la actividad fetal y placentaria a diferencia del estriol total.
Los niveles de uE3 se encuentran disminuidos en mujeres portadoras de fetos con Síndrome de Down. El mecanismo fisiológico íntimo de la disminución de uE3 en estos embarazos permanece incierto. La síntesis de uE3 depende de la corteza suprarrenal y el hígado fetal por un lado y la placenta por otro. La inmadurez funcional de alguno de los órganos implicados en el circuito de síntesis de uE3 en fetos con síndrome de Down, podría explicar los niveles bajos hallados en suero materno.
Para realizar un tamizaje de cromosomopatías, es necesario tener en cuenta el factor de individualización del riesgo que variará en cada caso en función de una serie de factores fisiológicos que se han de corregir a la hora de hacer el cálculo de riesgo.
El factor más importante es la edad gestacional que debe ser corregida con la edad calculada por ecografía. Los marcadores disminuyen su concentración sérica con el aumento del peso materno y aumentan en la gestación gemelar.
Para la realización del cálculo de riesgo se utilizan los múltiplos de la mediana ( MoM ) de los parámetros bioquímicos. El MoM se obtiene dividiendo la cifra sérica obtenida, entre la mediana para esa edad gestacional a la que se ha realizado la determinación.
Se indicará la conveniencia de una técnica invasiva cuando exista un riesgo con una probabilidad igual o mayor a 1 : 270. Es importante tener en cuenta también los valores individuales de los marcadores bioquímicos antes de su integración en el cálculo combinado.
Existe indicación de técnicas invasivas para estudio de cariotipo fetal ante:
MoM AFP: < 0.5 MoM hCG: > 3
MoM hCG: < 0.2 ( Riesgo de trisomía 18 ) MoM AFP: > 3 ( Riesgo de defecto del tubo neural )
La aplicación del tamizaje bioquímico en segundo trimestre permite detectar el 60 a 65 % de los fetos con síndrome de Down con una tasa de falsos positivos del 5 % .
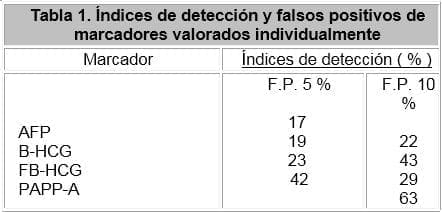
En la búsqueda de la precocidad en el tamizaje de las cromosomopatías, han surgido marcadores bioquímicos en el primer trimestre tales como la free Beta HCG (93), la PAPP-A (94) y la inhibina A (95), que han demostrado indices de detección variables cuando son utilizados individualmente y en combinación, tal y como se observa en las tablas 1 y 2.

Existen distintos factores a tener en cuenta por su influencia en la efectividad de los marcadores séricos maternos y la edad materna aplicados a la detección de anomalías cromosómicas fetales (97).
(Lea También: Tamizaje Ecográfico Secuencial de Cromosopatías)
Distribución de la edad materna en la población general de gestantes
El incremento de mujeres embarazadas de edad avanzada en la última década en la mayoría de paises industrializados, resulta en un aumento de la prevalencia del síndrome de Down y otras aneuploidías dependientes de la edad. Este desplazamiento de edad materna permite asumir, en la aplicación del screening bioquímico, un número de falsos positivos en función de la mayor prevalencia, modificando el cut-off de riesgo combinado para la práctica de un procedimiento diagnóstico.
Selección del ” cut – off “
La selección de un determinado punto como corte de riesgo en el resultado del test pretende alcanzar un equilibrio entre índices de detección y de falsos positivos. En situaciones extremas hipotéticas, la selección de un cut-off muy bajo permitiría virtualmente la identificación del 100 % a expensas de un número elevadísimo de falsos positivos ( procedimientos innecesarios). Por el contrario un cut-off elevado tiende a reducir los falsos positivos, con índices de detección más bajos y mayor número de falsos negativos. El decidir el cut-off es pues una decisión de compromiso en la estrategia de aplicación del programa de screening.
En la aplicación de distintas combinaciones de marcadores, la valoración de su eficacia para la elección del cut-off se hace escencialmente a través de las dos variables finales, índice de detección ( sensibilidad) y el correspondiente índice de falsos positivos.
Exigencias
La aplicación de marcadores bioquímicos exige mantener el rigor metodológico en todo el proceso, incluyendo la información a la gestante de lo que significa el test y su aceptación voluntaria. La determinación ecográfica de la edad gestacional en la que se obtiene la muestra, se considera parte importante en la valoración precisa de los niveles séricos de los marcadores, puesto que los errores pueden conducir a desviasiones en la valoración de los MoM, y por tanto en la estimación del índice de riesgo.
Existen factores de ” screening no fiable ” como hemorragia feto materna con aumento de AFPSM o embarazo gemelar, que pueden obscurecer el resultado y estimación de riesgo en el cálculo integrado. El informe que llega al clínico debe ser explícito mostrando, además del índice de riesgo, los valores individuales de los marcadores, expresados en MoM de los de referencia para cada laboratorio y haciendo notar desviaciones anormales tales como elevaciones de AFP mayor de 2,5 MoM o disminución de HCG menor de 0.2 MoM, que indican estudio ecográfico detallado ante la posibilidad de otras anomalías como DTN o trisomía 18 respectivamente o, en general, un pronóstico perinatal adverso asociado a elevaciones inexplicables de AFP.
Limitaciones
Sin duda,el test ideal de screening ( índice de detección del 100 % sin falsos positivos ) no existe y una de las limitaciones intrínsecas es la existencia de falsos negativos.
En la elección de alternativas y desde una perspectiva estríctamente ética, parece más razonable la elección de la estrategia que, además de un menor índice de falsos negativos, permita una opción diagnóstica a todas las gestantes independientemente de su edad. Otra limitación, no resuelta todavía en la combinación de los marcadores séricos a la edad, es el de los embarazos gemelares, puesto que la contribución de dos fetos y dos placentas modifica notáblemente los niveles de los marcadores serológicos.