Metabolismo Mineral en Fisiología Endocrina
Calcio
El cuerpo de un adulto contiene aproximadamente un poco más de un kilo de calcio, 99% dentro de los cristales de hidroxi-apatita presentes en los huesos. Alrededor de un gramo se encuentra en los líquidos extra-celulares y a pesar del enorme depósito de calcio en el tejido óseo, de las amplias variaciones en ingesta y excreción, la cantidad de calcio ionizado se mantiene constante por el control logrado por sistemas hormonas calcio tróficos.
El calcio en el plasma de presenta en tres estados, un 46% ligado a proteína (principalmente albúmina), que sube y baja de acuerdo con la concentración plasmática de proteínas totales y no tiene actividad biológica.
El 54% restante está formado por el calcio ionizado –biológicamente activo- y una pequeñísima fracción correspondiente a calcio ligado a aniones monovalentes del tipo fosfato, citrato, etc. que además de ser inactivo no es capaz de reabsorberse a nivel del túbulo renal, por lo que se pierde en la orina.
La absorción del calcio es primordialmente en el duodeno y parte alta del yeyuno:
Se aumenta por la vitamina D y también cuando hay hipocalcemia, se administra parathormona, cuando el medio intestinal es ácido, en presencia de hormona del crecimiento o de cantidades adecuadas de fosfato en la dieta; un exceso de fosfato inorgánico no digerible, álcali, cortisol y exceso de ácidos grasos, disminuyen su absorción.
Al ingerir un gramo de calcio se segregan 600 mg en los jugos intestinales, se absorben 700 y se pierden en las heces 900 mg, dando un ingreso neto de 100 mg de calcio.
Después de absorberse se incorpora al pool extra-celular, manteniénd0se en constante intercambio con el hueso, filtrado glomerular y líquido intra-celular.
El filtrado glomerular excreta unos 10 g de calcio, pero un 99% de este se reabsorbe, perdiéndose sólo 100 mg en la orina de 24 horas; la excreción e mayor si los niveles plasmáticos suben, pero aun en hipercalcemias severas, la calciuria rara vez pasa de 500 mg diarios.
Los efectos del calcio sobre los procesos celulares son por lo menos de dos clases. El primero, la disminución de la permeabilidad celular por reducción en el flujo de sustancias iónicas y no iónicas a través de las membranas; la hiper-calcemia disminuye entonces el intercambio de sodio por potasio a nivel celular (como en la reabsorción tubular de sodio), lo mismo que la acción de la vasopresina; la hipo-calcemia aumenta la permeabilidad celular y la excitabilidad neuro-muscular, dando lugar la tetania.
Una segunda acción del calcio es la de unir la excitación con la contracción muscular.
Al despolarizarse la membrana por un aumento en el potasio extra-celular, hay una liberación del calcio ligado a la membrana, que activa el proceso de contracción, acción que se antagoniza por el magnesio.
El calcio sirve de puente a la acetil-colina para unir el estímulo y la secreción glandular, y esta a su vez entra a las células de la medula suprarrenal para activar la secreción de catecolaminas. El calcio aumenta la secreción de ácido clorhídrico en el estómago, influye en las acciones del ACTH en la corteza suprarrenal y de la vasopresina en el túbulo contorneado distal.
El potasio y magnesio antagonizan varios efectos del calcio sobre la membrana celular, alterando la hidrólisis del ATP, de ahí que la administración de calcio endovenosos revierta los efectos electrocardiográficos de la hipercalemia.
Fósforo
El plasma y los tejidos blandos contienen del 10 al 20% del fósforo en el organismo y el resto está en los huesos, en forma de cristales de hidroxi-apatita (fosfato tri-cálcico e hidróxido de calcio, combinados).
Una tercera parte del fosfato plasmático es inorgánico y el resto son fosfolípidos. En los tejidos, la concentración de ésteres fosfóricos es mucho mayor que en el plasma. La absorción intestinal de fósforo se facilita con la absorción de calcio, e indirectamente e aumenta por la vitamina D.
La excreción y depuración de fosfato en el riñón depende de factores como niveles séricos, rata de la filtración glomerular, reabsorción tubular y posiblemente secreción tubular., factores que pueden ser modificados por la parathormona y la vitamina D.
Patología
Los adenomas paratiroideos son la causa del hiperparatiroidismo primario (y de la osteitis fibrosa quística generalizada de von Recklinghausen) y la falla renal crónica, la del hiperparatiroidismo secundario.
El hipoparatiroidismo primario es una enfermedad familiar rara que cursa con hipocalcemia con PTH baja, y el secundario resulta de la remoción quirúrgica de las paratiroides, usualmente como una complicación de la tiroidectomía. El pseudo-hipo (con anticuerpos a los receptores de PTH) tienen hipocalcemia y PTH alta.
El carcinoma medular de tiroides cursa con niveles altos de calcitonina como marcador tumoral, pero sin hipocalcemia. El uso crónico de dosis altas de vitamina D lleva a un cuadro de intoxicación, con severa hipercalcemia. La deficiencia de vitamina D causa raquitismo en los niños y osteomalacia en los adultos.
Efectos clínicos de los trastornos de la calcemia
Hipocalcemia
- Tetania clínica, con espasmo carpo-pedal, convulsiones
- Tetania latente
- Parestesias
- Aumento de la irritabilidad neuro-muscular (signos de Chvostek y Trousseau positivos)
- Cataratas metabólicas
- Prolongación del espacio QT
- Acortamiento de los espacios RR
- Disminución de la contractilidad cardiaca
- Atenuación de los efectos digitálicos
- Síntomas tetánicos atenuado por hipocalemia
- Tetania latente en alcalemia causada por hiperventilación, por caída en el calcio ionizado
- En hipocalcemia total asociada con retención de fosfatos (como se ve en la insuficiencia renal crónica) no hay tetania, en parte también por la acidosis
Hipercalcemia
- Síntomas gastro-intestinales (anorexia, náuseas, vómito, dolor abdominal, estreñimiento)
- Síntomas neuromusculares (hipotonía, estupor, coma)
- Cambios electrocardiográficos opuestos a los de la hipocalemia (acortamiento del QT, aumento en los espacios RR).
Enfermedades que cursan con hiperfosfatemia
- Acromegalia
- Falla renal
- Coma diabético no tratado
- Hipo-paratiroidismo
- Hipogonadismo
Enfermedades que cursan con hipofosfatemia
- Hiper-paratiroidismo primario
- Avitaminosis D (raquitismo y osteomalacia)
- Disfunciones tubulares
- Intoxicación por vitamina D
Algunas causas de pérdida ósea y de aparición de osteoporosis
- Edad (disbalance entre reabsorción y formación de hueso)
- Déficit de estrógenos
- Exceso de glucocorticoides
- Hipertiroidismo
- Alcoholismo
- Inmovilización prolongada
- Hipercalciuria
- Tabaquismo
- Trastornos gastro-intestinales
- Algunos cánceres
- Exceso de cafeína
- Factores genético-familiares
- Estructura corporal
- Raza blanca
(Lea También: Fisiología del Testículo)
Terapéutica
El manejo del hiperparatiroidismo primario es quirúrgico, por resección del adenoma paratiroideo. El del hiperparatiroidimo secundario de los renales crónicos es con calcitriol y el hipoparatiroidismo se trata con calcio y vitamina D.
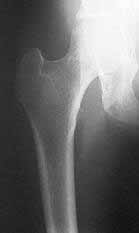
La enfermedad de Paget se maneja con calcitonina, y la osteoporosis, con medidas preventivas, ejercicio, dieta, suplencia de calcio y vitamina D, terapia hormonal de suplencia y bisfosfonatos (Figura 4. La radiografía muestra cuello de fémur osteoporótico).
Historia

Erb, Trousseau y Chvostek describieron signos de la tetania hipocalcémica, Virchow encontró en el hombre las glándulas paratiroides (1863), Erdheim (1906) describe hiperplasia de las paratiroides en casos de raquitismo y osteomalacia, JB Collip llama parathormona a un extracto muy activo de tejido paratifoideo en 1925, Dubois un año después empieza a estudiar el metabolismo del calcio del capitán de mar Charles Martell –quien sufría hiperparatiroidismo primario- que Fue sometido a la primera paratiroidectomía, y al año siguiente Cushing y Davidoff describen un paciente con adenomas endocrinos múltiples.
Fisiología paratiroidea
Pero no fue sino hasta 1929 cuando la fisiología paratiroidea empieza a hacer su aparición con estudios como los de Fuler Allbright quien describió la teoría renal de la acción –fosfatúrica- de la PTH y Koltz en 1933 usa el AT-10 (dihidrotaquisterol) para tratar la tetania. Collip –en 1934- muestra el efecto histológico directo de los extractos paratifoideos sobre los huesos en los animales nefrectomizados y Patt en 1942 demuestra que los niveles de calcio regulan la secreción de PTH.
En 1948 Barnicot mostró que el injerto de tejido paratiroideo adyacente al hueso tiene un efecto descalcificante local y directo y tres años más tarde Chang comprende las relaciones entre el calcio, la PTH y la vitamina D. En 1962 Copp descubre la calcitonina. Pearse –estudioso del sistema APUD- acuña el término de células C del tiroides, productoras de la anterior hormona.
Luego Neer estudia la calcio-cinética con métodos radiactivos y Reiss mide PTH por radioinmuno-análisis; en 1970 Brewer informa la secuencia de aminoácidos de la PTH bovina, y Boyle y De Luca, la síntesis renal de la 1 alfa, 25, dihidroxicolecalciferol, una nueva hormona y en 1971 Aus demuestra que la acción de la PTH se hace a través del segundo mensajero AMPc.
Resumen
La homeostasis del calcio ionizado es el efecto más inmediato de las hormonas calcio-tróficas parathormona, vitamina D (que elevan su concentración) y calcitonina (que lo disminuye). La PTH promueve la osteólisis y es fosfatúrica, la vitamina D favorece la absorción de calcio y la calcitonina es antiosteolítica.
Estas hormonas contribuyen a la regeneración fisiológica del hueso. Avances de la última década se relacionan con la vitamina D y su receptor, análogos de PTH –moduladores de su acción- con utilidad terapéutica en osteoporosis, y proteínas relacionadas con la PTH (con importantes efectos fisiológicos adicionales a la homeostasis del calcio), mientras que la calcitonina ha perdido protagonismo en su papel fisiológico, aunque es clara su utilidad terapéutica como anti-reabsortivo.
Además se ha hecho evidente que el calcio mismo actúa como una hormona, fijándose al receptor que contiene un detector (o sensor) del calcio extracelular.
Referencias
- Ardila E. Epidemiología y patogénesis de la osteoporosis. Rev Col Menop 1997.3: No.1. encolombia.com
- Brown EM. Extracellular Ca2+ sensing, regulation of parathyroid cell function, and role of Ca2+ and other ions as extracellular (first) messengers. Physiol Rev 1991; 71:371-411.
- Iglesias-Gamarra A y cols. Enfermedades metabólicas del hueso (Tomos I y II), 900 páginas. Instituto Nacional de Salud, Bogotá, 1992.
- Iglesias-Gamarra A. Del raquitismo a la vitamina D. 2004 (en prensa).
- Jácome-Roca A. Cronología histórica de las paratiroides. Rev Soc Col Endocrinol 1982. 13. 88-93.
Ramírez J, Jácome A y cols. Problemas diagnósticos del hiperparatiroidismo primario, presentación de cinco casos. Acta Méd Col 1980. 5:395-406. - Manolagas SC et al. Sex Steroids and Bone. Recent Prog Horm Res, 2002; 57(1): 385 – 409.
- Manolagas SC. Birth and death of bone cells, basic regulatory mechanisms and implications for the pathogenesis and treatment of osteoporosis. Endocr Rev 2000; 21:115-137.
- Negri AL. Receptor – Censor de calcio extracelular: su rol en la homeostasis mineral Rev. Nefrol. Diál. y Transpl., N° 43 – Septiembre 1997, Pág. 13-18
- Riggs BL, Khosla S, Melton LJ. Sex Steroids and the Construction and Conservation of the Adult Skeleton. Endocr Rev, 2002; 23(3): 279-302.
- Sutton ALM, MacDonald PN. Vitamin D: More Than a “Bone-a-Fide” Hormone. Molec Endocrinol 2003; 17 (5): 777-791.
- Strewler GH. The physiology of parathyroide hormone-related protein. N Eng J Med 2000. 342: 177-185.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO