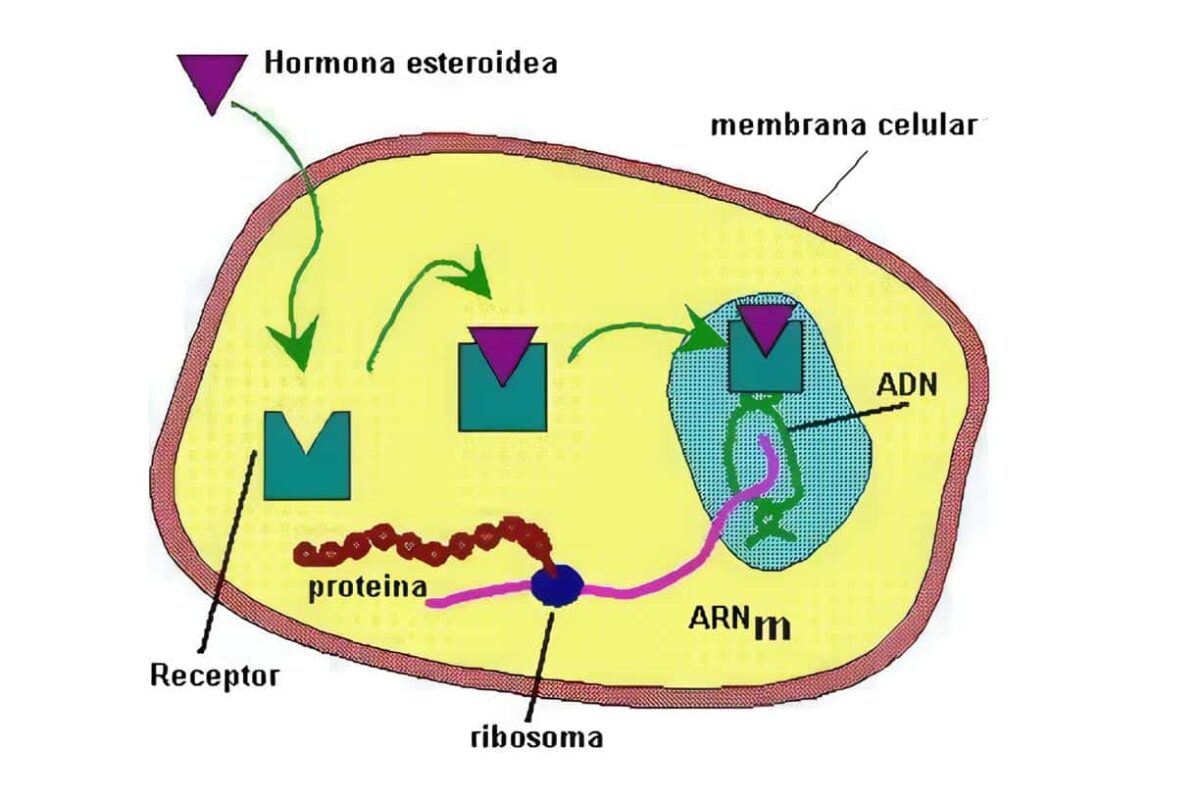
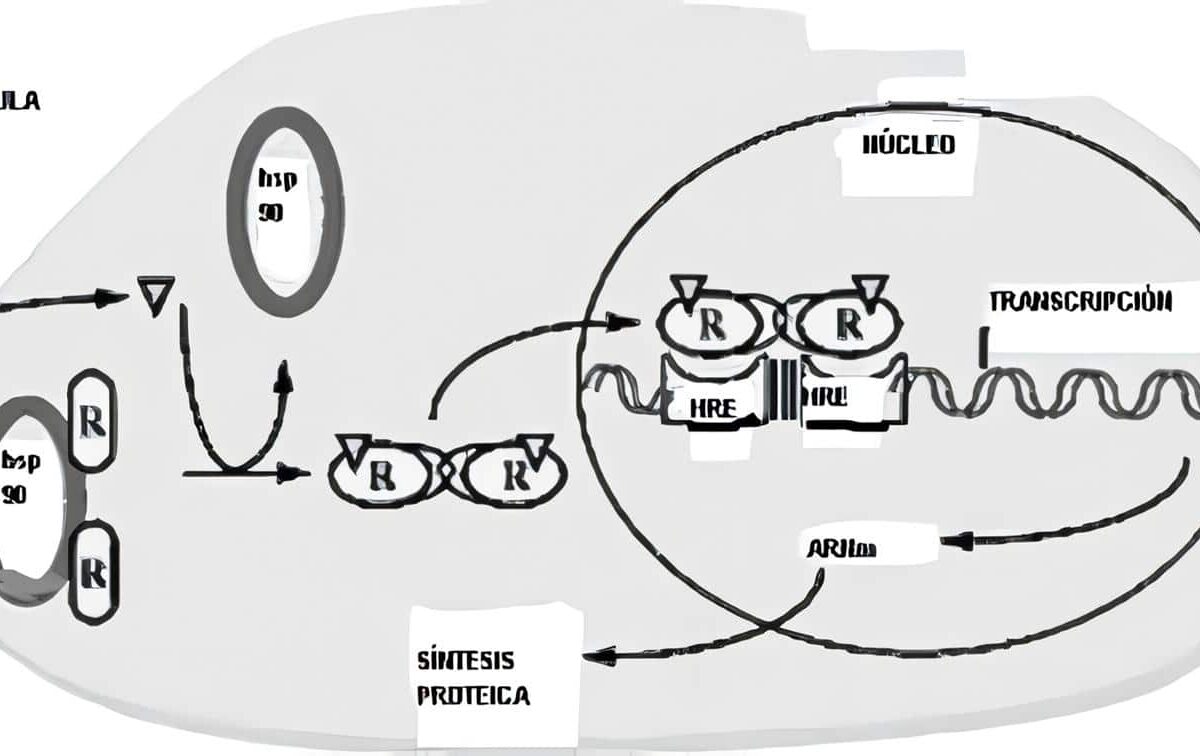
Péptidos ováricos
La célula de la granulosa debe ser entendida como una gran fábrica que además de estrógenos produce una gran cantidad de sustancias. Entre ellas se encuentran las inhibinas, la activina y la folistatina, responsables de colaborar en todo el proceso de retroalimentación. Hay una producción importante de citoquinas, entre las que se pueden citar las prostaglandinas, algunas interleuquinas y el factor de necrosis tumoral alfa. También se sintetizan gran cantidad de factores de crecimiento como los similares a la insulina, el epidérmico y el vascular angiogénico. Además de sustancias proteolíticas se encuentra presente el Factor Inhibidor de la Maduración del Oocito (OMI). De todos estos péptidos poco a poco se ha ido conociendo su función.
Las inhibinas, la activina y la folistatina juegan papel importante en todo el control del ciclo a través de los sistemas de retroalimentación. Tanto la FSH como el IGF-I hacen que la célula de la granulosa produzca de manera paralela estrógenos e inhibinas y el pico de ellas que se alcanza hace que a nivel central se frene la producción de FSH. La folistatina, péptido similar al factor de crecimiento epidérmico ejerce una acción similar a la de las inhibinas, pero su potencia biológica es menor. La secreción de activina es totalmente contraria y su mayor producción se encuentra al final del ciclo y comienzo de uno nuevo y sus papeles fundamentales son estimular la síntesis y secreción de FSH en la hipófisis, así como promover la unión de la FSH a sus receptores en las células de la granulosa.
Factor de crecimiento vascular angiogénico
El factor de crecimiento vascular angiogénico es el responsable de que el folículo pueda adquirir la vascularización adecuada. El factor de crecimiento similar a la insulina tipo II (IGF-II), además de estimular la mitosis se encarga de hacer que la célula de la granulosa sintetice receptores para LH y por ende de él depende la luteinización de la granulosa.
El OMI se encarga de mantener al oocito detenido en su división meiótica. Este factor es inhibido por los niveles elevados de LH, por lo cual se explica que solo hasta poco tiempo antes de la ovulación, cuando aparece el pico de LH, el oocito reanude su división meiótica.
El factor de crecimiento similar a la insulina tipo I (IGF-I) juega un papel fundamental en la esteroidogénesis. En primer lugar es capaz de actuar sobre el receptor de LH en la célula de la teca sensibilizando, de manera que puede garantizar una mayor síntesis de andrógenos. Por otro lado es fundamental en la célula de la granulosa para inducir la aromatasa, de esta manera permitiendo que haya una mayor conversión de andrógenos a estrógenos. Cuando ya la célula de la granulosa ha adquirido receptores para LH favorece la síntesis de progesterona.
(Lea También: Endocrinología del Embarazo y la Lactancia)
Fase Lútea
Se considera la fase más estable dentro del ciclo ovárico. Su duración es bastante constante, cercana a los 14 días. Luego de la ovulación las células de la teca y de la granulosa que han quedado se compactan en una masa única y acumulan gran cantidad de colesterol transportado por las LDL. Esta masa es la que forma el cuerpo lúteo siendo el colesterol el responsable de la tonalidad amarilla que lo caracteriza y que en la antigüedad se creyera que era producida por un pigmento al cual se le dio el nombre de “luteína”. Su principal función es la producción de progesterona. Para la adecuada función del cuerpo lúteo no solo es necesario que haya existido un buen desarrollo folicular con una adecuada vascularización que permita un buen transporte de colesterol, sino que depende de la secreción tónica de LH. La misma LH garantiza que las células del cuerpo lúteo adquieran receptores para LDL. Si todo funciona adecuadamente se garantiza una producción creciente de progesterona que alcanza su pico hacia el día octavo postovulatorio.
De las fases menos conocidas del ciclo en este momento es la lútea.
No se sabe realmente la razón precisa de por qué el cuerpo lúteo está condenado a desaparecer en un tiempo tan corto. Se cree que la producción creciente de progesterona unida a una pequeña síntesis de estrógenos es capaz de frenar la producción hipofisiaria de LH. En el momento en que esta gonadotropina cae se produce la involución del cuerpo lúteo.
Se sabe que en ese momento hay una gran afluencia de células de la línea blanca, especialmente de macrófagos. Ellos producen cantidades grandes de prostaglandinas que conducen a la luteolisis. Una vez deja de funcionar el cuerpo lúteo, cae rápidamente la producción de progesterona y estrógenos, hecho que permite el ascenso en la liberación de FSH y esto marca el comienzo de un nuevo ciclo. La única manera de prolongar la vida del cuerpo lúteo es rescatarlo de la involución en el momento en que aparece una hormona similar a la LH, la gonadotropina coriónica.
El Endometrio
El endometrio es uno de los principales órganos blanco del efecto de las hormonas esteroideas. Está compuesto por una capa basal que sirve de reserva y una capa funcional, encargada de prepararse cada ciclo para recibir un embarazo. Sobre esta capa funcional actúan los estrógenos y la progesterona.
El efecto de estas dos hormonas es diferente sobre las diversas estructuras del endometrio. Es así como los estrógenos inducen la proliferación glandular y de los vasos sanguíneos, mientras que la progesterona estimula de manera preferencial el estroma.
La fase inicial o proliferativa está marcada por la producción creciente de estrógenos en el ovario. Se caracteriza por la proliferación de las glándulas, en las cuales se observa una gran cantidad de mitosis. Además de este efecto, los estrógenos son fundamentales, ya que inducen la aparición de receptores para progesterona en las células endometriales.
Posterior a la ovulación empieza a funcionar el cuerpo lúteo, produciendo gran cantidad de progesterona. Este hecho induce cambios secretores en las glándulas endometriales y permite el crecimiento del estroma. La progesterona juega un papel fundamental en la regulación del endometrio ya que es capaz de inhibir el efecto mitogénico de los estrógenos a través de dos vías. En primer término, disminuye el número de receptores para estrógenos en el endometrio y en segundo lugar activa pasos enzimáticos que conjugan los estrógenos con grupos sulfato o glucorónido, haciéndolos biológicamente inactivos. Además la progesterona es capaz de mantener la estabilidad de la membrana de los lisosomas en las células del endometrio.
En caso de que haya embarazo hay comunicación entre el huevo fecundado y el endometrio:
Haciendo que se presente una serie de cambios morfológicos conocidos como la ventana de implantación y caracterizados por la aparición de podocitos en las células endometriales. La expresión de algunas moléculas de adhesión llamadas integrinas, es la responsable de la apertura y el cierre de la ventana de implantación.
Dado el caso que no haya embarazo y cese la función del cuerpo lúteo, el resultado es la caída en los niveles de estrógenos y progesterona. La disminución en la progesterona hace que se pierda la estabilidad de la membrana de los lisosomas y conduce a liberación de prostaglandinas. Estas citoquinas inducen episodios de vasoespasmo y vasodilatación, cada vez más sostenidos y prolongados que conducen a la ruptura de las glándulas y del estroma, fragmentación, diapédesis hemorrágica y transudación de células de la línea blanca. Este tejido empieza a descamarse y aparece al exterior en la forma de menstruación.
A iniciar un nuevo ciclo, la producción de estrógenos induce nuevamente la proliferación, permitiendo que en el endometrio también se inicie un nuevo ciclo.
Resumen
La gonada femenina –u ovario- tiene funciones reproductoras (la liberación del óvulo maduro o gameto femenino) y endocrinas –la producción de hormonas femeninas y precursores androgénicos.
En la mujer en edad fértil se produce un ciclo aproximadamente mensual que implica un compromiso hipotálamo-hipófisis-ovarios-endometrio-cuello uterino- vagina, es decir, que de acuerdo con el momento en que se encuentre este ciclo ovárico o ciclo menstrual, así serán los cambios en cada uno de estos órganos.
Si consideramos el día que se presenta la menstruación como el primer día del ciclo de veintiocho días, encontraremos que por medio de la GnRH se irán incrementando los niveles de FSH –y poco después los de LH- hasta aproximadamente la mitad del ciclo.
Esto irá madurando el folículo primordial hasta transformarlo en el maduro de De Graaf, produciendo cantidades crecientes de estradiol , lo que induce un endometrio proliferativo que se encuentra listo a recibir el óvulo –si este llega a ser fecundado- para iniciar un embarazo.
En la mitad del ciclo hay un aumento brusco en los niveles estrogénicos y se produce una luteinización por el pico ovulatorio de la LH (que se encuentra aquí cinco veces más alta que la FSH), con cambios en el moco cervical que adquiere una elasticidad llamada filancia, que capacita al espermatozoide para fecundar –generalmente en el tercio externo de la trompa- al óvulo liberado del ovario.
Existen también cambios hormonales en la vagina, cuyas células acumulan glicógeno para la fase ovulatoria.
Si no hay embarazo, caen nuevamente las gonadotropinas, el folículo roto se convierte en cuerpo amarillo secretor de progesterona, que induce cambios en el endometrio –ahora de tipo secretor- hasta que la atrofia de dicho cuerpo lúteo y la caída de los niveles de progesterona inducen el desprendimiento del endometrio y la siguiente menstruación.
En la etapa prepuberal los niveles de gonadotropinas son mínimos mientras que en la menopausia estos niveles aumentan al máximo, debido a la atrofia de la corteza ovárica y la falta de producción estrogénica.
El estrógeno de la vida fértil es el estradiol, el del embarazo es el estriol placentario y el de la menopausia es la estrona, producida por una aromatasa del adiposito, por acción de esta enzima sobre la androstenediona de la medula del ovario. Los estrógenos tienen un efecto anabólico, antiosteoporótico y la progesterona aumenta la temperatura corporal.
Referencias
- Barón G. Fisiología del ciclo menstrual. Fundamentos de endocrinología ginecológica. 1era. Edición. Colombia: Editorial Contacto Gráfico: 1998:44-57.
- Babu PS, Krishnamurthy H, P. Chedrese J, Sairam MR. Activation of extracellular-regulated Kinase Pathways in ovarian granulosa cells by the novel growth factor type 1 follicle-stimulating hormone receptor. J Biol Chemist 2000; 275: 27615-27626.
- Burns KH, Yan C, Kumar TR, Matzuk MM. Analysis of ovarian gene expression in follicle-stimulating hormone _ knockout mice. Endocrinology 2001; 142:2742–2751.
- Chapman SC, Woodruff TK. Modulation of activin signal transduction by inhibin B and inhibin-binding protein (InhBP). Mol Endocrinol 2001; 15:668.
- Conneely OM, Mulac-Jericevic B, Lydon JP, DeMayo FJ 2001 Reproductive functions of the progesterone receptor isoforms: lessons from knockout mice. Mol Cell Endocrinol 179:97– 103.
- Rose UM, Hanssen RGJM, Kloosterboer HJ. Development and characterization of an in vitro ovulation model using mouse ovarian follicles. Biol Reprod 1999; 61:503–511.
- Bergh C., Carlsson B., Olsson JH., et al. Regulation of androgen production in cultured human thecal cells by insulin-like growth factor I and insulin. Fertil Steril. 1993; 59:323.
- Couzinet B., Brailly S., Bouchard P., et al. Progesterone stimulates luteinizing hormone secretion by acting directly on the pituitary. J Clin Endocrinol Metab. 1992; 74:374.
- El-Roeiy A., Chen X., Roberts VJ., et al. Expression of insulin-like growth factor-I (IGF-I) and IGF-II and the IGF-I, IGF-II, and insulin receptor genes and localization of the gene products in the human ovary. J Clin Endocrinol Metab. 1993; 77:1411.
- Reddi K., Wickings EJ., McNeilly AS., et al. Circulating bioactive follicle stimulating hormone and immunoreactive inhibin during the human menstrual cycle. Clin Endocrinol. 1990; 33:547.
- Tilly JL., Kowalsky KI., Schomberg DW., et al. Apoptosis in atretic ovarian follicles is associated with selective decreases in messenger ribonucleic acid transcripts for gonadotropin receptors and cytochrome P450 aromatase. Endocrinology. 1992; 131:1670.