Dr. Germán Barón Castañeda, M.D.
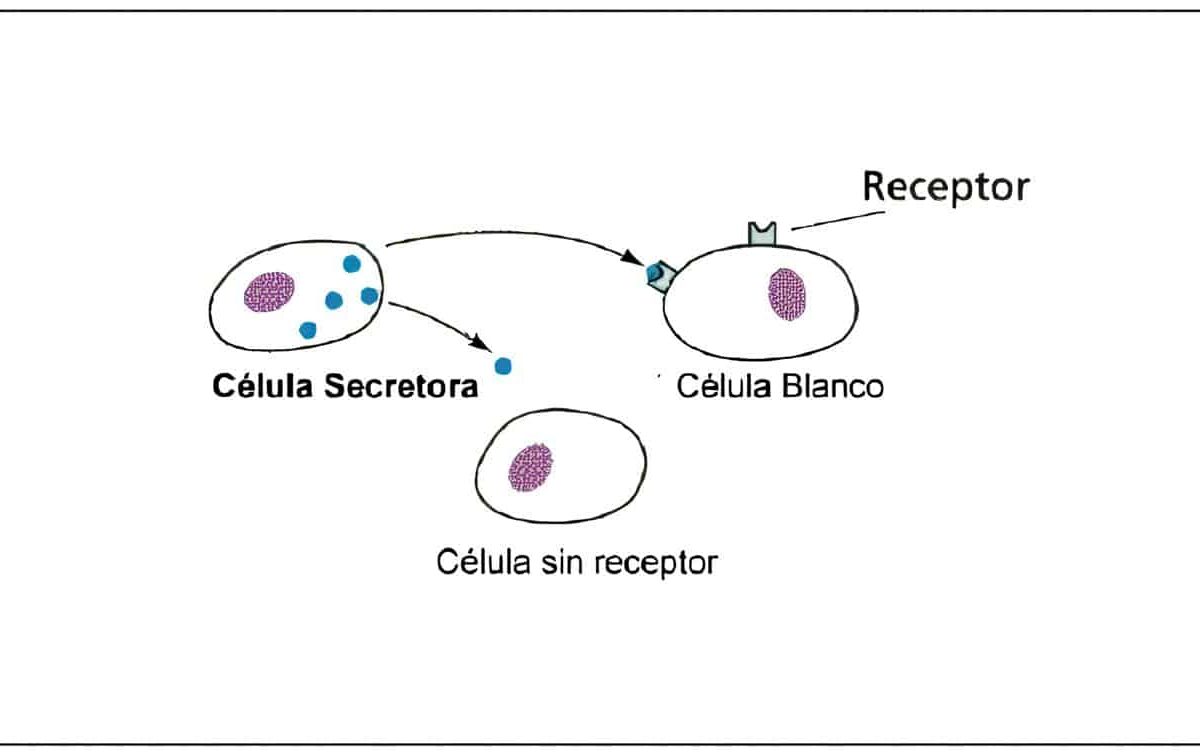
El útero es un órgano compuesto por tejidos complejos que sirven como fuente de productos autocrinos y paracrinos que no solo actúan sobre sus propias células, sino también sobre la unidad feto-placentaria durante el embarazo. La presencia de receptores es variable a lo largo del ciclo.
La expresión de receptores en las diversas partes del endometrio es variable a lo largo del ciclo. En las glándulas y el estroma, tanto los receptores para estrógenos como los de progesterona, van aumentando a lo largo de la primera fase del ciclo, alcanzando su máximo en la fase proliferativa tardía cerca al momento ovulatorio.
Disminuyen en forma progresiva durante la fase secretora. En las células epiteliales los receptores de progesterona son prominentes durante la fase proliferativa y son casi indetectables durante la secretora.
En el miometrio se encuentra gran cantidad de receptores para progesterona a lo largo de todo el ciclo. Se han encontrado también receptores androgénicos en cantidades constantes durante el ciclo, en la post-menopausia y en la decidua del embarazo.
Estudios recientes sugieren que el potencial de desarrollo que tiene el endometrio no depende sólo de la progesterona sino de una adecuada relación estrógeno/progesterona y de la concentración presente de cada una de estas hormonas.
Tanto los estrógenos como la progesterona tienen efectos complementarios:
Pero diferentes en el grado de diferenciación de las glándulas y el estroma y en forma individual afectan la secuencia temporal de los eventos de la fase lútea sobre los distintos tipos de células.
Los estrógenos durante la fase post-ovulatoria están implicados principalmente en el desarrollo glandular, mientras que la progesterona actúa sobre el estroma.
Por lo tanto, un endometrio secretor normal es el resultado de los efectos balanceados de estas dos hormonas.
Las anormalidades en la diferenciación del endometrio pueden resultar de dos tipos de imbalance hormonal: la cantidad excesiva, sea de estrógenos o de progesterona inhibe los efectos de la otra hormona; en forma similar cantidades inadecuadas de una hormona llevan a una expresión excesiva de los efectos de la otra.
Cuando se mantiene una adecuada relación de estrógenos y progesterona pero la cantidad de cada una de las hormonas es elevada, predomina el efecto de la progesterona; cuando la cantidad total de cada una de las hormonas es baja, predomina el efecto de los estrógenos.
 Figura 4.1 Efectos de las hormonas sobre el endometrio
Figura 4.1 Efectos de las hormonas sobre el endometrio
La mayor parte de las acciones endocrinas del útero no está aún bien definida. Se postula que uno de sus papeles fundamentales es alterar la respuesta inmune dentro del útero gestante.
Los factores de crecimiento son mitógenos potentes y en el endometrio se encuentran en grandes cantidades durante la fase proliferativa. Los estrógenos estimulan la expresión de los genes del factor de crecimiento epidérmico y del similar a la insulina. El epidérmico tiene la capacidad de ocupar los receptores estrogénicos; en conjunto con la progesterona aumenta en forma importante el número de células epiteliales.
El factor de crecimiento de transformación-a es un potente mitógeno presente especialmente durante la fase proliferativa; en conjunto con el estradiol estimula la proliferación de las células epiteliales y del estroma. No es extraña la presencia de citoquinas, ya que el útero es un órgano que sufre una degeneración cíclica.
Los factores de crecimiento similares a la insulina tienen un patrón de expresión controlado por los estrógenos y la progesterona. El IGF-I predomina durante la fase proliferativa y al inicio de la secretora, mientras que el IGF-II está presente en la fase folicular tardía y en la decidua.
Se ha demostrado que los estrógenos bloquean la expresión de la Interleuquina-6 por las células estromales; esto permite que actúen los factores de crecimiento y por lo tanto se presenta la proliferación celular.
(Lea También: Síndrome de Anovulación Crónica)
Las proteínas fijadoras de estos factores de crecimiento son secretadas por el endometrio; de ellas vale la pena destacar la IGFBP-1. Su síntesis es controlada por factores como la progesterona, la insulina y los factores de crecimiento similares a la insulina.
Su acción, aunque no bien establecida, parece ser el control de la expresión del IGF-I en el endometrio y el trofoblasto; posiblemente estimula la migración celular uniéndose al receptor de fibronectina. Sus niveles aumentan en el suero y el líquido amniótico durante el embarazo.
Otros factores menos estudiados son el factor de crecimiento derivado de plaquetas, mitógeno para las células del estroma; aunque no se ha demostrado que existan variaciones cíclicas en su concentración, el número de sus receptores es mayor durante la fase proliferativa.
El factor de crecimiento fibroblástico actúa sobre las células endoteliales de los capilares promoviendo su proliferación; no tiene variación durante el ciclo.
El factor de crecimiento de transformación-b se encuentra en las glándulas y en el estroma. Su concentración es mayor durante la fase proliferativa y el embarazo. Al parecer su principal acción es inhibir la proliferación celular en períodos en los cuales está ocurriendo la diferenciación. Al promover la diferenciación del citotrofoblasto a sincitiotrofoblasto puede contribuir a inhibir la invasión trofoblástica. Además induce el activador de plasminógeno.
Las prostaglandinas son producidas por las células epiteliales y del estroma, alcanzando un pico máximo en la fase secretora tardía; la que se produce en mayor cantidad es la F2a que es un estimulador potente de la contracción miometrial. Su cantidad se reduce en forma significativa después de la implantación, lo cual sugiere que hay un mecanismo importante de control para su supresión.
La producción de prostaglandinas requiere un soporte estrogénico, posiblemente aumentado por la progesterona; la supresión aguda de progesterona promueve su incremento. El miometrio produce principalmente prostaciclina utilizando precursores derivados del endometrio.
Las células epiteliales y del estroma también secretan fibronectina, acción suprimida por la progesterona. Posiblemente esta supresión reduce la capacidad de la fibronectina de unirse a los proteoglicanos de heparan-sulfato, acción importante en la unión del embrión.
Las células epiteliales producen uteroglobina, proteína que se une a los progestágenos y posiblemente juega papel en la inmunosupresión; la expresión de su gene está regulada por los estrógenos. Otro factor que puede jugar papel en la inmuno-regulación es la b-endorfina; su liberación es inhibida tanto por los estrógenos como por los glucocorticoides.
La endotelina-1 es un vasoconstrictor potente; su actividad está balanceada por el estímulo en la producción del factor de relajación derivado del endotelio y prostaciclina. Su síntesis en el endometrio es estimulada por el factor de crecimiento de transformación-b y por la interleuquina-1a.
Puede ser uno de los factores responsables de la vasoconstricción necesaria para frenar el sangrado menstrual. Es también un inductor de contracciones uterinas y puede jugar papel en la dismenorrea. Además es mitógeno y puede promover la reepitelización del endometrio.
Existen también las mucinas, productos glucoprotéicos de alto peso molecular ricos en mucopolisacáridos; son producidas por las células epiteliales hacia la luz de las glándulas durante la fase lútea, su acción es desconocida.
Diversas citoquinas también son expresadas en el endometrio. Entre ellas se pueden citar la interleuquina-1, presente en las células epiteliales, endoteliales, linfoides y del estroma; su concentración es mayor durante la fase secretora. Se postula su importancia durante la menstruación al inducir la producción de prostaglandina E2 y posiblemente es un factor importante durante la implantación. El interferon-g juega papel importante en la respuesta inmune al embarazo; induce la expresión de moléculas del HLA-DR e inhibe la proliferación del epitelio.
Existe otra serie de péptidos y proteínas producidos en el útero. Entre ellos se pueden citar la proteína endometrial asociada a progesterona (proteína placentaria 14 o PP-14), secretada por el epitelio glandular y la decidua; se encuentra también en el líquido amniótico y en la circulación. Son dos sus posibles acciones: actúa como globulina transportadora y ser responsable en parte de la inmunomodulación, pues se ha demostrado que es capaz de inhibir el cultivo mixto de linfocitos.
La proteína endometrial asociada con el embarazo a-1 (proteína placentaria 12 o PP-12) tiene una estructura similar a una proteína fijadora del IGF-I. Parece ser responsable de la regulación del crecimiento y la invasión del trofoblasto. En el endometrio decidualizado también se ha encontrado la presencia de CA-125 sin que se haya establecido su función.
Otros factores producidos por el endometrio y posiblemente regulados por factores hormonales son el activador de plasminógeno, la relaxina, la renina, la anhidrasa carbónica y la lactoferrina.
TABLA 4.1
Proteínas de la fase secretora
PROTEÍNA |
CÉLULA DE ORIGEN |
FUNCIÓN PROPUESTA |
PP-14 |
Epitelio glandular | Inmunosupresor |
IGFBP-1 |
Célula decidualizada del estroma | Regula acción IGF; modula invasividad del trofoblasto |
Proteínas de la matriz extracelular |
Epitelio glandular y células decidualizadas del estroma | Interacción matriz extracelular y trofoblasto |
Integrinas |
Epitelio glandular y células decidualizadas del estroma | Interacciones célula-matriz extracelular y célula-célula |
Prolactina |
Célula decidualizada del estroma | Osmoregulación dellíquido amniótico; regulación de síntesis de surfactante pulmonar; tocolítico; inmunosupresor |
Relaxina |
Célula decidualizada del estroma | Estimula la actividad de la aromatasa del estroma; ruptura del colágeno |
CA-125 |
Epitelio glandular | Desconocida |
Uteroglobina |
Célula decidualizada del estroma | Síntesis de prostaglandinas |
PAPP-A |
Epitelio glandular | Desconocida |
Mucinas |
Epitelio glandular | Desconocida |
Renina |
Célula decidualizada del estroma | Desconocida |
Lactoferrina |
Epitelio glandular | Desconocida |
Estudios recientes en ratas han mostrado que una de las proteínas necesarias para la implantación es el factor inhibidor de la leucemia (LIF). Aún es desconocido su papel en el embarazo humano, pero se sugiere que puede ser requisito indispensable para que exista implantación.
Muchas de las proteínas de la matriz extracelular tienen la secuencia de aminoácidos arginina-glicina-aspartato. Se ha sugerido que esta secuencia es fundamental para que exista implantación y crecimiento inicial del trofoblasto. Dentro de estas proteínas las más estudiadas hasta el momento son las integrinas, cuya expresión es mayor en el endometrio durante la ventana de implantación.
La Decidua
La decidua es el endometrio especializado del embarazo; es un tejido activo en el intercambio bioquímico entre la madre y la unidad feto-placentaria.
Las células de la decidua se derivan de las células del estroma del endometrio bajo el estímulo de la progesterona. Aparecen al final de la fase lútea y comienzo del embarazo y llegan a tapizar toda la superficie de la pared uterina.
Su principal característica histológica es la presencia de pliegues en el epitelio y la distensión de las células con un citoplasma claro; las células desarrollan núcleos agrandados e hipercromáticos; estos cambios son conocidos como la reacción de Arias-Stella.
La función de las células deciduales consiste en acumular glucógeno y vacuolas lipídicas, además de ser el sitio de expresión de varias sustancias entre las cuales se encuentran la prolactina, la relaxina, la renina y los factores de crecimiento similares a la insulina. Estos péptidos no son liberados hacia la circulación y su efecto es local.
La síntesis de la prolactina es regulada por la placenta, las membranas y factores deciduales.
A diferencia de la producida en la hipófisis, sobre ella no ejercen ningún control la dopamina, la bromocriptina y la TRH. Se han encontrado en la placenta un factor liberador y uno inhibidor.
Se cree que la prolactina es producida en las células deciduales. En el líquido amniótico alcanza niveles pico en la primera mitad del embarazo, llegando a 4,000 ng/ml. Se piensa que puede intervenir en la regulación del volumen de líquido amniótico y su contenido de electrolitos. Puede actuar también en la producción de surfactante a nivel pulmonar y en el miometrio disminuyendo su contractilidad. También es un factor que suprime la respuesta inmune.
En la decidua hay factores angiogénicos, importantes para el crecimiento de vasos sanguíneos en el embarazo temprano. Entre ellos se pueden citar el factor de crecimiento fibroblástico y otro factor estimulador del endotelio.
Se encuentran, además, concentraciones elevadas de proteínas fijadoras del factor de crecimiento similar a la insulina (IGFBP), especialmente la tipo 1, conocida antiguamente como proteína endometrial 12 o globulina- a asociada al embarazo. Su función no está esclarecida totalmente pero parece actuar sobre la expresión de insulina y factores de crecimiento.
Referencias
- Aplin JD., Charlton AK., Ayad S. An immunohistochemical study of human endometrial extracellular matrix during the menstrual cycle and first trimester of pregnancy. Cell Tissue Re. 1988; 253: 231.
- Bell SC. Secretory endometrial and decidual proteins: studies and clinical significance of a maternally derived group of pregnancy-associated serum proteins. Hum Reprod. 1986; 1: 129.
- Bell SC. Decidualization and insulin-like growth factor binding protein: implications for its role in stromal cell differentiation and the decidual cell haemachorial placentation. Hum Reprod. 1989; 4: 125.
- Benedetto MT., Tabanelli S., Gurpide E. Estrone sulfate sulfatase activity is increased during in vitro decidualization of stromal cells from human endometrim. J Clin Endocrinol Metab. 1990; 70: 342.
- Cañez MS., Lee KJ., Olive DL. Progestgens and estrogens. Infertil Reprod Cl NA. 1992; 3: 1: 59-78.
- Carr BR. The normal menstrual cycle. En Carr BR., Blackwell RE. Textbook or reproductive medicine. Ed. Appleton & Lange (1a). 1993: 209-219.
- Christiaens GCML., Sizma JJ., Haspels AA. Morphology of hemostasis in menstrual endometrium. Br J Obstet Gynecol. 1980; 87: 425-439.
- Christiaens GCML., Sixma JJ., Haspels AA. Hemostasis in menstrual endometrium: a review. Obstet Gynecol Survey. 1982; 37: 281.
- Clark JH. Mechanism of action of steroid hormones and antagonists. Infetil Reprod Cl NA. 1992; 3: 1: 7-20.
- Economos K., Mac Donald PC., Casey ML. Endothelin-1 gene expression and protein biosynthesis in human ndometrium: potential modulator of endometrial blood flow. J Clin Endocrinol Metab. 1992; 74: 14.
- Edman CD. The effects of steroids in the endometrium. Seminars Reprod Endocrinol. 1983; 1: 79.
- Eldering JA., Nay MG., Hoberg LM., et al. Hormonal regulation of prostaglandin production by Rhesus monkey endometrium. J Clin Endocrinol Metab. 1990; 71: 596.
- Flowers CE., Wilborn WH. Cellular mechanisms for endometrial conservation during menstrual bleeding. Semin Reprod Endocrinol. 1984; 2: 307-341.
- Giudice LC. Overview of the endometrium in reproductive medicine. Infertil Reprod Med Clin NA. 1995; 6: 2: 263-280.
- Giudice LC., Dsupin BA., Jin IH., et al. Differential expresion of messenger ribonucleic acids encoding insulin-like growth factors and their receptors in human uterine endometrium and decidua. J Clin Endocrinol Metab. 1993; 76:1115.
- Giudice LC., Dsupin BA., Irwin JC. Steroid and peptide regulation of insulin-like growth factor binding proteins secreted by human endometrial stromal cells is dependent on stromal differentiation. J Clin Endocrinol Metab. 1992; 75:1235.
- Handwerger S., Richards RG., markoff E. The physiology of decidual prolactin and other decidual protein hormones. Trend Endocrinol Metab. 1992; 3: 91.
- Hansard LJ., Walmer DK. Descriptive histology: the gold standard for clinically evaluating the endometrium. Infertil Reprod Med Clin NA. 1995; 6: 2: 281-292.
- Heffner LJ., Iddenden DA., Lyttle CR. Electrophoretic analyses of secreted human endometrial proteins: identification and characterization of luteal phase prolactin. J Clin Endocrinol Metab. 1986; 62: 1288. Hofmann GE., Scott RT., Bergh PA., et al. Immunohistochemical localization of epidermal growth factor in human endometrium, decidua, and placenta. J Clin Endocrinol Metab. 1991; 78: 882.
- Holinka CF., Gurpide E. Diamine oxidase activity in human decidua and endometrium. Am J Obstet Gynecol. 1984; 150: 359.
- Horie K., Takakura K., Imai K., et al. Immunohistochemical localization of androgen receptor in the human endometrium, decidua, placenta and pathological conditions of the endometrium. Hum Reprod. 1992; 7: 1461.
- Huang JK., Tseng L., Bihof P., et al. Regulation of prolactin production by progestin, estrogen and relaxin in human endometrial cells. Endocrinology. 1987; 121: 2011.
- Ignar-Trowbridge DM., Nelson KG., Bidwell MC., et al. Coupling of dual signaling pathways: epidermal growth factor action involves the estrogen receptor. Proc Natl Acad Sci USA. 1992; 89: 4658.
- Jacobs I., Bast RC. The CA 125 tumor-associated antigen: a review of the literature. Human Reproduction. 1989; 4:1.
- Joshi SG. A progestagen-associated protein of the human endometrium: basic studies and potential clinical applications. J Steroid Biochem. 1983; 19: 751.
- Jost A., Vigier B., Prepin J., et al. Studies on sex differentiation in mammals. Recent Prog Hormo Res. 1973; 29: 1.
- Kubota T., Kamada S., Hirata Y., et al. Synthesis and release of endothelin-1 by human decidual cells. J Clin Endocrinol Metab. 1992; 75: 1230.
- Lessey BA., Killiam AP., Metzger DA., Haney AF., et al. Immunohistochemical analysis of uterine estrogen and progesterone receptors throughout the menstrual cycle. J Clin Endocrinol Metab. 1988; 67: 334.
- Levin JH., Stanczyk FZ., Lobo RA. Estradiol stimulates the secretion of prostacyclin and thromboxane from endometrial stromal cells in culture. Fertil Steril. 1992; 58: 530.
- Levy C., Robel P., Gautray JP., et al. Estradiol and progesterone receptors in human endometrium: normnal and abnormal cycles and early pregnancy. Am J oBstet Gynecol. 1980; 136: 646.
- Maslar IA. The progesatational endometrium. Semin Reprod Biol. 1988; 6: 115.
- Maslar IA., Riddick DH. Prolactin production by human endometrium during the normal menstrual cycle. Am J Obstet Gynecol. 1979; 135: 751.
- Metzger, DA. Sex steroid effects on the endometrium. Infertil Reprod Clin NA. 1992; 3: 1: 163-186.
- Metzger DA. Regulation of the endometrium. Infertil Reprod Med Clin NA. 1995; 6: 2: 293-301.
- Mularoni A., Mahfoudi A., Beck L. Progesterone control of fibronectin secretion in guinea pig endometrium. Endocrinology. 1992; 13: 2127.
- Noyes RW., Hertig AW., Rock J. Dating the endometrial biopsy. Fertil Steril. 1950; 1: 3.
- Press MF., Udove JA., Greene GL. Progesterone receptor distribution in the human endometrium. Am J Pathol. 1988; 131: 112.
- Roberts DK., Walker NJ., Lavia LA. Ultrastructural evidence of stromal/epithelial interactions in the human endometrial cycle. Am J Obstet Gynecol. 1988; 158: 854.
- Schwarz BE. The production and biologic effects of uterine prostaglandins. Seminars Reprod Endocrinol. 1983; 1:189.
- Speroff L., Glass RH., Kase NG. The uterus. En Speroff L., Glass RH., Kase NG. Clinical Gynecologic Endocrinology and Infertility. Ed. Williams & Wilkins (5a), 1994; 109-139.
- Strauss JF., Gurpiede E. Endometrio: regulación y disfunción. En Yen SSC., Jaffe RB. Endocrinología de la reproducción. Ed. Panamericana (3a). 1993: 333-381.
- Walsh SW. 5-hydroxyeicosatetranoic acid, leukotriene C4, and prostaglandin F2alpha in amniotic fluid before and during term and preterm labor. Am J Obstet Gynecol. 1989; 161: 1352.
- Willborn WH., Flowers CE. Cellular mechanisms for endometrial conservation during menstrual bleeding. Seminars Reprod Endocrinol. 1984; 2: 307.