Dr. Germán Barón Castañeda, M.D.
Sistema TRH/TSH
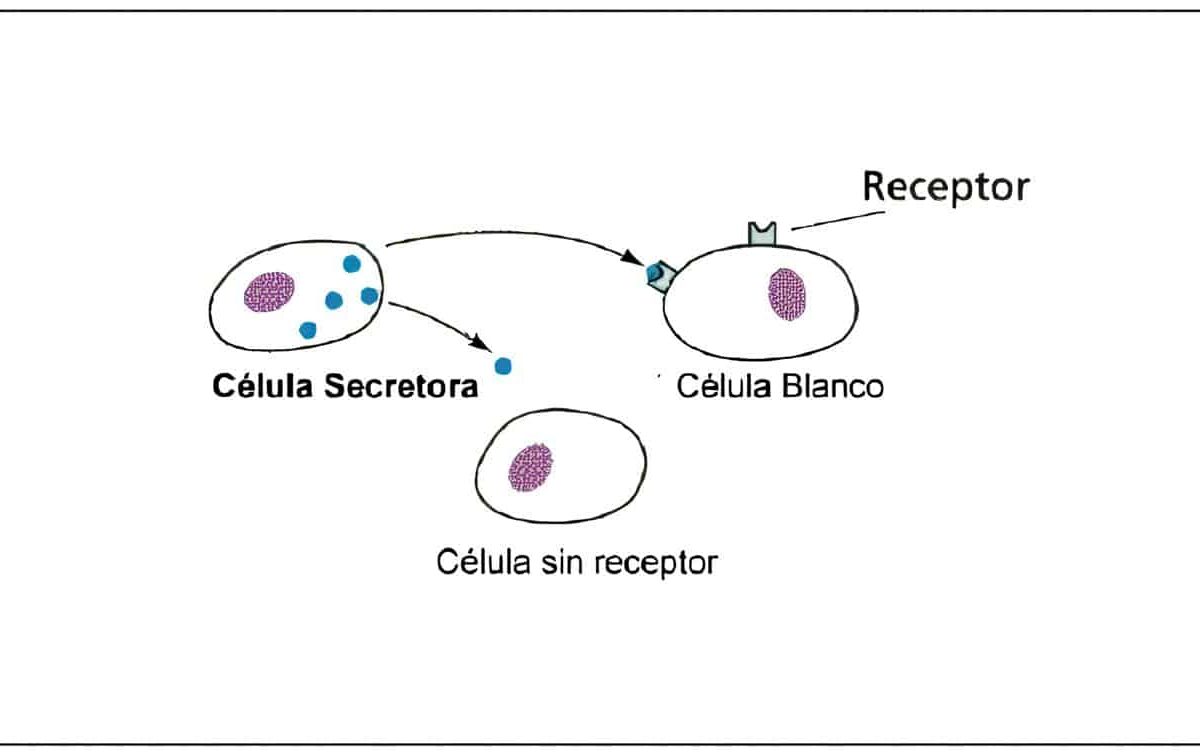
El control hipotalámico de la producción de TSH está regulado por la acción estimuladora de la TRH y la inhibitoria de la somatostatina. Las neuronas productoras de TRH se encuentran localizadas en el núcleo paraventricular y sus axones anidan en la eminencia media.
La acción de la TRH sobre la hipófisis es bloqueada por la exposición a hormonas tiroideas. Además de la liberación de TSH, en la hipófisis la TRH es un potente liberador de prolactina.
Las hormonas tiroideas ejercen un efecto de retroalimentación negativa sobre la producción de TRH. En la hipófisis esta hormona liberadora actúa por un mecanismo similar al de la GnRH, activando el fosfoinositol; su acción la ejerce sobre la membrana sin requerir la “internalización”. La secreción de TSH también puede ser modificada por otras hormonas como los estrógenos, los glucocorticoides y la hormona de crecimiento. Se ha observado aumento en la secreción de TSH con somatostatina y disminución con opioides endógenos.
(Lea También: Fisiología del Ciclo Menstrual)
Sistema Neurohipofisiario
La actividad neurosecretora de los núcleos supraóptico y paraventricular lleva a la producción de oxitocina y vasopresina, cada una de las cuales está unida a una proteína transportadora, la neurofisina. Estas dos hormonas y sus proteínas transportadoras son derivadas de precursores glicoprotéicos, pro-presofisina para la vasopresina y pro-oxifisina para la oxitocina. Las neurofisinas son péptidos grandes, cuya única función conocida hasta el momento es el transporte axonal de las hormonas en mención. Existen dos tipos de neurofisinas, una estimulada por estrógenos o neurofisina I y otra estimulada por nicotina o neurofisina II. En la neurohipófisis también se encuentran pequeños núcleos neuronales productores de TRH, CRH, VIP y neurotensina.
La transcripción de los genes que sintetizan oxitocina y vasopresina se encuentra regulada por factores endocrinos tales como los esteroides sexuales y las hormonas tiroideas.
Se ha demostrado que la oxitocina es capaz de inhibir la producción de progesterona. Induce la liberación de prostaglandina F2a uterina, lo cual puede contribuir a la contracción de la trompa de Falopio y a la luteolisis.
El control central de la liberación de estas hormonas incluye neurotransmisores colinérgicos y adrenérgicos, además de una gama de neuropéptidos.
La acetilcolina estimula la secreción tanto de oxitocina como de vasopresina, a través de receptores nicotínicos.
La influencia noradrenérgica parece actuar a través de dos vías, una a estimuladora y otra b inhibitoria. Los opioides endógenos también intervienen en estas vías a través de receptores que inhiben la liberación de oxitocina y aumentan la de vasopresina. En el núcleo del fascículo solitario se encuentra activina, sustancia que aumenta la liberación de oxitocina.
Las células productoras de oxitocina contienen receptores para estrógenos, los cuales inducen un aumento en la sensibilidad para oxitocina. Influyen en el procesamiento del precursor de la oxitocina.
La angiotensina II juega un papel importante en la regulación de vasopresina. Induce su secreción y por ende la retención de agua. La liberación de vasopresina se encuentra estimulada por la colecistoquinina y por la TRH.
La Glándula Pineal
Aunque hasta el momento no hay un papel definido en los humanos, es posible que el cerebro controle la función reproductiva a través de la glándula pineal. Esta glándula tiene inervación simpática y responde a estímulos ópticos y hormonales y exhibe ritmo circadiano.
La pineal posee una enzima esencial para la síntesis de melatonina, la hidroxindol-o-metiltransferasa, controlada por la norepinefrina.
La asociación de tumores pineales hiperplásicos con disminución en la función gonadal y tumores destructivos con pubertad precoz hacen pensar que esta glándula posee sustancias que inhiben las gónadas. Posiblemente su acción está mediada por el ingreso de melatonina al hipotálamo que inhibe la secreción pulsátil de GnRH.
La pineal contiene receptores para hormonas sexuales tales como estradiol, testosterona, dihidrotestosterona, progesterona y prolactina. Tiene la capacidad de aromatizar andrógenos a estrógenos. El receptor de norepinefrina estimula la síntesis de receptores para andrógenos y estrógenos.
Una posible acción de la glándula pineal puede estar relacionada con la sincronización de los ciclos observada en mujeres que comparten habitación, en amigas cercanas y en compañeras de trabajo.
Las sustancias biológicamente activas producidas por la pineal incluyen norepinefrina, serotonina, histamina y melatonina.
Referencias
- Andersen AN., Hagen C., Lange P., et al. Dopaminergic regulation of gonadotropin levels and pulsatility in normal women. Fertil Steril. 1987; 47: 391.
- Bacchinetti F., Petraglia F., Genazzani AR. Localization and expression of the three opioid systems. Seminars Reprod Endocrinol. 1987; 5: 103.
- Blank MS., Fabbri A., Catt KJ. Inhibition of luteinizing hormone release by morphine and endogenous opiates in cultured-pituitary cells. Endocrinology. 1986; 118: 2027.
- Berga SL., Mortola JF., Girton L. et al. Neuroendocrine aberrations in women with functional hypothalamic amenorrhea. J Clin Endocrinol Metab. 1989; 68: 301.
- Blackwell RE. Neuroendocrinology of reproduction. En Carr BR., Blackwell RE. Textbook of reproductive medicine. Ed Appleton & Lange (1a); 1993: 157-170.
- Bloom FE. Mecanismos neuroendocrinos: células y sistemas. . En Yen SSC., Jaffe RB. Endocrinología de la reproducción. Ed Panamericana (3a); 1993: 20-42.
- Bloom FE. The endorphins: agrowing family of pharmacologically pertinent peptides. Ann Rev Pharm Toxicol. 1983; 23: 151.
- Brownstein MJ., Russel JT., Gainer H. Synthesis, transport, and release of posterior pituitary hormones. Science. 1980; 207: 373.
- Callard GV., Pasmanik M. The role of estrogen as a parahormone in the brain and pituitary. Steroids. 1987; 50: 475.
- Castelbaum A., Doyle M., DeCherney AH. Past, present and future of steroid hormones. Infertil Reproduc Cl NA. 1992; 3: 1: 1-6.
- Chrisitansen E., Veldhuis JD., Rogol AD., et al. Modulating actions of estradiol on gonadotropin-releasing hormone-stimulated prolactin secretion in postmenopausal individuals. Am J Obstet Gynecol. 1987; 157: 320.
- Clark JH. Mechanism of action of steroid hormones and antagonists. Infertil Reproduc Cl NA. 1992; 3: 1: 7-20.
- Conn PM., Crowley WF. Gonadotropin-releasing hormone and its analogues. New Engl J Med. 1991; 324: 93.
- De Souza MJ., Arce JC., Nulsen JC. Effects of exercise training on sex steroids: endocrine profile and clinical implications. Infertil Reprod Clin North Am. 1992; 3: 1: 129 – 148.
- Elsholtz HP. Molecular biology of prolactin: cell-specific and endocrine regulators of the prolactine gene. Seminars Reprod Endocrinol 1992; 10: 183.
- Evans RM. The steroid and thyroid hormone receptor superfamily. Science. 1988; 240: 889.
- Evans WS., Sollenberger MJ., Booth RA. Contemporary aspects of discrete peak-detection algorythms: II. The paradigm of the luteinizing hormone pulse signal in women. Endocr Rev. 1992; 13: 81.
- 18. Filicori M., Santoro M., Merriam GR., et al. Characterization of the physiological pattern of episodic gonadotropin secretion throughout the human menstrual cycle. J Clin Endocrinol Metab. 1986; 62: 1136.
- Fishman J. The cathecol estrogens. Neuroendocrinology. 1976; 4: 363.
- Fishman J., Norton B. Brain catecholestrogens: formation and possible functions. Adv Biosci. 1975; 15: 123.
- Findoff PR., Ferin M. Brain opioid peptides and menstrual cyclicity. Seminars Reprod Endocrinol. 1987; 5: 125.
- Guillemin F. Peptides in the brain: the new endocrinology of the neuron. Science. 1978; 202: 390.
- Harris GW. Induction of ovulation in rabbit by electrical stimulation of hypothalamohypophysial mechanism. Proc Royal Soc Biol. 1937; 122: 374.
- Hanley MR. Peptide regulatory factors in the nervous system. Lancet. 1989; 1: 1373.
- Hayflic JS., Adelman JP., Seeburg PH. The complete nucleotide sequence of the human gonadotropin-releasing hormone gene. Nucleic Acids Res. 1989; 17: 6403.
- Henzl MR., Polan ML. How GnRH agonists were discovered and developed. Infertil Reprod Clin North Am. 1993; 4: 1: 1-8.
- Hohlweg W., Junkmann K. Die hormonal-nervose regullerug der funktion des hypophysen vorderlappens. Klin Wpchschr. 1932; 11: 321.
- Howlett TA., Rees LH. Endogenous opioid peptides and hypothalamo-pituitary function. Ann Rev Physiol. 1986; 48: 527.
- Judd S., Rakoff J., Yen SCC. Inhibiton of gonadotropin and prolactin release by dopamine effect of endogenous estradiol levels. J Clin Endocrinol Metab. 1978; 47: 494.
- Knobil E. The neuroendocrine control of the menstrual cycle. Recent Prog Horm Res. 1980; 36: 53.
- Krieger DT. Brain peptides: what, where, and why? Science. 1983; 22: 975 – 985.
- Linton EA., Lowry PJ. Corticotrophin releasing factor in man and ist measurement: a review. Clin Endocrinol. 1989; 31: 225.
- Loucks AB., Mortola JF., Girton L., et al. Alterations in the hypothalamic-pituitary-ovarian and the hypothalamica-pituitary-adrenal axes in athletic women. J Clin Endocrinol Metab. 1989; 68: 402.
- Marsall JC., Dalkin AC., Haisemleder DJ. Gonadotropin-releasing hormone pulses: regulators of gonadotropin synthesis and ovulatoru cicles. Recent Prog Horm Res. 1991; 47: 155.
- Metcalf G., Jackson IMD. Thyrotropin-releasing hormone: biomedical significance. Ann NY Acad Sci. 1989; 553: 1.
- Nikolics K., Mason AJ., Szony E., et al. A prolactin-inhibiting factor within the precursor for human gonadotropin-releasing hormone. Nature. 1985; 316: 511.
- Palkovits M. Anatomy of neural pathways affecting CRH secretion. Ann NY Acad Sci. 1987; 512; 139.
- Pavlou SN. The mechanism of action of GnRH agonists. Infertil Reprod Clin North Am. 1993; 4: 1: 9-20.
- Rasmussen DD., Gambacciani M., Swartz W., et al. Pulsatile gonadotropin-releasing hormone release from the human mediobasal hypothalamus in vitro: opiate receptor-mediated supression. Neuroendocrinology. 1989; 49: 150.
- Reame N., Sauder SE., Kelch RP., et al. Pulsatile gonadotropin secretion durin the human menstrual cycle: evidence for altered frequency of gonadotropin-releasing hormone secretion. J Clin Endocrinol Metab. 1984; 59: 328.
- Reeves WB., Andreoli TE. The posterior pituitary and water metabolism. En Wilson JD., Foster DW (eds). Williams Textbook of Endocrinology. W.B. Saunders Co (8a), 1992: 311 – 356.
- Reichlin S. Neuroendocrinology. En Wilson JD., Foster DW (eds). Williams Textbook of Endocrinology. W.B. Saunders Co (8a), 1992: 135 – 220.
- Reisine T. Neurohormonal aspects of ACTH release. Hosp Prac. 1988; 15: 77.
- Reiter RJ. Pineal melatonin: cell biology of its synthesis and of its physiological interactions. Endocr Rev. 1991; 12: 151.
- Rivier C., Rivier J., Vale W. Stress-induced inhibiton of reproductive functions: role of endogenous corticotropin-releasing factor. Science. 1986; 231: 606.
- Roberts V., Meunier H., Vaughan J., et al. Production and regulation of inhibin subunits in pituitary gonadotropes. Endocrinology. 1989; 124: 552.
- Schwanzel-Fukuda M., Pfaff DW. Origin of luteinizing hormone-releasing hormone neurons. Nature. 1989; 338: 161.
- Schwartz J., Cherny R. Intercellular communication within the anterior pituitary influencing the secretion of hypophysial hormones. Endocrin Rev. 1992; 13: 453.
- Sherwood NM., Lovejoy DA., Coe IR. Origin of mammalian gonadotropin- releasing hormones. Endocr Rev. 1993; 14: 241.
- Speroff L., Glass RH., Kase NG. Neuroendocrinology. En Speroff L., Glass RH., Kase NG. Clinical Gynecologic Endocrinology and Infertility. Ed. Williams & Wilkins (5a), 1994; 141 – 181.
- Soules MR., Steiner RA., Cohen NL., et al. Nocturn slowing of pulsatile luteinizing hormone secretion in women during the follicular phase of the menstrual cycle. J Clin Endocrinol Metab. 1985; 61: 43.
- South SA., Yankov VI., Evans WS. Normal reproductive neuroendocrinology in the female. Endocrinol Metab Clin North Am. 1993; 22: 1: 1-28.
- Suh BY., Liu JH, Berga SL., et al. Hypercortisolism in patients with functional hypothalamic amenorrhea. J Clin Endocrinol Metab. 1988; 66: 733.
- Tannenbaum GS., Ling N. The interrelationship of growth hormone (GH)-releasing factor and somatostatin in generation of the ultradian rythm of GH secretion. Endocrinology. 1984; 115: 1952.
- Thorner MO., Vance ML., Horvath E., et al. The anterior pituitary. En Wilson JD., Foster DW (eds). Williams Textbook of Endocrinology. W.B. Saunders Co (8a), 1992: 221 – 310.
- Waring DW., Turgeon JL. A pathway for luteinizing hormone releasing-hormone self-potentiation: cross-talk with the progesterone receptor. Endocrinology. 1992; 130: 3275.
- Yen SCC. Control hipotalámico de la secreción de las hormonas hipofisiarias. . En Yen SSC., Jaffe RB. Endocrinología de la reproducción. Ed Panamericana (3a); 1993: 85-125.
- Zimmernann RC., Schumacher M., Schroder S. Melatonin and the ovulatory luteinizing hormone surge. Fertil Steril. 1990; 54: 612.