Urología
Los tumores testiculares de células germinales (TTCG) pueden ser divididos en seminomatosos y no seminomatosos. Los TTCG representan el 95% de los tumores testiculares. En 1998 se reportaron 65 casos nuevos en el Instituto Nacional de Cancerología, que representan el 1,3% del total de los pacientes vistos por primera vez en ese año.
La gran mayoría de estos tumores son primarios del testículo, pero también existen los de origen extragonadal (mediastino, retroperitoneo y glándula pineal).
Los TTCG son un tipo muy particular de tumor, por su alta sensibilidad a la quimioterapia, y en ellos la intención del tratamiento es siempre curativa, independiente del estado clínico en el momento del diagnóstico. El pronóstico ha mejorado gracias a los resultados del manejo multidisciplinario. (Ver también: Cirugía Mínimamente Invasora)
Epidemiología
El cáncer testicular es el tumor más frecuente en el hombre joven entre 20 y 35 años. Su incidencia se ha duplicado a nivel mundial en los últimos 40 años. El seminoma se presenta más frecuentemente en la década de los cuarenta y los tumores no seminomatosos aproximadamente una década más temprano.
Etiopatogenia
Hay evidencia parcial de inductores y promotores hormonales en el desarrollo de los TTCG. La gonadotropina provee un camino final común en el desarrollo de los TTCG. Las mutaciones en los receptores de la coriogonadotrofinas y hormona luteinizante en un tejido atrófico de epitelio germinal contribuyen al desarrollo de los TTCG.
La criptorquidia es un factor de riesgo bien establecido, con un riesgo relativo entre 2,5% y 14%. Un testículo intra-abdominal tiene un riesgo mayor, más que uno localizado en la región inguinal. Aproximadamente uno de diez pacientes que desarrollan TTCG tienen historia previa de criptorquidia.
El carcinoma in situ, o neoplasia intratubular, es identificada hasta en un 5% en el testículo contralateral en los pacientes con cáncer de testículo. El carcinoma in situ de testículo es actualmente reconocido como la lesión precursora del carcinoma invasor.
Otros factores, entre ellos trauma, parotiditis e infertilidad, han sido inculpados como factores etiológicos, pero no han sido comprobados. Recientemente se ha informado una mayor incidencia de TTCG en pacientes inmunosuprimidos, interesados por VIH o en pacientes que reciben ciclosporina luego de un trasplante renal. Los análisis de citogenética en células tumorales de tumores germinales han mostrado una anomalía consistente en el isocromosoma del brazo corto del cromosoma 12.
Cuadro Clínico
El hallazgo clínico inicial más frecuente es la presencia de una masa testicular que usualmente es asintomática, pero no es raro encontrar manifestaciones clínicas de en fermedad metastásica. Lumbalgia relacionada con la presencia de metástasis retroperitoneal, tos y disnea por diseminación mediastinal y/o pulmonar, adenopatías supraclaviculares o ginecomastia como una manifestación paraneoplásica.
Diagnóstico
Imágenes
El ultrasonido testicular es de gran utilidad. Es una técnica no invasora que puede diferenciar entre lesiones de 2-3 mm hipo-ecogénicas tumorales y no tumorales, con una sensibilidad cercana al 100%.
La tomografía axial computadorizada (TAC) es fundamental en el estudio de la enfermedad infradiagmática. La resonancia magnética nuclear (RMN) no suele aportar más que la TAC y debe ser reservada para protocolos de evaluación de imágenes.
Tomando en consideración la frecuencia de la diseminación pulmonar y el interés de la exploración mediastinal, se deben hacer radiografía de tórax y TAC pulmonar en los TTCG no-seminomatosos. La TAC torácica no está justificada en los tumores cuyo TAC abdominal es normal.
Marcadores tumorales o marcadores oncofetales
La gonadotropina coriónica humana (hCG), la alfa-fetoproteina (alfa-FP) y la deshidrogenasa láctica (LDH) son de ayuda para el diagnóstico, tienen valor pronóstico para determinar la respuesta terapéutica y pueden dar una estimación precoz de la evolución de la enfermedad mucho antes que la clínica o las imágenes. Su medición debe ser realizada antes y después de la orquidectomía, así como durante el tratamiento y seguimiento.
La unidad alfa de la hCG es común a otras hormonas de la pituitaria anterior; de allí que la medición de la unidad beta de la hCG sea más específica. Un nivel anormal de beta-hCG se relaciona con TTCG.
Sin embargo, un valor alto de hCG ha sido descrito en otros cánceres (gástrico, pancreático, ovario, seno, pulmón y carcinoma hepatocelular). La alfa-FP es producida por los componentes del saco vitelino, pero también por hepatocitos y células del tracto gastrointestinal.
Todos estos diferentes orígenes explican que la alfa-FP no sea específica de TTCG. La alfa-FP puede estar elevada en relación con enfermedades no malignas (hepatitis viral), lo que puede llevar al diagnóstico falso de recaída de TTCG. En el plasma de pacientes con TTCG la vida media de la beta hCG es de 18 a 36 horas y la de la alfa-FP de 5 a 7 días.
Esta vida media debe ser tenida en cuenta en la interpretación de los valores séricos. Hasta en un 20% de los seminomas pueden encontrarse niveles elevados de hCG y frecuentemente niveles elevados de LDH. La diferenciación trofoblástica se asocia con producción de hCG, y la diferenciación hacia el compromiso del seno endodérmico con producción de AFP
Clasificación Histopatológica
La evaluación histológica del espécimen de la orquidectomía radical debe ser usada para la clasificación del pT. Se dividen en seminomatosos (espermatocítico, clásico y con células del sinsitio trofoblástico) y no seminomatosos (carcinoma embrionario, teratoma – maduro o inmaduro con transformación maligna,- coriocarcinoma, tumor del saco vitelino, tumor del seno endodérmico).
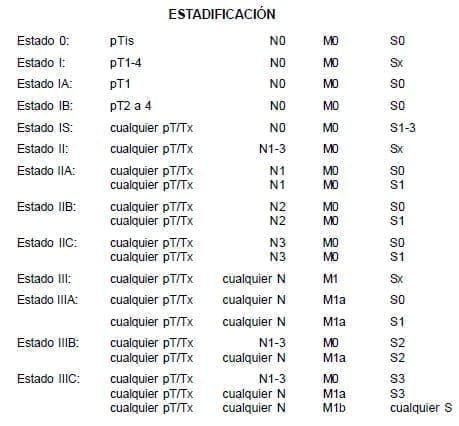
La extensión del tumor primario es clasificada por el método TNM, después de orquidectomía radical, así:
Tumor Primario (pT)
pTx Tumor primario no puede ser evaluado (si la orquidectomía radical no ha sido realizada, se utiliza el Tx).
pTo No evidencia de tumor primario (cicatriz histológica en el testículo).
pTis Neoplasia de células germinales intratubular (carcinoma in situ).
pT1 Tumor limitado al testículo y epidídimo, sin invasión vascular (sanguínea/linfática). El tumor puede invadir la túnica albugínea, pero no la túnica vaginal.
pT2 Tumor limitado al testículo y epidídimo, con invasión vascular (sanguínea/linfática) o el tumor se extiende a través de la túnica albugínea, con compromiso de la túnica vaginal.
pT3 Tumor invade el cordón espermático, con o sin invasión vascular (sanguínea/ linfática).
pT4 Tumor invade el escroto, con o sin invasión vascular (sanguínea/linfática).
Ganglios Linfáticos Regionales (N)
pNx Ganglios linfáticos regionales no pueden ser evaluados.
pN0 Sin metástasis en los ganglios linfáticos regionales.
pN1 Metástasis con una masa ganglionar linfática de 2 cm o menos en su diámetro mayor o hasta 5 ganglios positivos, ninguno mayor de 2 cm en su diámetro mayor.
pN2 Metástasis con una masa ganglionar linfática mayor de 2 cm pero no más de 5 cm de diámetro mayor o más de 5 ganglios positivos, ninguno mayor de 5 cm o evidencia de extensión extraganglionar del tumor.
pN3 Metástasis con una masa ganglionar linfática mayor de 5 cm en el diámetro mayor.
Metástasis (M)
Mx Metástasis a distancia no puede ser evaluada.
Mo Sin metástasis a distancia.
M1 Metástasis a distancia.
M1a Metástasis pulmonares o ganglionares no regionales.
M1b Metástasis distantes, diferentes a las pulmonares y ganglionares linfáticas no regionales. Marcadores séricos (S)
Sx Determinación de marcadores no disponible o no realizada.
S0 Niveles de marcadores dentro de límites normales.
S1 LDH menor 1,5 de lo normal y
HCG menor de 5.000 mIu/ml, y
AFP menor de 1.000 ng/ml. S2 LDH 1,5 a 10 veces de lo normal o HCG 5.000 a 50.000 mIu/ml, o AFP 1.000 a 10.000 ng/ml.
S3 LDH mayor de 10 de lo normal o
HCG mayor de 50.000 mIu/ml o
AFP mayor de 10.000 ng/ml
Factores Predictores de Pronóstico:
Los factores predictores de enfermedad metastásica más importantes en estado I no seminoma son la invasión vascular (sanguínea y/o linfática) y el porcentaje de carcinoma embrionario en el producto de la orquidectomía.
En pacientes con enfermedad metastásica, los factores más importantes predictores de respuesta a una quimioterapia son la localización de la metástasis visceral (pulmonar o no pulmonar) y el nivel de marcadores séricos.
Clasificación pronóstica de consenso de IGCCCG (tabla 1)
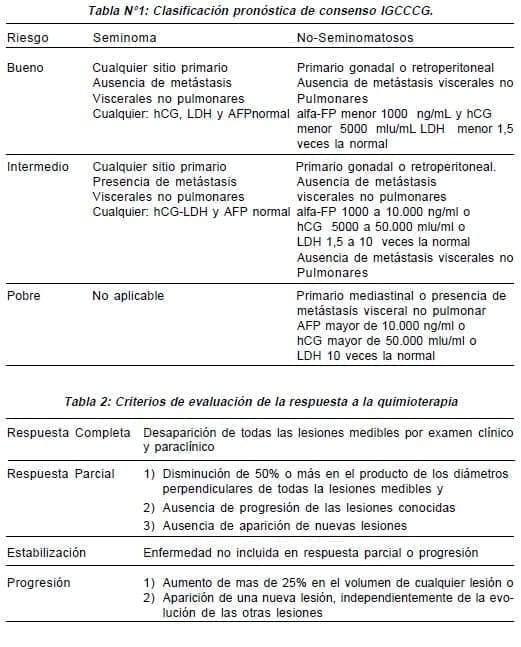
A cinco años, la supervivencia libre de enfermedad (SLE) de todos los pacientes fue de 75% y la supervivencia global (SG) de 80%. Los factores pronósticos más importante de los TTCG no seminomatosos para la SLE y la SG fueron: el sitio de origen primario (gonadal y retroperitoneal vs mediastinal), la presencia de metástasis viscerales no pulmonares y el nivel de marcadores tumorales.
La asociación de estas variables ha permitido la separación de los TTCG no seminomatosos en 3 grupos pronósticos de acuerdo a las supervivencia a cinco años:
- Bajo riesgo: SLE de 81% y SG de 92%
- Riesgo intermedio: SLE de 75% y SG de 80%
- Alto riesgo: SLE de 41% y SG de 48% En seminoma, el mejor factor pronóstico para predecir la SLE y la SG fue la presencia de metástasis viscerales no pulmonares. Solo se definieron dos grupos pronósticos, también con tasas de supervivencia a cinco años:
- Bajo riesgo: SLE de 82% y SG de 88%
- Riesgo Intermedio: SLE de 67% y SG de 72%
Tratamiento
El manejo de lesión primaria: es orquidectomía radical (orquiectomía por vía inguinal con ligadura del cordón espermático a nivel del anillo inguinal profundo).
Seminoma Estado I (T1-4 N0 M0 S0)
Radioterapia infradiagmática: se realiza irradiación paraórtica y pélvica ipsilateral de 25-
Gy. La supervivencia libre de enfermedad supera el 95% a 5 años (nivel III de evidencia).
Estado II (Cualquier T N1-2 M0 y SO-1)
Se realiza radiación paraórtica y pélvica ipsilateral, pero con una dosis mayor en el área ganglionar comprometida, con dosis que oscilan entre 24 y 30 Gy.
Estado II (Cualquier T N3 M0 y cualquier S)
Quimioterapia (PEB).
Estado III (Cualquier T cualquier N M1 y cualquier S)
El tratamiento es la quimioterapia PEB:
Cisplatino 20 mg/m2 IV, días 1 a 5
Etopósido 100 mg/m2 IV, días 1 a 5
Bleomicina 30 UI/IV, días 2, 8 y 15
Tres ciclos en los pacientes de bajo riesgo y 4 ciclos a los de riesgo moderado. La SLE es de 70 a 90% a 5 años (nivel de evidencia IV).
Masa residual postquimioterapia
Pacientes con masa residual menor de 3 cm, al igual que aquellos que alcanzan una respuesta completa, son dejados en observación. Existe controversia en el manejo de las masas residuales mayores de 3 cm o más; nuestra recomendación es dejar en observación y vigilancia estricta, ya que la mayoría de estas masas no contienen tumor maligno viable.
La recaída postquimioterapia de primera línea se trata con quimioterapia de segunda línea: 4 ciclos de VeIP con la cual se alcanzas supervivencias de alrededor del 50%.
No seminoma
Estado I (Cualquier T N0 M0 S0) En el estado I la linfadenectomia retroperitonieal es considerada como primera opción. El seguimiento con solo observación puede ser una conducta alternativa, únicamente en aquellos pacientes que puedan cumplir todas las citas con determinación de marcadores tumorales y estudios de imageneología solicitados.
Estado II (Cualquier T N1-3 MO S0-1) Tratamiento con quimioterapia con base en el esquema PEB en número de 3 ciclos. Masas residuales luego de quimioterapia, con marcadores negativos, deben ser extirpadas.
Estado III (Cualquier T cualquier N, M1 y cualquier S) Quimioterapia PEB: el número de ciclos de acuerdo con el riesgo.
Pacientes con masa residual y marcadores normales postquimioterapia son considerados para cirugía citorreductora. La necesidad de tratamiento subsiguiente dependerá del tipo de lesión histológica encontrada en esta masa. En pacientes con marcadores elevados postquimioterapia, la quimioterapia de rescate VeIP, si el esquema de primera línea fue PEB.
(Lea También: Cáncer de Próstata)
Quimioterapia en Altas Dosis (Qad) en Ttcg No Seminomatosos
Un 90% de los pacientes alcanza una remisión completa (RC) luego de una primera línea de quimioterapia; el rescate convencional, luego de una primera línea, sólo logra una SLE de 20 a 25%. La QAD es un procedimiento relativamente seguro después de la introducción de los factores estimulantes de crecimiento hematopoyético y la mejor estra tegia en antibioticoterapia y el soporte de células pluripotenciales de médula ósea o sangre periférica.
A pesar que los TTCG refractarios sometidos a QAD sólo logran un 15% de aumento en la supervivencia global, por lo pronto es el único y mejor ejemplo en oncología de la eficacia en el aumento de la dosis de los mismos medicamentos que fueron utilizados previamente.
La definición de enfermedad refractaria fue establecida por el grupo de Indiana: es una enfermedad en progresión mientras reciba una combinación óptima de cisplatino, o que progrese durante un mes luego de la última dosis de cisplatino (Mensel PJ, et al, 1994). El carboplatino y el etopósido son los medicamentos más activos disponibles en este momento.
La adición de un tercer agente antineoplásico, como la Ifosfamida y/o ciclofosfamida, no ha ofrecido mayor beneficio, pero sí mayor toxicidad renal, requiriendo en algunos casos hemodiálisis.
Este tipo de tratamiento es mejor tolerado como primera línea de rescate, o mejor aún como primera línea de tratamiento en TTCG de riesgo alto, pero los beneficios en la supervivencia global están en curso de evaluación en protocolos aleatorios de Fase III.
Se ha establecido que el único factor independiente capaz de predecir una SLE a largo plazo, posterior a la QAD, es la sensibilidad del tumor a la quimioterapia convencional con cisplatino. Esto servirá en un futuro para seleccionar aquellos pacientes con posibilidades de buenos resultados con QAD.
Toxicidad del tratamiento
Los antineoplásicos más usados en la terapia de los TTCG son cisplatino, bleomicina, etopósido, vinblastina e ifosfamida. La toxicidad limitante de dosis común a la mayoría de estos citostáticos es la mielosupresión, que puede ser controlada con factores de crecimiento hematopoyético (G-CSF o GM-CSF). La nefrotoxicidad y la hipomagnasemia son frecuentes. Todas las toxicidades deben ser evaluadas según los criterios de la Organización Mundial de la Salud.
Toxicidad aguda y crónica
Neuropatía periférica
Inducida por cisplatino, se semeja a la neuropatía por deficiencia de vitamina B-12; es de dosis acumulativa y se recupera parcialmente luego de finalizada la quimioterapia. Puede ser producida también por la vinblastina, con disfunción principalmente sensorial.
Ototoxicidad
También la produce el cisplatino y se asimila a la toxicidad causada por los aminoglicósidos. Produce la pérdida de la audición para los tonos de alta frecuencia, se observa en un tercio de los pacientes tratados con cisplatino.
Toxicidad pulmonar
A las dosis usuales, la bleomicina exhibe toxicidad pulmonar en 2% de los casos. Esta se puede manifestar por neumonitis intersticial subaguda o crónica, la cual puede ser agudizada por radioterapia previa del parénquima pulmonar, por administración de oxíge no en alta concentración, por la edad del paciente y por la dosis total de bleomicina (mayor de 400 Unidades).
Toxicidad tardía
Fertilidad
Los pacientes con cáncer testicular tienen reducida su fertilidad. En muchos pacientes, se ha informa una disfunción en las células de Leydig con elevados niveles de LH. Posterior a la orquidectomía, 75 a 80% de los pacientes tienen recuentos subnormales de espermatozoides o anomalías en su motilidad. Normalmente la función sexual (erección, líbido y orgasmo) no sufre alteraciones luego del tratamiento.
La morbilidad tardía a largo plazo más importante como resultado de la resección linfática retroperitoneal es la pérdida de la eyaculación y, consecuentemente, del potencial de fertilidad; las nuevas técnicas de preservación neural logran conservar una eyaculación anterógrada en más del 95% de los casos, pero la quimioterapia reduce el recuento de espermatozoides.
Alrededor de 40% de los pacientes que desean tener hijos pueden lograrlo luego de una quimioterapia convencional. Por otra parte, los niños cuyos padres han sido tratados por TTCG no tienen riesgo aumentado de anomalías congénitas. Una completa y oportuna información por parte del oncólogo clínico tratante antes, durante y luego de la terapia es esencial para el mejor manejo de estos problemas.
Efectos psicológicos
Los pacientes que han respondido al tratamiento inicial, evolucionan psicológicamente bien. Sin embargo, los pacientes tratados por recaída frecuentemente desarrollan problemas psicosociales, ansiedad, insomnio, irritabilidad y depresión.
Segundas neoplasias
Se ha descrito un riesgo aumento de segundas neoplasias en los pacientes tratados por TTCG. Se ha reportado un aumento con el riesgo relativo de desarrollar leucemia secundaria al uso del etopósido. El riesgo de un segundo TTCG contralateral es bajo y el de otro tumor sólido antes de los diez años de finalizado el tratamiento no está comprobado. Luego de los diez años, el riesgo relativo de segundas neoplasias no es mayor al de cualquier otro tumor curado con quimioterapia o radioterapia.
Seguimiento
Se debe practicar examen físico completo en forma rutinaria, con especial atención a las áreas ganglionares y al testículo contralateral; niveles séricos de marcadores y radiografía simple de tórax y TAC abdominopélvica, de acuerdo a cada caso partícular. En el primer año, debe realizarse cada dos meses, en el segundo año cada cuatro meses, del tercero al quinto año cada seis meses y luego, anualmente.
Lecturas Recomendadas
- 1. BERNARDI D, SALVIONI R, VACCHER E, ET AL. Testicular germ cell tumors and human immunodeficiency virus infection: a report of 26 cases. J Clin Oncol 1995; 13:2705-11.
- 2. BEYER J, KRAMAR A, MANDANOS R, ET AL. High-dose chemotherapy as salvage treatment in germ cell tumors: A multivariate analysis of prognostic variables. J Clin Oncol 1996; 14:2638-45.
- 3. BOKEMEYER C, SCHMOLL HJ, KUCZYK MA, ET AL. Risk of secondary leukemia following high cumulative doses of etoposide during chemotherapy for testicular cancer. J Natl Cancer Inst 1995; 87:58-60
- 4. BOKEMEYER C AND SCHMOLL HJ . Treatment of testicular cancer and the development of secondary malignancies. J Clin Oncol l995; 13:283-92.
- 5. BOSL GJ, ILSON DH, RODRIGUEZ E, ET AL. Clinical relevance of the i(12p) marker chromosome in germ cell tumors. J Natl Cancer Inst 1994; 86:349-55.
- 6. BOSL GJ AND MOTZER RJ. Testicular germ-cell cancer. N Engl J Med 1997; 337:242-53.
- 7. BOWER M, NEWLANDS ES, HOLDEN L, ET AL. Treatment of men with metastatic non-seminomatous germ cell tumors with cyclical POMB/ACE chemotherapy. Ann Oncol 1997; 8:477-83.
- 8. CULINE S, KRAMAR A, BIRON P, DROZ JP. Chemotherapy in adult germ cell tumors. Critical Rev Oncol/ Hematol 1996; 22:229-63.
- 9. EINHORN LH. Salvage therapy for germ cell tumors. Semin Oncol 1994; 21:47-51.
- 10. GERL A, CLEMM C, SCHMELLER N, ET AL. Late relapse of germ cell tumors after cisplatin-based chemotherapy. Ann Oncol 1997; 8:41-7.
- 11. HERR HW, SHEINFELD J, PUC HS, ET AL. Surgery for a post-chemotherapy residual mass in seminoma. J Urol 1997; 157:860-62.
Referencias
- 12. HORWICH A, SLEIJFER DT, FOSSA SD, ET AL: Randomized trial of bleomycin, etoposide, and cisplatin compared with bleomycin, etoposide, and carboplatin in good-prognosis metastatic nonseminomatous germ cell cancer: a multi-institutional Medical Research Council/European Organization for Research and Treatment of Cancer trial. J Clin Oncol 1997; 15:1844-52.
- 13. IGCCG INTERNATIONAL GERM CELL CANCER COLLABORATIVE GROUP. International germ cell consensus classification: a prognostic factor-based staging system for metastatic germ cell cancers. J Clin Oncol 1997; 15:594-603.
- 14. LAI PP, BERNSTEIN MJ, KIM H, ET AL. Radiation Therapy for stage I and IIA testicular seminoma. Int J Radiat Oncol Biol Phys 1994; 28:337-79.
- 15. LAMPE H, HORWICH A, NORMAN A, DEARNALEY DP. Fertility after chemotherapy for testicular germ cell cancers. J Clin Oncol 1997; 15: 239-45.
- 16. MASTOFI FK AND SESTERHENN IA. Revised international classification of testicular tumors. In : Jones W.G, Harnden P, Appleyard I, (eds). Germ cell tumors III. Vol 91 of Advances in the biosciences. Oxford: Pergamon Press; 1994.p.153-8.
- 17. MENCEL PJ, MOTZER RJ, MAZUMDAR M, ET AL. Advanced seminoma: treatment results, survival, and prognostic factors in 142 patients. J Clin Oncol 1994; 12:120-6.
- 18. MOTZER RJ, MAZUMDAR M, BAJORIN DF, ET AL. High-dose carboplatin, etoposide, and cyclophosphamide with autologous bone marrow transplantation in first-line therapy for patients with poor-risk germ cell tumors. J Clin Oncol 1997; 15:2546-52.
- 19. MOTZER RJ, GULATI SC, CROWN JP, ET AL. High-dose chemotherapy and autologous bone marrow rescue for patients with refractory germ cell tumors. Early intervention is better tolerated. Cancer 1992; 69:550-6.
- 20. MURTY VVS AND CHAGANTI RSK. A genetic perspective of male germ cell tumors. Sem Oncol 1998; 25:133-44.
Bibliografías
- 21. PICO JL, FADEL E, IBRAHIM A, ET AL: High-dose chemotherapy followed by hematological support: experience in the treatment of germ cell tumors. Bull Cancer 1995; 82 Suppl 1:56s-60s.
- 22. PONT J, ALBRECHT W, POSTNER G, ET AL. Adjuvant chemotherapy for high-risk clinical stage I nonseminomatous testicular germ cell cancer: long-term results of a prospective trial. J Clin Oncol 1996; 14:441-8.
- 23. PUC HS, HEELAN R, MAZUMBAR M, ET AL. Management of residual mass in advanced seminoma: results and recommendations from the Memorial Sloan-Kettering Cancer Center. J Clin Oncol 1996; 14:454-60.
- 24. TIMMERMAN JM, NORTHFELT DW, SMALL EJ. Malignant germ cell tumors in men infected with the human immunodeficiency virus: natural history and results of therapy. J Clin Oncol 1995; 13:1391-97.
- 25. TONER GC AND MOTZER RJ. Poor prognosis germ cell tumors: current status and futur directions. Sem Oncol 1998; 25:194-202.
- 26. VALLIS KA, HOWARD GC, DUNCAN W, ET AL. Radiotherapy for stages I and II testicular seminoma: results and morbidity in 238 patients. Br J Radiol 1995; 68:400-5.